Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.15 no.1 Chapingo ene./abr. 2009
Sensibilidad de inmunoimpresión–ELISA y DAS–ELISA en el diagnóstico y muestreo del virus de la tristeza de los cítricos en huertos comerciales de Tamaulipas, México
Reliability of direct tissue blot–ELISA and DAS–ELISA in the detection of Citrus tristeza virus and sampling in commercial orchards in Tamaulipas, Mexico
N. Ruiz–García1, G. Mora–Aguilera1*, P. Rivas–Valencia1, C. Góngora–Canul1, E. Loeza–Kuk1, D. Ochoa Martínez1, G. Ramírez–Valverde2, M. A. Gutiérrez–Espinosa3 y R. Álvarez–Ramos4
1 Progama de Fitopatología. Campus Montecillo. Colegio de Postgraduados, Km. 36.5 Carretera México–Texcoco,Montecillo, Estado de México. C. P. 56230. México.
2 Progama de Estadística. Campus Montecillo. Colegio de Postgraduados, Km. 36.5 Carretera México–Texcoco,Montecillo, Estado de México. C. P. 56230. México.
3 Progama de Fruticultura. Campus Montecillo. Colegio de Postgraduados, Km. 36.5 Carretera México–Texcoco,Montecillo, Estado de México. C. P. 56230. México.
4CFICET–Campo Agrícola Experimental Gral. Francisco Villa. Cd. Victoria, Tamaulipas. Correo–e: morag@colpos.mx (*Autor responsable).
Recibido: 24 de septiembre, 2007
Aceptado: 29 de agosto, 2008
Resumen
El Virus de la tristeza de los cítricos (VTC) causa una enfermedad de interés regulatorio para la citricultura mexicana. El diagnóstico y un muestreo oportuno y confiable es esencial para aplicar estrategias de manejo ante el avance en territorio nacional del pulgón café, su principal vector. Con el fin de contar con un método eficaz y eficiente para el muestreo y detección del VTC, se evaluó el desempeño del método de inmunoimpresión–ELISA con respecto a DAS–ELISA, el método oficial de diagnóstico, debido a su economía, facilidad y rapidez. Con este propósito se evaluaron 7,421 árboles, considerando la edad del brote y de infección, provenientes de 11 huertos comerciales de Tamaulipas. El método de inmunoimpresión–ELISA superó en sensibilidad y capacidad de pronóstico de positivos a DAS–ELISA en el diagnóstico de árboles con infección reciente o desconocida del VTC (P≤0.028). La disposición de brotes positivos en el dosel fue heterogénea siendo descrita por la función beta binomial (P≤0.16–0.23). Con base en esta función y la reproducción de los resultados de impresiones dobles por pecíolo (93.2%) se sugiere un tamaño óptimo de muestra de 10 pecíolos por árbol en impresiones simples. Este método fue 54.9% más económico que DAS–ELISA y los diagnósticos se realizaron en una sexta parte del tiempo requerido en esta última prueba. Sin embargo, por el requerimiento de la norma oficial mexicana vigente (NOM–031–FITO–2000), se recomienda el método de inmunoimpresión–ELISA como un método rápido para discriminar árboles positivos en muestreos de campo que deben posteriormente ser verificados por el método oficial de diagnóstico.
Palabras clave: Citrus sinensis, virus, serología, diagnóstico.
Abstract
The Citrus tristeza virus (CTV) causes a disease of regulatory interest for the Mexican citriculture. Timely and reliable sampling and diagnosis is essential for management strategies to check the spread of the brown citrus aphid, its main vector, in national territory. Because it is cheap and operationally feasible, direct tissue blot immunoassay–ELISA was compared with to DAS–ELISA, the official method for diagnosis, in order to establish an effective and efficient method for CTV detection. For the comparison, a total of 7421 trees of 11 commercial orchards of Tamaulipas, grouped by budding and infection age were tested. The direct tissue blot immunoassay technique was more sensitive and more capable of positive prognosis than DAS–ELISA in the diagnosis of CTV (P≤0.028) in trees with recent and unknown infection. Buds diagnosed positive were heterogeneously distributed throughout the canopy, described by the beta binomial function (P≤0.16–0.23). Based on this function and the reproducibility (93.2%) of the results of double petiole printing suggested an optimal sample size of 10 petioles in single print. This method was 54.9% more economical than DAS–ELISA and the diagnoses require only 17% of the time invested for DAS–ELISA. However, due to the requirements of the current Mexican official norm (NOM–031–FITO–2000), this method is recommended as a fast technique to discriminate positive trees in field sampling to be later verified with the official method of diagnosis.
Key words: Citrus sinensis, virus, serology, diagnosis.
INTRODUCCIÓN
En México, el diagnóstico del Virus de la tristeza de los cítricos (VTC) en programas oficiales de muestreo y erradicación se realiza con el método serológico DAS–ELISA (double–antibody sandwich enzyme–linked immunoabsorbent assay). Los anticuerpos monoclonales 3DF1 y 3CA5 empleados son capaces de detectar la mayoría de los aislamientos mexicanos del VTC (Silva et al., 2002). Este método serológico discrimina la mayoría de las plantas con virus de aquellas sin el virus (Mathews et al., 1997). Sin embargo, por el procesamiento de una gran cantidad de muestras en una campaña fitosanitaria, este método es costoso porque requiere de laboratorio, equipo y personal acreditado. Adicionalmente, se retrasa el diagnóstico por la gran cantidad de tiempo requerido para el procesamiento del tejido vegetal (Cambra et al., 2000). La disponibilidad comercial del método de inmunoimpresión–ELISA ha resuelto el problema de la infraestructura y oportunidad en el diagnóstico (Cambra et al., 2000). Sin embargo, en México se conoce sólo un estudio de validación de inmunoimpresión–ELISA (Loredo y Peña, 2002). Por el contrario, se han realizado estudios de reacción específica de aislamientos severos con DAS–ELISA (Silva et al., 2001), así como estudios comparativos de calidad de antisueros comerciales en condiciones de laboratorio (Iracheta et al., 2005). El objetivo del presente estudio fue determinar el desempeño (sensibilidad, capacidad de pronóstico y concordancia) del método de inmunoimpresión–ELISA con respecto a DAS–ELISA, así como determinar las condiciones de operación: edad del brote, tiempo transcurrido desde la infección y número de brotes por muestra, con el fin de contar con una alternativa al método DAS–ELISA que sea confiable, económica y oportuna en el diagnóstico del VTC en plantaciones comerciales de cítricos.
MATERIALES Y MÉTODOS
Colecta de tejidos
Cada muestra consistió de seis a ocho brotes tiernos por árbol con al menos dos hojas de la parte media del brote, colectados uniformemente en la periferia del dosel de cada árbol a una altura de 1.5 metros. Las muestras se colocaron en bolsas de polietileno debidamente etiquetadas y se trasladaron al laboratorio acreditado de diagnóstico de VTC del Comité para el Fomento e Investigación Citrícola del Estado de Tamaulipas (CFICET), donde se guardaron a 4 °C hasta su proceso. Las muestras se clasificaron por su historial con respecto a la infección de VTC. Positivos históricos: esta población consistió de 157 árboles positivos identificados previamente empleando DAS–ELISA (Cuadro 1). Negativos históricos: una población de 3,200 árboles negativos mediante DAS–ELISA en por lo menos dos censos anteriores (Cuadro 2). Infección desconocida: una población de 4,054 árboles ubicados en el área de influencia de nueve hileras por 49 árboles de un foco de dispersión (Cuadro 2). Esta área se estimó con autocorrelación espacial empleando el software LCOR2 Ver 1.3C (Gottwald et al., 1992). La incidencia y la fecha de detección solo se conocieron en el árbol de referencia.
Análisis serológicos
El análisis serológico de las muestras se realizó en el Laboratorio Acreditado para el diagnóstico de VTC, ubicado en las instalaciones del CFICET. Las muestras se analizaron simultáneamente, empleando seis a ocho pecíolos de hojas para el diagnóstico con inmunoimpresión–ELISA en su modalidad directa (Garnsey et al., 1993) y la corteza de los mismos brotes para el diagnóstico con DAS–ELISA en su modalidad directa (Garnsey y Cambra, 1991).
Método con DAS–ELISA. Una porción de corteza de 0.5 g se maceró por 30 segundos en un molino de rodillos para tejidos (Dayton Electric®), recolectando el extracto con 2 ml de amortiguador de extracción [8 mM Na2 HPO4, 1.4 mM K2 HPO4, 137 mM NaCl, 2.5 mM KCl, 0.1% Tween–20, pH 7.4 + (2% de polivinilpirrolidona + 0.02% de albúmina de huevo)]. La cobertura de las placas de microtitulación de poliestireno (MaxiSorp®, Nulge Nunc Internacional, Dinamarca) se realizó con la mezcla de anticuerpos 3DF1 + 3CA5 (Agdia CAB78900) a una dilución de 5 ì l·ml–1 de amortiguador de cobertura (15 mM NaHCO3 + 30 mM NaCO3, pH 9.6). Se incubaron por cuatro horas a 28 °C y lavaron en tres ocasiones con PBS–Tween (8mM Na2 HPO4, 1.4 mM K2 HPO4, 137 mM NaCl, 2.5 mM KCl + 0.1% Tween–20, pH 7.4). Este lavado se repitió después de cada incubación. Se emplearon 100 ì l de extracto por cada pozo con dos repeticiones por muestra y se incubaron por dos horas a 28 °C. El conjugado enzimático empleado fue el anticuerpo de cabra anti–ratón de Agdia Inc. a una dilución de 5 ì l·ml–1 en el amortiguador de conjugado (PBS–Tween pH 7.4 + 0.2% de albúmina de suero bovino + 2% de PVP–40). Las placas se incubaron por dos horas a 28 °C. Para el revelado de las placas se añadió 1 mg·ml–1 del sustrato p–nitrofenil fosfato disuelto en el amortiguador de revelado (10.2 mM MgCl + 923 mM de dietanolamina). Los controles positivos y negativos fueron extractos de corteza de brotes de plantas de naranja Valencia tardía sobre naranjo agrio mantenidas en invernadero para producción certificada del CFICET. Las lecturas de densidad óptica a 405 nm (OD405) mayores a tres veces la media de dos testigos negativos, después de una hora de reacción fueron consideradas como positivas.
Método con inmunoimpresión–ELISA. La impresión de los pecíolos se realizó individualmente presionando los mismos en dos sitios contiguos sobre una membrana de nitrocelulosa de 13 x 7 cm, previo corte transversal con tijera. La membrana se bloqueó con una solución de 1% de albumina de suero bovino en agua destilada. Se incubó por una hora a temperatura ambiente, al término del cual se lavó con el amortiguador de lavado agitándola durante cinco minutos. El lavado se repitió al término de cada incubación que se realizó a temperatura ambiente. Sobre la membrana se añadió una mezcla de anticuerpos monoclonales (3DF1+3CA5 acoplados a biotina) y se incubó por dos horas. Después del lavado se añadió el conjugado (fosfatasa alcalina acoplado a estreptavidina) y se incubó por una hora. Se empleo 0.1 μm·ml–1 de anticuerpo y conjugado disuelto en amortiguador de conjugado a pH de 7.2. Los anticuerpos y el conjugado fueron adquiridos de Plant Print Diagnostic, SL. Valencia, España. Para el revelado de las membranas se añadió una pastilla (2 g) del sustrato precipitante (nitroblue de tetrazolio y bromo–cloro indolil fosfato, NBT–BCIP) disuelto en 10 ml de agua destilada. Se incubó a temperatura ambiente hasta que aparecieron los precipitados de color violeta en los controles positivos, lo cual ocurrió entre 15 y 20 minutos. La reacción se detuvo lavando las membranas con la solución de lavado agitando el recipiente durante cinco minutos. Las membranas se secaron con papel absorbente a temperatura ambiente. Las lecturas se realizaron con una magnificación de 10 x empleando un microscopio estereoscópico, considerando como positivos al VTC, aquellas impresiones que mostraron precipitados de color violeta en la región correspondiente al haz vascular del pecíolo (Cambra et al., 2000).
Comparación de inmunoimpresión–ELISA con positivos históricos
La comparación consistió en diagnosticar simultáneamente con ambos métodos de diagnóstico la población de 157 árboles positivos históricos, empleando los índices de sensibilidad (proporción de positivos verdaderos dado que están infectados), predictivo de positivos (proporción de positivos verdaderos entre los que fueron diagnosticados como tales) y concordancia (proporción de diagnósticos coincidentes) para medir el desempeño de inmunoimpresión–ELISA (Greenhalgh, 1997). Un intervalo de confianza del 100 (1–α)% para los índices estimados se obtuvo empleando [B(α/2; x, n–x +1), B(α/2; x+1, n–x)], donde B(a; m1, m2) denota el cuantil a–ésimo de la distribución beta (Brown et al., 2001). Adicionalmente, las muestras se agruparon en dos edades de pecíolo (≤1 mes y ≥6 meses). La proporción de positivos en ambas edades se comparó con el estadístico ji–cuadrada en su versión de máxima verosimilitud (G2). El análisis serológico con DAS–ELISA se realizó combinando en una sola muestra la corteza de los seis a ocho brotes colectados por árbol.
Comparación de inmunoimpresión–ELISA en muestras negativas e infección desconocida
Se empleó el mismo procedimiento usado con los árboles positivos históricos, aplicándola a la población de 3,200 árboles negativos previos y 4,054 árboles de infección desconocida. Dado que se carecía de información sobre la infección verdadera de los árboles al momento del muestreo, sólo fue posible estimar la sensibilidad de cada método (Johnson y Pearson, 1999). Sea dj (j= 1,2) el número de muestras positivas detectadas con el método de diagnóstico j y sea b el número de muestras positivas coincidentes con ambos métodos de diagnóstico. La sensibilidad para cada
método de diagnóstico es 
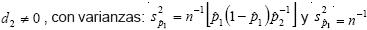
 La sensibilidad total estimada aplicando ambos métodos de diagnóstico es
La sensibilidad total estimada aplicando ambos métodos de diagnóstico es con varianza
con varianza  (Goldberg y Wittes, 1978). La sensibilidad estimada con cada método de diagnóstico en cada antecedente de infección se comparó empleando la aproximación normal para comparar dos proporciones. La concordancia entre ambos métodos de diagnóstico se midió con el índice kappa (Sim y Wright, 2005). El diagnóstico del CTV mediante DAS–ELISA se realizó con muestras compuestas de cuatro árboles. Cuando una muestra compuesta resultó positiva se analizaron las muestras individuales correspondientes para identificar al árbol(es) positivo(s).
(Goldberg y Wittes, 1978). La sensibilidad estimada con cada método de diagnóstico en cada antecedente de infección se comparó empleando la aproximación normal para comparar dos proporciones. La concordancia entre ambos métodos de diagnóstico se midió con el índice kappa (Sim y Wright, 2005). El diagnóstico del CTV mediante DAS–ELISA se realizó con muestras compuestas de cuatro árboles. Cuando una muestra compuesta resultó positiva se analizaron las muestras individuales correspondientes para identificar al árbol(es) positivo(s).
Estimación del número de pecíolos por muestra
La redundancia en la información proporcionada por el empleo de brotes dispuestos en agregados en el dosel de un árbol se estimó con el tamaño efectivo de muestra. Se tomó una muestra de n = 6 brotes en N árboles positivos. Cuando la disposición de los brotes positivos alrededor de los árboles es homogénea, la probabilidad de que un árbol tenga al menos un brote positivo es  donde
donde  es la proporción media de brotes positivos por árbol. Cuando la disposición de los brotes positivos alrededor de los árboles es heterogénea, la probabilidad de que un árbol tenga al menos un brote positivo es
es la proporción media de brotes positivos por árbol. Cuando la disposición de los brotes positivos alrededor de los árboles es heterogénea, la probabilidad de que un árbol tenga al menos un brote positivo es  donde
donde 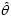 es el índice de agregación de la distribución beta binomial. Cuando la disposición de los brotes es heterogénea, en una muestra de n brotes, el número de brotes diferentes que proporcionan información sobre la infección viral es
es el índice de agregación de la distribución beta binomial. Cuando la disposición de los brotes es heterogénea, en una muestra de n brotes, el número de brotes diferentes que proporcionan información sobre la infección viral es  (Madden y Hughes, 1999). La bondad de ajuste de las frecuencias de brotes positivos se realizó por antecedente de infección con el estadístico ji–cuadrada. El parámetro
(Madden y Hughes, 1999). La bondad de ajuste de las frecuencias de brotes positivos se realizó por antecedente de infección con el estadístico ji–cuadrada. El parámetro 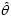 se estimó con el algoritmo AS R93 (Smith y Ridout, 1995).
se estimó con el algoritmo AS R93 (Smith y Ridout, 1995).
RESULTADOS
Comparación de inmunoimpresión–ELISA en árboles positivos históricos
La confirmación con ambos métodos de diagnóstico de los 157 árboles positivos históricos fue coincidente en 150 árboles (95.54%), observándose sólo siete muestras discordantes (Cuadro 3). Cuatro muestras fueron negativas por DAS–ELISA (absorbancias de 0.052 a 0.120, control = 0.152) y positivas por inmunoimpresión–ELISA (dos a cuatro pecíolos positivos), mientras que tres muestras fueron positivas por DAS–ELISA (absorbancias: 0.232, 0.481, 0.823, control = 0.152) y negativas por inmunoimpresión–ELISA. Únicamente una muestra de la huerta M1 fue negativa por ambos métodos de diagnóstico (absorbancia = 0.082). El 98.03% de las muestras infectadas fueron positivas con inmunoimpresión–ELISA, por lo que el 1.98% fueron falsos negativos. Además, el 97.39% de las muestras que proporcionen un resultado positivo con inmunoimpresión–ELISA realmente estarían infectados. La proporción de positivos detectados con DAS–ELISA e inmunoimpresión–ELISA fue igual en ambas edades de peciolos, P<0.294 y P<0.551, respectivamente.

Comparación de inmunoimpresión–ELISA en muestras negativas e infección desconocida
El número de árboles positivos detectados en cada antecedente de infección se muestra en el Cuadro 4. En el antecedente de infección desconocida se identificaron cinco muestras discordantes: un árbol fue positivo por DAS–ELISA (absorbancia = 0.197, control = 0.148) y negativo por inmunoimpresión–ELISA, y cuatro árboles positivos por inmunoimpresión–ELISA (dos impresiones positivas) y negativos por DAS–ELISA (absorbancias: 0.031, 0.075, 0.143, 0.146, control = 0.148). La concordancia entre ambos métodos de diagnóstico fue k = 0.927 + 0.015 (P<0.05). La sensibilidad estimada para inmunoimpresión–ELISA fue mayor que para DAS–ELISA (P≤0.029). En el antecedente de infección reciente se identificaron seis muestras discordantes: positivos por inmunoimpresión–ELISA (dos impresiones positivas) y negativos por DAS–ELISA (absorbancias de 0.040 a 0.095, control = 0.146). La concordancia entre ambos métodos de diagnóstico fue k = 0.962 ± 0.018 (P<0.05). La sensibilidad estimada para inmunoimpresión–ELISA fue mayor que para DAS–ELISA (P≤0). En ambos antecedentes de infección, inmuno–impresión–ELISA fue más sensible para identificar las muestras positivas al VTC. Empleando ambos métodos de diagnóstico se mejora la sensibilidad del programa de diagnóstico y se reduce la proporción de falsos negativos.

Estimación del número de pecíolos por muestra
La disposición de los brotes positivos en la periferia de un árbol no fue homogénea (Cuadro 5). La mayor cantidad de pecíolos con información redundante sobre la infección viral se estimó en el antecedente de infección desconocido, en la cual se estimó también el mayor índice de agregación (Figura 1, Cuadro 5). La menor cantidad de pecíolos con información redundante se estimó en el antecedente de árboles positivos históricos, en la cual, incluso la disposición de los brotes positivos alrededor de un árbol puede considerarse homogénea (Cuadro 5, Figura 1).

DISCUSIÓN
Entre los métodos serológicos disponibles para el diagnóstico de VTC, DAS–ELISA es el más aceptado, y en México constituye el método oficial para el diagnóstico de VTC (NOM–031–FITO–2000). Sin embargo, el método de inmunoimpresión–ELISA mostró la misma sensibilidad que DAS–ELISA en el diagnóstico de este virus empleando árboles positivos históricos y mayor sensibilidad en muestras de infección reciente, así como en aquellas de antecedente desconocido, que correspondería al caso real de detección de VTC en México y en otras regiones con un programa regulatorio análogo. Estos resultados concordaron en general con los obtenidos en Veracruz en un estudio comparativo con árboles adultos de infección viral conocida (Loredo y Peña, 2002). Sin embargo, estos últimos autores no reportan indicadores de desempeño (sensibilidad y concordancia) y el muestreo no fue exhaustivo, por lo que la comparación fue de tipo cualitativo. Resultados similares se obtuvieron en España con anticuerpos convencionales y recombinantes en 23 árboles también de infección conocida (Terrada et al., 2000) y en Turquía, empleando anticuerpos monoclonales y policlonales en 258 árboles de infección desconocida (Korkmaz, 2002). Con los resultados reportados en estos dos últimos trabajos se estimó la sensibilidad y concordancia, resultando en ambos casos una sensibilidad y exactitud de 100%. Considerando que ambos métodos emplean el mismo principio antigénico, la diferencia en la sensibilidad puede deberse al efecto de dilución en muestras compuestas para DAS–ELISA, afectando la detección de árboles con infecciones recientes o muy prolongadas. Esto, por efecto de la baja concentración (Mathews et al., 1997; Ruiz et al., 2005) y disposición heterogénea del virus en el dosel de la planta (Ben–Ze'ev et al., 1989; Ballesteros et al., 1993). Aunado a la confiabilidad (sensibilidad y concordancia), el método serológico de inmunoimpresión–ELISA ha resuelto algunos problemas documentados en DAS–ELISA como el costo y el tiempo respuesta (Cambra et al, 2000). El costo por muestra en el presente trabajo, considerando todo el proceso y costo de reactivos, con DAS–ELISA fue de US$ 1.72 contra US$ 0.98 de inmunoimpresión–ELISA, lo que representó un ahorro de 57.5%. En un reporte previo se mostró un ahorro del 66% en el análisis de árboles adultos (Loredo y Peña, 2002). En el caso de inmunoimpresión–ELISA, las dos impresiones por brote fueron reproducibles en 93.2%, por lo cual se sugiere realizar una impresión por pecíolo e incrementar la exploración del dosel del árbol con más brotes para compensar la heterogeneidad en la disposición de brotes positivos. Considerando que el número de brotes evaluados por árbol, sin afectar la confiabilidad en la detección, fue de cinco en doble impresión, se propone el empleo de 10 brotes por muestra en impresión simple. Esto reduce los costos del análisis en 17% e incrementa la probabilidad de incluir brotes positivos en la muestra. La determinación del número óptimo de brotes para detección de árboles con al menos un brote positivo se formalizó por primera vez en este trabajo considerando la distribución beta binomial que permitió determinar la disposición de los brotes positivos alrededor del dosel del árbol. Este resultado confirma cuantitativamente la disposición heterogénea del virus previamente deducido mediante pruebas serológicas y biológicas (Ben–Ze'ev et al., 1989; Cambra et al., 2000; Ballesteros et al., 2003). Inmunoimpresión–ELISA fue más oportuna en el diagnóstico de las muestras que DAS–ELISA, ya que el tiempo promedio para analizar una membrana (127.2 ± 1.02 impresiones, n = 13 membranas) fue de un día, mientras que con DAS–ELISA se requirió seis días, realizando muestras compuestas de cuatro árboles. Por esta característica se ha propuesto el empleo de inmu–noimpresión–ELISA directamente en campo por personal no especializado (Cambra et al., 2000). Aun cuando el método de inmunoimpresión–ELISA ha mostrado suficiente sensibilidad para el diagnóstico de VTC, es necesario reconfirmar los resultados positivos con DAS–ELISA para aplicar las medidas de control indicadas en la normatividad mexicana vigente. El procedimiento que se sugiere para reducir costos e incrementar la oportunidad en el diagnóstico, manteniendo la confiabilidad de un programa de detección, consistiría en diagnosticar en una primera etapa todas las muestras con inmunoimpresión–ELISA y posteriormente confirmar con DAS–ELISA únicamente las muestras positivas. Con este procedimiento se tendría un error de 2.2% de falsos negativos y 2.6% de falsos positivos. Este procedimiento incrementa únicamente el 4.6% los costos del análisis, y representa un ahorro de 54.9% del costo empleando DAS–ELISA como único método de diagnóstico.
CONCLUSIONES
El diagnóstico del VTC con el método serológico de inmunoimpresión–ELISA fue más sensible que DAS–ELISA y mejora la detección de positivos. Aunque en el antecedente de positivos históricos ambos métodos tuvieron la misma sensibilidad estadística, en el escenario de positivos de infección reciente e infección desconocida, inmunoimpresión–ELISA fue más confiable. La disposición de los brotes en el dosel de los árboles fue heterogénea, lo cual afectó el desempeño de ambos métodos. Debido a lo anterior y a la reproducción del diagnóstico en un brote, se recomienda un tamaño óptimo de muestra de 10 brotes por árbol en impresión simple. El desempeño de ambos métodos no fue afectado por la edad de los brotes empleados, aunque sí lo fue por el tiempo transcurrido desde la infección, siendo el método DAS–ELISA la más afectada. Inmunoimpresión–ELISA fue 57.5% más económico y requirió una sexta parte del tiempo empleado en DAS–ELISA. Por las especificaciones de la norma oficial mexicana NOM–031–FITO–2000, se recomienda el método de inmunoimpresión–ELISA como un método rápido para preidentificar muestras positivas que deben ser verificados posteriormente por el método oficial de diagnóstico. Este procedimiento representa un ahorro total del 54.9%.
AGRADECIMIENTOS
El presente proyecto recibió apoyo financiero del Consejo Nacional de Ciencia y Tecnología, Núm. G35488–B; Fundación Produce–Tamaulipas, A.C. y CFICET. Los autores agradecen el apoyo técnico de la Biol. Doris Hidalgo y el apoyo logístico del personal de la Campaña contra el VTC del CESV, Tamaulipas.
LITERATURA CITADA
BALLESTEROS O., J. F.; PIÑA, J. A.; CARBONELL, E. A.; MORENO, P.; HERMOSO M., A.; CAMBRA, M.; NAVARRO, L. 1993. Biological diversity of citrus tristeza vairus (CTV) isolates in Spain. Plant Pathology 42: 219–229. [ Links ]
BEN–ZE'EV, I. S.; BAR–JOSEPH, M.; NITZAN, Y.; MARCUS, R. 1989. A severe citrus tristeza virus isolate causing the collapse of trees of sour orange before virus is detectable throughout the canopy. Annals of Applied Biology 114: 293–300. [ Links ]
BROWN, L. D.; CAI, T. T.; DASGUPTA, A. 2001. Interval estimation for a binomial proportion. Statistical Science 16: 101–133. [ Links ]
CAMBRA, M.; GORRIS, M. T.; ROMÁN, M. P.; TERRADA, E; GARNSEY, S. M.; CAMARASA, E.; OLMOS, A.; COLOMER, M. 2000. Routine detection of citrus tristeza virus by direct inmunoprinting–ELISA method using specific monoclonal and recombinant antibodies, pp. 34–41. In: 14th Conference of the International Organization of Citrus Virologist. da GRAÇA, J. V.; LEE, R. F.; YOKOMI, R. K. (eds.). Riverside, California, USA. [ Links ]
GARNSEY, S. M.; CAMBRA, M. 1991. Enzyme–linked immunosorbent assay (ELISA) for citrus pathogens, pp. 193–216. In: Grafttransmissible diseases of citrus. Handbook for detection and diagnosis. Roistacher, C. N. (ed.). FAO, Rome. [ Links ]
GARNSEY, S. M.; PERMAR, T. A.; CAMBRA, M.; HERDERSON, C. T. 1993. Direct tissue blot immunoassay (DTBIA) for detection of Citrus tristeza virus (CTV), pp. 39–50. In: 12th Conference of International Organization of Citrus Virologist. MORENO, P.; DA GRAÇA, J. V. (eds.). Riverside, California. [ Links ]
GREENHALGH, T. 1997. How to read a paper: papers that report diagnostic or screening test. British Medical Journal 315: 540–643. [ Links ]
GOLDBERG, J. D.; WITTES, J. T. 1978. The estimation of false negatives in medical screening. Biometrics 34: 77–86. [ Links ]
GOTTWALD, T. R.; RICHIE, S. M.; CAMPBELL, C. L. 1992. LCOR2–Spatial correlation analysis software for the personal computer. Plant Disease 96: 213–215. [ Links ]
IRACHETA C., M. M.; PEÑA DEL RÍO, M.; ROCHA P., M. A. 2005. Comparación de antisueros comerciales para la detección del virus tristeza de los cítricos. Revista Mexicana de Fitopatología 23: 323–328. [ Links ]
JOHNSON, W. O.; PEARSON, L. M. 1999. Dual screening. Biometrics 55: 867–973. [ Links ]
KORKMAZ, S. 2002. Application of direct tissue blot immunoassay in comparison with DAS–ELISA for detection of Turkish isolates of citrus tristeza closterovirus (CTV). Turkish Journal of Agriculture and Forestry 26: 203–209. [ Links ]
LOREDO S., R. X.; PEÑA R., M. A. 2002. Validación de la técnica ELISA–Inmunoimpresión para detección de VTC, pp. 189–190. In: XV Reunión Científica–Tecnológica Forestal y Agropecuaria. Villahermosa, Tabasco. [ Links ]
MADDEN, L. V.; HUGHES, G. 1999. An effective sample size for predicting plant disease incidence in a spatial hierarchy. Phytopathology 89: 770–781. [ Links ]
MATEWS, D. M.; RILEY, K.; DODDS, J. A. 1997. Comparison of detection methods for citrus tristeza virus in field trees during months of nonoptimal titer. Plant Disease 81: 525–529. [ Links ]
RUIZ G., N.; MORA A., G.; RIVAS V., P.; OCHOA M., D.; GÓNGORA C., C. C.; LOEZA K., E.; GUTÍERREZ E., A.; RAMÍREZ V., G.; ÁLVAREZ R., R. 2005. Probability model of Citrus tristeza virus detection in the tree canopy and reliability and efficiency of direct immunoprinting–ELISA, pp. 196–204. In: 15th Conference of the International Organization of Citrus Virologist. HILF, M.E.; DURAN A., N.; ROCHA P. , M. A. (eds.). Riverside, California. [ Links ]
SILVA V. S.; PEÑA R., M.; PEÑA M., R.; VILLEGAS J., N.; BYERLY M., K. F.; ROCHA P., M. A. 2001. Distribución del virus de la tristeza en tres plantaciones comerciales de cítricos del estado de Nuevo León, México. Agrociencia 35: 441–450. [ Links ]
SIM, J.; WRIGHT, C. C. 2005. The kappa statistic in reliability studies: use, interpretation, and sample size requirements. Physical Therapy 85: 257–268. [ Links ]
SMITH, D. M.; RIDOUT, M. S. 1995. Remark AS R93: A remark on algorithm AS 189: Maximum likelihood estimation of the parameters of the beta binomial distribution. Applied Statistics 44: 545–547. [ Links ]
TERRADA, E.; KERSCHBAUMER, R. J.; GIUNTA, G.; GALEFFI, P. ; HIMMLER, G., CAMBRA, M. 2000. Fully "recombinant enzyme–linked immunosorbent assays" using genetically engineered single–chain antibody fusion proteins for detection of Citrus tristeza virus. Phytopathology 90: 1337–1344. [ Links ]





![Comportamiento de dos cultivares de limón mexicano [Citrus aurantifolia (Christm) Swingle] en portainjertos desarrollados en suelos con dos profundidades](/img/es/next.gif)








