Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.14 no.3 Chapingo sep./dic. 2008
Cambios postcosecha del hongo comestible huitlacoche (Ustilago maydis (D. C.) Corda)
Postharvest changes in the edible mushroom huitlacoche (Ustilago maydis (D.C.) Corda)
A. Martínez–Flores1, J. J. Corrales–García1*, T. Espinosa–Solares1, P. G. García–Gatica1 y C. Villanueva–Verduzco2
1 Departamento de Ingeniería Agroindustrial, Universidad Autónoma Chapingo. km 38.5 Carretera México–Texcoco. Chapingo, Estado de México, C. P. 56230. México. Correo–e: joelcorrales@hotmail.com (*Autor responsable)
2 Departamento de Fitotecnia, Universidad Autónoma Chapingo. km 38.5 Carretera México–Texcoco. Chapingo, Estado de México, C. P. 56230. México.
Recibido: 4 de septiembre, 2007
Aceptado: 12 de noviembre, 2008
Resumen
El huitlacoche [(Ustilago maydis (D.C.) Corda)] ha sido un importante alimento en la dieta de los habitantes de la región Centro–Sur de México desde épocas precolombinas. Recientemente, su aceptación a nivel mundial se ha incrementado. A pesar de que es un producto muy perecedero no existen estudios postcosecha, por lo cual, el objetivo de este estudio fue identificar el cambio de parámetros físicos y fisiológicos en postcosecha de huitlacoche entero (mazorca) y desgranado (agallas) a temperatura ambiente, 3 y 10 °C, durante 11 días. Se evaluó el cambio de aspecto, color, pérdida de peso, respiración, producción de etileno y cambio en aminoácidos. La respiración promedio del huitlacoche entero a temperatura ambiente, 10 y 3 °C fue de 320.8, 120.8 y 71. 5 mlCO2·kg–1·h–1, respectivamente; en tanto que para el desgranado fue de 372.8, 346.7 y 164.1 mlCO2·kg–1·h–1 a temperatura ambiente, 10 y 3 °C respectivamente. A los 7 días de almacenamiento, el hongo presentó pérdida de peso arriba del 80, 60 y 22% a temperatura ambiente, 10 y 3 °C respectivamente. Se encontraron 18 aminoácidos, del contenido total los esenciales representaron 37.8% de los cuales lisina representó el 27.2%. Después del almacenamiento, el huitlacoche no mostró un cambio importante en el contenido de aminoácidos. A 3 °C el huitlacoche entero conservó mejor su apariencia, color y peso. No se detectó producción de etileno en las temperaturas evaluadas.
Palabras clave: cambio de color, pérdida de peso, respiración, etileno, aminoácidos.
Abstract
Huitlacoche (Ustilago maydis (D.C.) Corda) has been an important food in the diet of the inhabitants of the Central–Southern region of Mexico since pre–Columbian times. Recently, its acceptance has increased all around the world. Although it is a highly perishable mushroom, there are no postharvest studies. For these reasons the objective of this work was to identify changes in physical and physiological postharvest parameters of huitlacoche on the corn ear and of cut huitlacoche galls stored at room temperature, 10 °C, and 3 °C for 11 d. The measured variables were changes in appearance, color, weight loss, respiration, production of ethylene and amino acids. The average respiration rate of huitlacoche on the ear at room temperature, 10 and 3 °C was 320.8, 120.8 and 71.5 mLCO2·kg–1·h–1, respectively, and 372.8, 346.7 and 164.1 mLCO2·kg–1·h–1 in cut galls, respectively. Weight loss was above 80, 60 and 22% at room temperature, 10 and 3 °C at 7 days, respectively. Huitlacoche contains 18 amino acids, of these, essential amino acids accounted for 37.8% of the total. Lysine was 27.2% of the essential amino acids. After the storage period, there was no major change in amino acid content. The huitlacoche kept its appearance, color and weight better when it was stored at 3 °C on the ear. Ethylene production by huitlacoche was not detected.
Key words: color changes, weight loss, respiration, ethylene, amino acids.
INTRODUCCIÓN
El hongo Ustilago maydis (D.C.) Corda es conocido en el mundo por causar la enfermedad llamada carbón común en maíz (Zea mays), esta enfermedad propicia la formación de grandes tumores o agallas que se pueden desarrollar sobre todas las partes verdes de la planta, tallos, hojas, espiga y mazorca; cuando el micelio del hongo prolifera dentro de los tumores su tamaño puede ser muy notorio (Bolker, 2001). En México, desde el periodo precolombino las agallas que se forman en la mazorca son usadas en la preparación de diferentes platillos (Ruíz y Martínez, 1998), y se le conoce como "huitlacoche" o "cuitlacoche", nombre que los Aztecas utilizaron para nombrar a las agallas comestibles que se forman cuando el maíz (Zea mays L.) está infectado por este basidiomiceto (Pataky y Chandler, 2003).
Actualmente, es una enfermedad tolerada y en ocasiones hasta promovida por los mismos productores de maíz de la región Centro–Sur de México, pues es consumido y vendido en algunos mercados regionales y enlatado por algunas empresas de alimentos (Villanueva, 1997). Su venta representa importantes ingresos económicos, pues su precio supera por mucho el precio del maíz en grano.
Recientemente, el huitlacoche ha sido considerado como un cultivo alternativo debido al incremento de su popularidad como alimento (Venegas et al., 1995), y ha sido introducido en la alta cocina (Ruíz y Martínez, 1998). El incremento en la aceptabilidad de este hongo podría estar relacionado, por un lado, a su alto contenido de aminoácidos (Lizarraga–Guerra y López, 1996), por lo cual se le considera un buen alimento, pero, principalmente por su excelente sabor.
Al ser un producto altamente perecedero, el huitlacoche se consume fresco y en forma casi inmediata a su recolección o cosecha, debido a su corta vida útil (dos o tres días); probablemente esto se debe a que presenta un metabolismo muy activo y cambios muy rápidos, sin embargo, éstos no han sido evaluados, o por lo menos no existe información en la literatura al respecto. Por la importancia que tiene este hongo para nuestro país y lo que podría representar conocer los cambios en postcosecha del hongo, es necesario identificarlos a fin de contribuir en la generación de parámetros de conservación para el manejo apropiado del huitlacoche en postcosecha. Por lo anterior, el objetivo de este estudio fue caracterizar los cambios físicos, fisiológicos y contenido de aminoácidos del huitlacoche entero y desgranado, almacenado a temperatura ambiente y en condiciones de refrigeración, durante 11 días.
MATERIALES Y MÉTODOS
Material
Se utilizó huitlacoche (Ustilago maydis) adquirido en la Central de Abasto de Iztapalapa del Distrito Federal, recolectado por la tarde del día anterior, de plantas de maíz infectadas en forma espontánea. Se transportó cuidadosamente al laboratorio, para evitar daños mecánicos. Del lote adquirido, se seleccionaron mazorcas completamente cubiertas por las agallas, de un color preferentemente blanco y de la mejor apariencia. La mitad de las mazorcas se utilizaron completas y la otra mitad del lote se desgranó (desprendiendo las agallas en forma manual).
Tratamientos
Huitlacoche entero y desgranado se almacenó durante 11 días a temperatura ambiente (H. R. 77% aprox.), 3 y 10 °C (H. R. 90–95% aprox.) generándose seis tratamientos derivados de la combinación de las dos formas de manipulación y las tres temperaturas. La unidad experimental para el huitlacoche entero fue una mazorca y para el desgranado fue de 100 g de agallas; cada tratamiento con cinco o tres repeticiones, dependiendo de la variable evaluada. Los resultados se sometieron al análisis de varianza univariado, con base en un diseño completamente al azar, cuando se detectaron diferencias significativas se aplicó la prueba de comparación de medias de acuerdo con la prueba de Tukey, a una P=0.05, en el software SAS (Statistical Analysis System) 9.1, 2004.
Cambio de apariencia y parámetros de color
La apariencia se describió con ayuda de fotografías tomadas al inicio, a la mitad y al final del periodo de almacenamiento, utilizando una cámara SAMSUNG digital modelo DIGIMAX 6 MPx. El color del huitlacoche (entero y desgranado) fue determinado con un colorímetro Hunter Lab modelo Mini Scan XE Plus No. 45/0–L, con el que se obtuvieron las dimensiones CIELAB L*, a* y b*. Se determinó la luminosidad (L*), cambio total de color ( E), el ángulo de tono (Hue) y la pureza de color (Chroma). Lo anterior mediante las siguientes ecuaciones (Hutchings, 1999):
E), el ángulo de tono (Hue) y la pureza de color (Chroma). Lo anterior mediante las siguientes ecuaciones (Hutchings, 1999):

Pérdida de peso
Se utilizó una balanza digital Adam Equipment Co. Modelo ADP 2100L (0.01 g). Se determinó el porcentaje de peso perdido con respecto al peso inicial del huitlacoche fresco, el cálculo se realizó con base en la siguiente fórmula:

Donde:
% PP = porcentaje de peso perdido
Pi = peso inicial
Pf = peso final
Patrón de respiración y producción de etileno
La respiración se determinó con base en el método colorimétrico de Claypool y Keefer (1942) modificado y adaptado para estudios postcosecha por Pratt y Mendoza (1979). Se mantuvo un flujo conocido y constante de aire, sobre el huitlacoche (en este caso fue 18.0 litro·h–1), el cual arrastra el CO2 producido por el hongo, mismo que se atrapa en una solución de azul de bromotimol y bicarbonato de sodio. El dióxido de carbono provoca un cambio de pH de la solución, lo que origina un cambio en la transmitancia, la cual se determinó con un espectrofotómetro "Spectronic 20" a 615 nm. Se obtuvieron registros de transmitancia de la solución antes y después de capturar el CO2 producido por el hongo. El porcentaje de CO2 se determinó con base en una curva de calibración de porcentaje de CO2 vs. porcentaje de transmitancia elaborada previamente, con diluciones de un estándar de CO2. La ecuación (r2 = 0.953) de la curva estándar de CO2 encontrada fue la siguiente:
% CO2 = –2.39509 + (0.133224 x X)
+ (–0.0025356 x X2)
+ (2.0988x10–5 x X3)
Donde: X = transmitancia de la solución
De acuerdo con este método la tasa de respiración se puede expresar en mL de CO2 por kg de peso fresco de tejido por hora, utilizando la siguiente fórmula:

Donde: ml de CO2 = CO2 producido por la respiración del huitlacoche.
[CO2]= concentración de CO2 en % calculada a partir de la curva estándar.
Flujo = flujo de aire comprimido utilizado en el sistema (18 litros·h–1).
El etileno (C2H4) se cuantificó por cromatografía de gases. Las muestras de huitlacoche se colocaron dentro de cámaras (recipientes de plástico sellados herméticamente) durante una hora, entonces se extrajo una muestra de 0.1 mL y se inyectó en un cromatógrafo Varian modelo 3,400 usando el software Star Chromatography Workstation Versión 4.5, Varian, 1996. Se empleó una columna capilar Chrompack de 25 m, 0.32 mm de diámetro interno y 0.45 mm de diámetro externo. La presión en la cabeza de la columna fue de 29 a 30 psi. Las condiciones de temperatura fueron, 80 °C en columna, 150 en el inyector, 150 en el auxiliar, 170 en el detector de ionización de flama (FID) y 200 en el filamento. El tiempo de corrida fue de 4 minutos. Bajo estas condiciones, el tiempo promedio de retención del etileno fue de 3.063 min.
Para determinar la concentración se utilizó una curva estándar con concentraciones conocidas de etileno vs. área del pico producido. La ecuación (r2 = 0.9903) de la curva estándar fue la siguiente:
Etileno = 4.81605 + 0.0245X
Donde:
Etileno = Concentración de etileno en partes por millón (ppm)
X = Área del cromatógrama producido por la muestra
Cambio en aminoácidos
Doce muestras adicionales (100 g) de huitlacoche desgranado fueron congeladas con nitrógeno líquido. Cuatro muestras de huitlacoche fresco (sin almacenamiento), cuatro después de 11 días de almacenamiento a 3 °C y cuatro más después del mismo período a 10 °C. Inmediatamente después de su congelación, las muestras fueron liofilizadas a –47 °C y presión de 1 x 10–3 mbar, en un equipo LABCONCO modelo FREEZE SISTEM/LYPH LOCK®. Las muestras liofilizadas se enviaron al Departamento de Ciencia y Tecnología de los Alimentos, del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, para la determinación de aminoácidos. El método utilizado fue Cromatografía de Intercambio Iónico.
RESULTADOS
Cambios de apariencia y parámetros de color
La Figura 1, muestra al huitlacoche con una coloración blanca ligera con ciertas áreas grises, al respecto algunos consumidores suelen mencionar que tiene una tonalidad plateada, además muestra agallas completamente llenas, sin rugosidades evidentes en la superficie. Los cambios de coloración se presentaron progresivamente durante los días de almacenamiento y se hicieron notables en forma generalizada, a los 11 días (Figura 1c), tiempo en el cual el huitlacoche de todos los tratamientos presentó áreas grises y negras. Por otro lado, la pérdida de humedad provocó la aparición de rugosidades en la cubierta (peridio), que originó su rompimiento.

A temperatura ambiente, el deterioro del hongo fue muy evidente a partir del tercer día, mostró una coloración negra, agallas deshidratadas y rotas, por lo cual no se comparan las fotos con las de la temperatura de refrigeración. En refrigeración, la mayor pérdida de color y presencia de hendiduras o rugosidades lo presentó el huitlacoche desgranado almacenado a 10 °C, estos cambios fueron menos evidentes en el huitlacoche entero almacenado a 3 °C.
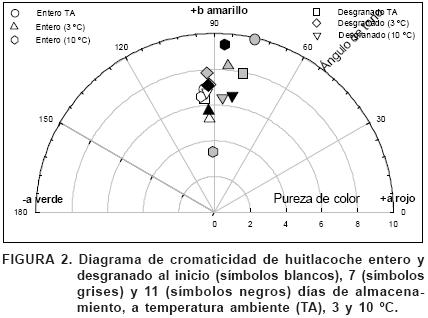
El cambio visual de color, guardó cierta relación con los parámetros de color determinados a partir de los valores de L*, a* y b*, proporcionados por el colorímetro. Durante el almacenamiento, en todos los tratamientos se observó un decremento progresivo en la luminosidad L* y un aumento progresivo en el cambio total de color (AE) La disminución de brillantez indica que el huitlacoche se obscureció, así, al disminuir la brillantez, el cambio total de color se incrementó (Cuadro 1). A temperatura ambiente, la luminosidad disminuyó a la mitad en los primeros siete días; no fue posible determinar parámetros de color a los 11 días, debido a la avanzada alteración de las muestras (deshidratación, rompimiento de agallas y exposición de micelio). La refrigeración retardó la pérdida de luminosidad de forma significativa, siendo la mejor temperatura la de 3 °C, con la cual a los 11 días se tuvo la mayor luminosidad. El huitlacoche entero conservó mejor su luminosidad que el desgranado, en las tres temperaturas utilizadas.
El ángulo de tono se mantuvo alrededor de 90 ° en todos los tratamientos, con este valor la escala CIELAB indica la zona de colores amarillos (Figura 2); sin embargo, la pureza de color no pasó de las doce unidades, por lo tanto el color del huitlacoche se encontró en el área de los tonos grises, esto significa que el amarillo se encuentra muy mezclado con el gris, lo que indica color de baja pureza. Sin cambios importantes en la pureza de color y al ángulo de tono, la luminosidad (brillantez) se convirtió en el parámetro más importante para explicar el cambio total de color del huitlacoche en postcosecha.
Pérdidas de peso
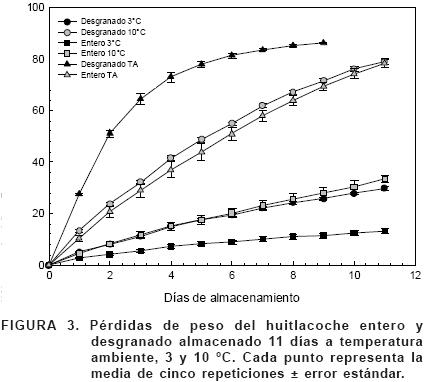
La pérdida de peso fue mayor y sumamente rápida en el huitlacoche conservado a temperatura ambiente, en el séptimo día, el huitlacoche entero perdió más del 50% de su peso y 80% el desgranado. La refrigeración en ambas temperaturas disminuyó la pérdida de peso; a los siete días a 3 °C la pérdida fue de 20 y 10% en huitlacoche desgranado y entero, respectivamente. Para el mismo tiempo, a 10 °C la pérdida de peso fue de 60 y 23% en huitlacoche entero y desgranado, respectivamente.
La Figura 3 muestra que el efecto de la temperatura fue determinante tanto en el huitlacoche entero como en el desgranado: con la menor temperatura se redujo hasta cuatro veces el peso perdido, comparado con el de la temperatura ambiente. Al final de la refrigeración, la mayor pérdida de peso ocurrió con 10 °C en el huitlacoche desgranado (78.9%) y la menor con 3 °C con el huitlacoche entero (13.1%). Para ambas temperaturas y período de almacenamiento, el huitlacoche desgranado presentó mayor pérdida de peso que el entero.
Patrón de respiración y producción de etileno
En general, las tasas de respiración que presentó el huitlacoche entero y desgranado fueron sumamente altas durante su almacenamiento en las diferentes temperaturas probadas (Figura 4). A temperatura ambiente, la respiración promedio del huitlacoche entero y desgranado fue de 320.8 y 372.8 mlCO2kg–1·h–1, respectivamente. El huitlacoche entero almacenado a 3 y 10 °C presentó una tasa de respiración promedio de 71.5 y 120.9 mlCO2kg–1·h–1, respectivamente, mientras que para el desgranado fueron considerablemente menores: 164.0 y 346.7 mlCO2kg–1·h–1 a 3 y 10 °C. En síntesis, la respiración disminuyó significativamente con la refrigeración y particularmente en el huitlacoche entero y a la menor temperatura.
En algunos días de almacenamiento, los registros de respiración del huitlacoche entero fueron significativamente menores a los del huitlacoche desgranado. Para ambas temperaturas de refrigeración, la producción de CO2 del huitlacoche fue disminuida por debajo del 50% del valor inicial, manteniéndose así en la mayoría de los tratamientos, excepto para el huitlacoche desgranado a 10 °C, que tuvo un comportamiento anormal.
En el huitlacoche entero y desgranado no se detectó producción de etileno en ninguna de las temperaturas probadas en este trabajo.
Cambio en aminoácidos
Los resultados indicaron que el huitlacoche contiene 18 aminoácidos; destacando la presencia de todos los esenciales que representaron el 37.8% del total. Los aminoácidos esenciales presentes en mayor cantidad fueron la lisina, fenilalanina y leucina con 27.2, 20.6 y 15.5% del total de los aminoácidos esenciales, respectivamente. Dos aminoácidos no esenciales, destacan por su alto contenido en el huitlacoche, éstos son el ácido aspártico y acido glutámico, que juntos representan el 27.6% del total de los aminoácidos.
La Figura 5 permite ver que después de 11 días de almacenamiento a 3 o 10 °C, el huitlacoche no presentó cambios importantes, sólo hubo diferencia estadística en tres aminoácidos. Metionina y ácido aspártico almacenados 11 días a 10 °C, presentaron una disminución con respecto al huitlacoche fresco, mientras que arginina también disminuyó pero con 3 °C. Por lo anterior, se considera que el huitlacoche refrigerado en postcosecha mantiene su contenido de aminoácidos y por lo tanto no pierde su calidad nutricia.

DISCUSIÓN
A temperatura ambiente la pérdida de peso, apariencia visual, color y respiración del huitlacoche presentaron los registros más altos, las temperaturas de refrigeración probadas lograron disminuir estos procesos relacionados con el deterioro del huitlacoche, lo que impacta en el incremento de su vida útil. Pues de acuerdo con Brosnan y Sun (2001) la velocidad de deterioro está relacionada a los procesos metabólicos del producto, y la velocidad de deterioro se incrementa logarítmicamente con el incremento de la temperatura.
El cambio de color ocurrido en el huitlacoche, puede estar relacionado a lo que ocurre en otros hongos comestibles, donde el inicio del cambio de color ha sido atribuido (Neyra et al., 2005) a la oxidación enzimática de fenoles tales como tirosina, para formar pigmentos cafés, o a la oxidación no enzimática de los fenoles inducida por otros factores. La enzima que origina los cambios de color es la tirosinasa, que pertenece a la familia de las polifenol oxidasas (PFO) que se sabe es crucial en la síntesis de la melanina (Nerya et al., 2006). Se ha encontrado (Jiying et al., 2006) que en Agaricus bisporus la baja temperatura inhibe la actividad de la PFO y por lo tanto el grado de obscurecimiento. Si el cambio de color del huitlacoche (sobre el peridio) se relaciona a un proceso enzimático, es entonces entendible que a 3 °C el cambio fue menor, pues probablemente la o las enzimas responsables de este proceso son sensibles a esta temperatura. Sin embargo, hay que considerar que con la rotura de agallas del huitlacoche se expone micelio y teliosporas que son de color negro, lo que influye en la coloración final del hongo; pero, con agallas íntegras el peridio sería la estructura que determina el cambio de color.
Al no presentarse alteraciones importantes en los parámetros de ángulo de tono y pureza de color, la luminosidad es el parámetro que más impactó en el cambio total de color del huitlacoche. Entonces es fundamental conservar la luminosidad el mayor tiempo posible, lo que se consiguió con la temperatura más baja (3 °C). Sin embargo, en otros trabajos, se ha encontrado que al utilizar bajas temperaturas cercanas entre sí, es posible no encontrar diferencia significativa al tratar de conservar este valor, tal como fue reportado para Pleurotus por Villaescusa y Gil (2003) quienes observaron que la luminosidad bajó de 96.9, a 61.9, 63.3 y 61.7% a 0, 4 y 7 °C, después de 11 días de almacenamiento, pero sin diferencia entre estas temperaturas.
Como se esperaba, la pérdida de peso fue mayor en el huitlacoche desgranado y ésta se incrementó con la temperatura. Este hecho puede estar relacionado a que durante su manipulación; es decir, al separar las agallas, éstas sufren daños mecánicos y rompimiento de tejido, lo que origina que se pierda agua con mayor facilidad, lo que impacta directamente en la pérdida de peso. Además, la superficie de transferencia o expuesta es mayor, lo que implica mayor transpiración; pero, también se debe considerar que este hongo no posee epidermis o estructuras que limiten el flujo de vapor de agua a la atmósfera circundante, como ocurre en los productos hortofrutícolas.
Las tasas de respiración del huitlacoche desgranado fueron mayores a la del huitlacoche entero, en cualquier temperatura (ambiente, 3 y 10 °C). Resultados similares fueron reportados por Cliffe y O' Borne (2007), quienes encontraron que el champiñón cortado en rodajas, respira aproximadamente 22% más que el entero. La acción de desprender las agallas, puede llevar a un rompimiento de tejido que provoque un incremento en el metabolismo, y por lo tanto un incremento en la respiración. Esto es relevante pues según Kader (2002) la velocidad de deterioro de los productos hortofrutícolas generalmente es proporcional a su velocidad de respiración. Por otro lado, al disminuir la temperatura, la respiración del huitlacoche disminuyó significativamente, aun cuando se encontraron variaciones durante su almacenamiento. Lo anterior es congruente con lo reportado por Jiying et al. (2006) quienes mencionan que temperaturas bajas en postcosecha disminuyen la tasa de respiración del hongo Agaricus bisporus y en general también disminuyen muchos procesos metabólicos que se desarrollan durante su almacenamiento. Villaescusa y Gil (2003) reportan datos que confirman lo anterior, el hongo Pleurotus respira 40.0, 79.2 y 98.4 mlCO2 kg–1·h–1 a la temperatura de 0, 4 y 7 °C, después de 12 horas de refrigeración.
No se detectó producción de etileno por el huitlacoche, este resultado es similar a lo planteado por Villaescusa y Gil (2003), quienes mencionan que durante el periodo de almacenamiento del hongo comestible Pleurotus no se detectó producción de etileno en ninguna temperatura probada (0, 4, 7 °C). Aun cuando es un género distinto, puede ayudarnos a sostener nuestro resultado. Por otro lado, la producción de etileno es realizada casi exclusivamente por tejidos del reino vegetal y los hongos comestibles no pertenecen a éste.
El contenido de aminoácidos del huitlacoche refrigerado en general no sufre un cambio evidente durante su almacenamiento. Sin embargo, puede ser prudente realizar un trabajo con mayor detalle. No obstante, existen evidencias de que otros hongos si presentan cambio de aminoácidos en postcosecha. Tseng y Mau (1999) al trabajar con Agaricus bisporus conservado por 12 días a 12 °C, encontraron que el contenido de azúcares totales, manitol y fructosa se redujeron, mientras que el contenido total de aminoácidos se incrementó de 77.9 g·kg–1 a 140.6 y 151.6 g·kg–1 a los 6 y 12 días respectivamente. El hecho de que el huitlacoche contiene todos los aminoácidos esenciales, no es exclusivo de este hongo, de acuerdo con Crisan y Sands (1978) los hongos comestibles, generalmente contienen todos los aminoácidos esenciales y representan del 20 al 40% del contenido total. Por otro lado, Lizarraga–Guerra y López (1996) encontraron 17 aminoácidos libres en huitlacoche, de los cuales lisina fue el más abundante con 3.2 mg·g–1 de materia seca. Los resultados de este trabajo indican que el huitlacoche contiene mayor cantidad de lisina, comparado con otros hongos comestibles (datos no mostrados). Es bueno considerar que, aun cuando el contenido de lisina es alto, la cantidad de proteína en el huitlacoches es del orden del 10–14% base seca (Venegas et al., 1995).
CONCLUSIONES
El huitlacoche mantenido a temperatura ambiente en general presentó altas tasas de respiración, rápida pérdida de peso (transpiración) y mayores cambios de coloración (obscurecimiento), mientras que la refrigeración redujo considerablemente estos parámetros. Almacenar el huitlacoche entero presenta mejor respuesta a la refrigeración, comparada con el desgranado, lo que permite incrementar su vida útil.
Se comprobó que el huitlacoche es un hongo altamente perecedero, por su alta tasa de respiración y que no produce etileno. Se identificó que el principal problema para incrementar la vida útil del huitlacoche, es evitar la rápida pérdida de peso (deshidratación), que origina rompimiento de agallas.
AGRADECIMIENTO
Se agradece el apoyo financiero del Consejo Nacional de Ciencia y Tecnología (CONACYT) a través del proyecto SEP–2004–C01–47725 "Producción controlada e intensiva de huitlacoche (Ustilago maydis D. C. Corda) y alternativas para su manejo en postcosecha" y al Programa Universitario de Investigación en Alimentos de la Universidad Autónoma Chapingo.
LITERATURA CITADA
BOLKER, M. 2001. Ustilago maydis a valuable model system for the study of fungal dimorphism and virulence. Microbiology 147: 1395–1401. [ Links ]
BROSNAN, T.; SUN, D. W. 2001. Precooling techniques and applications for horticultural products– a review. Intenational Journal of Refrigeration 24: 154–170. [ Links ]
CLAYPOOL, L.; KEEFER, R. M. 1942. A colorimetric method for CO2 determination in respiration. Proc. Amer. Soc. Hort. Sci. 40: 177–188. [ Links ]
CLIFFE, B. V.; D. O'BEIRNE. 2007. Effects of GAS atmosphere and temperature on the respiration rates of whole and sliced mushrooms (Agaricus bisporus) implications for film permeability in Modified Atmosphere Packages. Food Engineering and Physical Properties. 72(4): 197–204. [ Links ]
CRISAN, E. V.; SANDS, A. 1978. Nutricional Value. In: CHANG, S. T.; HAYES, W. A. (eds.). The biology and cultivation of edible mushrooms. Academic Press. London. 137–166 p. [ Links ]
HUTCHINGS, B. J. 1999. Food color and appearance. Second Edition. Ed. Aspen Publishers. USA. pp. 610. [ Links ]
JIYING, Z.; WANG, X.; XU, Y. 2006. Effects of the Postharvest Storage Temperature and its Fluctuations on the Keeping Quality of Agaricus bisporus. International Journal of Food Engineering. Vol. 2. No. 1. [ Links ]
KADER, A. A. 2002. Postharvest Technology of Horticultural Crops. University of California. Division de agriculture and Natural Resources. 535 p. [ Links ]
LIZARRAGA–GUERRA, R.; LOPEZ, M. G. 1996. Content of Free Amino Acids in Huitlacoche (Ustilago maydis). Journal Agric. Food Chem. 44: 2556–2559 [ Links ]
NERYA, O.; BEN–ARIE, R.; DANAI, O.; TAMIR, S.; VAYA, J. 2005. Inhibition of mushroom browning. Acta Hort. (ISHS) 682: 1885–1888. [ Links ]
NERYA, O.; BEN–ARIE, R.; LUZZATTO, T.; MUSA, R.; KHATIV, S.; VAYA, J. 2006. Prevention of Agaricus bisporus postharvest browning with tyrosinase inhibitors. Postharvest Biology and Technology. 39(3): 272–277. [ Links ]
PATAKY, J. K.; CHANDLER, M. A. 2003. Production of huitlacoche, Ustilago maydis: timing inoculation and controlling pollination. Mycologia. 95(6): 1261–1270 [ Links ]
PRATT, H. K.; MENDOZA, D. B. 1979. Calorimetric determination of carbon dioxide for respiration studies. HortScience 14(2): 175–176 [ Links ]
RUIZ–HERRERA, J.; MARTÍNEZ–ESPINOSA, A. D. 1998. The fungus Ustilago maydis, from the aztec cuisine to the research laboratory. Internatl Microbiol. 1: 149–158 [ Links ]
TSENG, Y. H.; MAU, J. L. 1999. Contents of sugars, free amino acids and free 5–nucleotides in mushrooms, Agaricus bisporus, during post–harvest storage. Journal of Science of Food and Agriculture. 79(11): 1519–1523 (resumen) [ Links ]
VENEGAS, P. E.; VALVERDE, M. E.; PAREDES–LÓPEZ, O.; PATAKY, J. K. 1995. Production of the edible fungus huitlacoche (Ustilago maydis): effect of maize genotype on chemical composition. Journal of fermentation and bioengineering. 80(1): 104–106 [ Links ]
VILLAESCUSA, R.; GIL, I. M. 2003. Quality improvement of Pleurotus mushrooms by modified atmosphere packaging and moisture absorbers. Postharvest Biology and Technology. 28: 169–179 [ Links ]
VILLANUEVA, V. C. 1997. Huitlacoche (Ustilago maydis) as a food in Mexico. Micol Neotrop. Apl. 10: 73–81. [ Links ]














