Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.14 no.3 Chapingo Set./Dez. 2008
Poliaminas y acondicionamiento térmico reducen daño por frío y afectan actividad de β–galactosidasa en calabaza zucchini
Polyamine and thermal conditioning reduce chilling injury and affect β–galactosidase activity in zucchini squash
M. A. Martínez–Téllez1, R. R. Balandrán–Quintana2*, R. Soto–Cerón2, A. Quintero–Ramos2 y R. Márquez–Meléndez2
1 Centro de Investigación en Alimentación y Desarrollo, A. C. Coordinación de Tecnología de Alimentos de Origen Vegetal. Carretera a La Victoria Km. 0.6. Apartado postal 1735. Hermosillo, Son. C. P. 83000. México.
2 Facultad de Ciencias Químicas. Universidad Autónoma de Chihuahua. Ciudad Universitaria s/n. Apartado postal 1542–C. Chihuahua, Chih. C. P. 31310. México. Correo–e: rbalandran@ciad.mx (*Autor responsable).
Recibido: 14 de diciembre, 2006
Aceptado: 14 de enero, 2008
Resumen
Se realizó un estudio en calabaza zucchini en dos etapas; en la primera de ellas se evaluó el efecto del almacenamiento a 2.5 y/o 10 °C durante 12 días, así como de un acondicionamiento de 15 °C por 48 h previo al almacenamiento a 2.5 °C, sobre el índice de daño por frío (IDF) y la actividad de la enzima β–galactosidasa. En la segunda etapa se evaluó el efecto de la aplicación exógena de las poliaminas putrescina (PUT), espermidina (SPD) y espermina (SPM) en concentraciones de 0.1, 0.25, 0.5, 1.0, 1.5, 2.0 y 4.0 mM sobre el IDF y la actividad de β–galactosidasa de frutos almacenados a 2.5 °C durante 12 días. En la primera etapa se encontró que el acondicionamiento a 15 °C y el almacenamiento a 10 °C resultaron en una reducción del IDF de 84 y 40%, respectivamente, mientras que la actividad de β–galactosidasa aumentó gradualmente en el curso de 12 días, en respuesta a las condiciones de almacenamiento, con excepción de una disminución, al día 4 a 10 °C. La aplicación de poliaminas redujo el IDF mostrando una mayor efectividad la PUT, seguida de la SPM y la SPD. Asimismo, las poliaminas causaron una reducción significativa (P≤0.05) de la actividad de β–galactosidasa durante 12 días de almacenamiento a 2.5 °C, teniendo un mayor efecto la SPM. Sin embargo, el tratamiento con estos compuestos en concentración de 4.0 mM resultó en un IDF similar al del control.
Palabras clave: Cucurbita pepo L., desórdenes fisiológicos, tecnología postcosecha.
Abstract
This two–stage study was conducted to assess the effect of prior conditioning on the chilling injury index (CII) and enzymatic activity of β–galactosidase in zucchini fruits in cold storage (2.5 or 10 °C). In the first stage, zucchini fruits were conditioned at 15 °C for 48 h prior to storage at 2.5 °C. In the second stage, the polyamines putrescine (PUT), spermidine (SPD) and spermine (SPM) at concentrations of 0.1, 0.25, 0.5, 1.0, 1.5, 2.0 y 4.0 mM, were applied exogenously on fruits stored at 2.5 °C for 12 days. It was found that conditioning at 15 °C and storage at 10 °C reduced CII by 84 and 40%, respectively. β–galactosidase activity increased gradually in the course of 12 d in response to all of the treatments, except for a decrease on day four at 10 °C. Polyamine application at all the concentrations decreased the CII, PUT being the most effective, followed by SPM and SPD. Infiltration of polyamines induced a reduction of β–galactosidase activity during 12 days of storage at 2.5 °C, with SPM having the greatest effect. All the polyamines at 4.0 mM caused a CII similar to that of the control.
Key words: Cucurbita pepo L., physiological disorders, postharvest technology.
INTRODUCCIÓN
El daño por frío (DF) es un desorden fisiológico que afecta a muchas plantas de origen tropical y subtropical y a sus frutos, cuando son expuestos o almacenados a temperaturas entre 2 y 15 °C y posteriormente transferidos a temperaturas superiores. En general, las plantas dañadas por frío presentan inicialmente hojas con hendiduras acuosas o, en el caso de los frutos, zonas blandas en la superficie, las cuales son invadidas por patógenos secundarios, comenzando así su descomposición. Los síntomas pueden ocurrir rápidamente (en el transcurso de varias horas) o retardarse (de algunas horas a varios días) dependiendo de las especies, la magnitud de la baja temperatura y la duración de la exposición (Parkin et al., 1989).
Hay dos formas en que el DF impacta económicamente. Una tiene que ver con el crecimiento y desarrollo de plantas durante la primavera, cuando las temperaturas son bajas, o en cualquier época del año durante el periodo de crecimiento, cuando la temperatura del aire disminuye de manera anormal por debajo de un umbral crítico (Wilson, 1984).
El segundo impacto crítico del DF es el que tiene que ver con el almacenamiento poscosecha. Con excepción de una evidente reducción de la calidad de los cultivos susceptibles, la importancia económica del DF es difícil de cuantificar (Saltveit y Morris, 1990). Grandes volúmenes de productos susceptibles al frío se pierden en el campo cuando baja su demanda en el mercado; ante la incertidumbre de vender o no, el productor prefiere no invertir recursos económicos en la cosecha de los productos, puesto que no podría almacenarlos en refrigeración hasta la mejora de su precio. Así se restringe en gran medida el almacenamiento, manejo y distribución de tales productos.
La calabaza zucchini (Cucurbita pepo L.) es un cultivo de importancia económica en México, susceptible al DF, que puede utilizarse como modelo en estudios relacionados con este desorden fisiológico ya que su respuesta a la baja temperatura se encuentra bien caracterizada y, además, en la costa de Hermosillo, Son., lugar donde se desarrolló el presente estudio, se cultiva en dos fechas por año y en invernaderos, lo cual hace que el cultivo esté disponible durante un tiempo considerable. El DF es un fenómeno poco entendido a nivel bioquímico. Se sabe que la temperatura baja altera la permeabilidad de la membrana celular, conduciendo a desórdenes metabólicos que resultan en el daño (Parkin at al., 1989). Por esta razón, la tecnología para prevenir el DF se basa en la protección a membranas celulares, destacando los acondicionamientos térmicos (Lurie, 1998) y, a nivel experimental, la aplicación de poliaminas (Martínez–Téllez et al., 2002). Estos métodos son relativamente efectivos, pero un conocimiento más profundo de las causas fisiológicas y bioquímicas del DF, así como de los mecanismos de resistencia al frío de las plantas, permitirían desarrollar otros más certeros, diseñar prácticas de cultivo más adecuadas y desarrollar cultivares más resistentes.
Se ha sugerido que algunos oligosacáridos derivados de la pared celular, liberados por vía enzimática, actúan como señales iniciadoras del DF (Balandrán–Quintana et al., 2002). A estos oligosacáridos con actividad biológica se les conoce como oligosacarinas y está demostrado que intervienen en diversas etapas del desarrollo de plantas y estimulan respuestas contra el ataque por patógenos a través de mecanismos del tipo hormonal. Entre las respuestas reportadas se encuentran algunas que son características del DF, como un aumento en la producción de etileno y flujo de iones a través de membranas (Côté y Hahn, 1994). Se han aislado oligosacarinas de pectina y de xiloglucano, ambos presentes en la pared celular. Si las oligosacarinas están involucradas de alguna manera en el mecanismo del DF, un evento previo a su liberación sería un aumento en la actividad de enzimas de pared celular, entre las cuales puede estar la β–galactosidasa, ya que existen evidencias de que su sustrato natural es el xilo–glucano (Edwards et al., 1988). Con el objetivo de hacer un sondeo preliminar, en el presente estudio se evaluó el efecto de la aplicación de las poliaminas putrescina (PUT), espermi–na (SPM) y espermidina (SPD), y de un acondicionamiento a 15 °C previo al almacenamiento a 2.5 °C, temperatura que causa DF en zucchini (Handerburg et al., 1986; Serrano et al., 1998), sobre el desarrollo del DF y la actividad de β–galactosidasa.
MATERIALES Y MÉTODOS
Material vegetal
El estudio se realizó en Hermosillo, Sonora, México, con frutos de calabaza zucchini cosechados durante el mes de abril. Para el estudio se utilizaron 2,500 frutos, que se lavaron con una solución de cloro al 1% y se seleccionaron por tamaño (17 – 20 cm de largo) y atributos de calidad (turgentes, de color verde lustroso, libres de daños físicos y por insectos) el mismo día de la cosecha. Inmediatamente después se dividieron en lotes para aplicar los tratamientos y/o almacenarlos como se describe a continuación. Este fue considerado el día cero del experimento.
Organización experimental
El estudio se dividió en dos etapas. En la primera se evaluó el efecto, sobre el índice de daño por frío (IDF) y la actividad de la enzima β–galactosidasa, de tres tratamientos: (1) almacenamiento a 2.5 (± 1 °C), 85% de humedad relativa (HR) por 12 d; (2) almacenamiento a 10 (± 1 °C), 85% HR por 12 d; (3) acondicionamiento a 15 °C por 48 h y posterior almacenamiento a 2.5 (±1 °C), 85% HR por 12 d. En la segunda etapa se evaluó el efecto de la aplicación exógena de las poliaminas putrescina (PUT), espermidina (SPD) y espermina (SPM), en diferentes concentraciones, sobre el IDF y la actividad residual de β–galactosidasa, en frutos almacenados durante 12 días a 2.5 °C.
Para el experimento de la primera etapa se formaron tres lotes de 100 frutos que se destinaron a cada uno de los tratamientos. Cada cuatro días, durante los 12 días que duró el experimento, se tomaron muestras al azar, consistentes en 25 frutos de cada uno de los lotes. A cinco de ellos se les retiró la piel, de 3 mm de espesor, y se colocó en bolsas de plástico. Las muestras se almacenaron en un ultracongelador a –70 °C, donde permanecieron hasta que se realizó el análisis de β–galactosidasa. En los 20 frutos restantes se determinó el IDF.
Para la segunda etapa se formaron lotes de frutos que fueron infiltrados con las poliaminas PUT, SPM y SPD en concentraciones de 0.1, 0.25, 0.5, 1.0, 1.5, 2.0 y 4.0 mM (se trataron 25 frutos con cada concentración de cada una de las poliaminas; puesto que se realizaron cuatro muestreos, en total se infiltraron con poliaminas 2,100 frutos). Como control se infiltraron 100 frutos con agua destilada. La aplicación se realizó por inmersión de los frutos en 2 litros de solución de poliamina contenida en un desecador, bajo una presión manométrica de aire de 88,260Pa durante 3 min con la finalidad de facilitar la infiltración, de acuerdo con el método reportado por Martínez–Téllez et al. (2002). Los frutos tratados se transfirieron a una temperatura de 2.5 °C donde permanecieron 12 días. Cada cuatro días se colectaron al azar 20 de los frutos infiltrados con cada una de las poliaminas para determinarles IDF y actividad de β–galactosidasa.
Índice de daño por frío (IDF)
El grado de deterioro por frío se evaluó en 20 frutos, tomando como base la extensión del picado superficial de éstos 24 horas después de transferirlos desde la temperatura de almacenamiento hasta la temperatura ambiente (20 °C). Se utilizó una escala hedónica que calificó como 0 (cero) a un fruto sin daño, como uno a un daño ligero (hasta 10% de la superficie del fruto), como dos a un daño moderado (hasta 20%) y como tres a un daño severo (mayor a 20%). La extensión del daño se describe como IDF, que se obtiene para cada subgrupo mediante el producto del número de frutos por el número de la escala de daño. Los productos resultantes se suman y luego se dividen entre el número total de frutos, de acuerdo con la Ecuación (1), donde n(0), n(1), n(2) y n(3) son el número de frutos multiplicado por la calificación 0, 1, 2 o 3, respectivamente, y N es el número de frutos por subgrupo o tratamiento.

Actividad de β–galactosidasa
La actividad de β–galactosidasa se determinó por triplicado de acuerdo con el método de Distler y Jourdian (1978). Veinte gramos de exocarpo se colocaron en un vaso de precipitado en baño de hielo y se agregaron 2 g de polivinilpolipirrolidona (PVPP) y 32 ml de solución amortiguadora helada de fosfato de sodio 0.2 M, pH 7.2. Todos los reactivos fueron proporcionados por la empresa Sigma Chemical Co., St. Louis, MO. La mezcla se homogeneizó en un equipo Ultra Turrax T25 (Janke and Kunkel. IKA–Labortechnik, Alemania). El homogenizado se filtró a través de tela de organza, se midió el volumen del filtrado y se centrifugó a 19,500 rpm en un rotor JA–20 a 4 °C durante 30 min. El sobrenadante se filtró con papel Whatman #1 y este filtrado constituyó el extracto crudo en el cual se determinó la actividad de β–galactosidasa.
La actividad de β–galactosidasa en los extractos crudos se determinó por triplicado incubando 20 μl de extracto con 25 μl de p–nitrofenol–β–D–galactopiranósido como sustrato, 10 μl de albúmina de suero bovino al 1%, y 45 μl de solución amortiguadora citrato–fosfato, pH 4.3, a 37 °C durante 1 h. Luego se detuvo la reacción adicionando 1 μl de solución amortiguadora de glicina 0.25 M, pH 10, y finalmente se midió la absorbencia a 400 nm en un espectrofotómetro Shimadzu (Shimadzu Corp., Japan). Se construyó una curva estándar con p–nitrofenol–β–D–galactopiranósido para cuantificar en cada alícuota el p–nitrofenol liberado por la β–galactosidasa. El contenido de proteínas en cada extracto se cuantificó por el método de Biuret (Layne, 1957). Una unidad de β–galactosidasa se definió como la cantidad de enzima que libera 1 μmol de p–nitrofenol·mg proteína–1·ml–1·h–1 bajo las condiciones del ensayo.
Diseño experimental
El IDF no se evaluó estadísticamente debido a la naturaleza subjetiva de la determinación. Para el análisis estadístico de la actividad de β–galactosidasa se utilizaron diseños completamente al azar con arreglo factorial para evaluar el efecto del acondicionamiento a 15 °C, la temperatura y el tiempo de almacenamiento en la primera etapa, así como el efecto diferencial de las poliaminas aplicadas y la concentración de éstas en la segunda etapa. Se realizó análisis de varianza y comparación de medias por el método de Tukey (P≤0.05) utilizando el software NCSS (Hintze, 2001).
RESULTADOS Y DISCUSIÓN
Etapa I
Índice de daño por frío (IDF)
El acondicionamiento a 15 °C·48 h–1 ocasionó una disminución de 84% en el IDF de los frutos de calabaza zucchini respecto a los almacenados a 2.5 °C, mientras que aquellos almacenados a 10 °C sin acondicionamiento presentaron un 40% de reducción de los síntomas (Figura 1). El efecto a nivel celular que tienen los pre–acondicionamientos con temperatura no ha sido determinado con precisión, sin embargo, algunos autores han relacionado la reducción del IDF con el mantenimiento de la estructura de membranas celulares (debido probablemente a la expresión de proteínas de choque térmico) en frutos de calabaza zucchini (Lurie, 1998). Lo anterior se ha acompañado de una disminución en la pérdida de fosfolípidos y galactolípidos, que generalmente ocurre a nivel celular a bajas temperaturas, y de la conservación del grado de insaturación de los ácidos grasos, así como de un decremento en la relación esteroles libres:fosfolípidos de la membrana celular (Wang, 1993).

Actividad de β–galactosidasa
De acuerdo con el ANOVA, el efecto principal de la temperatura de almacenamiento no fue significativo (P≤0.05) sobre la actividad residual de la enzima β–galactosidasa. El efecto principal del tiempo de almacenamiento, así como la interacción tiempo–temperatura fueron significativos sobre la actividad de esta enzima. En la Figura 2 se aprecia que la actividad se incrementó gradualmente en función del tiempo de almacenamiento a 2.5 °C, detectándose un aumento del 23% a los 12 días con relación al valor encontrado al día cero. En los frutos pre–acondicionados a 15 °C·48–1 h el comportamiento fue muy similar al encontrado en los frutos almacenados a 2.5 °C durante los primeros ocho días, pero luego disminuyó significativamente al día 12. También se observó una disminución significativa de la actividad de β–galactosidasa al cuarto día de almacenamiento a 10 °C, con un aumento transitorio al día ocho, para, finalmente, disminuir al día 12.
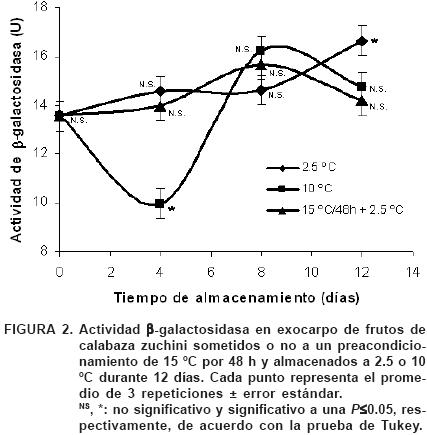
El acondicionamiento a 15 °C minimizó los síntomas del DF incluso más que el almacenamiento a 10 °C (Figura 1), pero en ambos tratamientos la actividad de β–galactosidasa presentó un patrón similar, con excepción de lo encontrado al día 4 a 10 °C. Lo anterior sugiere que alrededor del día cuatro, cuando la temperatura es de 2.5 °C, la enzima puede estar involucrada en ciertos eventos metabólicos para preparar al tejido en su respuesta al frío, puesto que a 2.5 °C la calabaza zucchini sufre de DF (Handerburg et al., 1986; Serrano et al., 1998). Sin embargo, a 10 °C, temperatura a la que no hay síntomas de DF en zucchini, la enzima no refleja un aumento en su actividad, posiblemente debido a que no hubo una señal que la activara para desencadenar una respuesta. Esto también sugiere que el pre–acondicionamiento surte efecto hasta después del día cuatro y que la β–galactosidasa podría estar involucrada en el mecanismo de protección contra el DF.
Etapa II
Indice de daño por frío (IDF)
La aplicación de poliaminas también redujo el IDF de los frutos de zucchini en el transcurso de 12 días de almacenamiento a 2.5 °C (Figura 3). La PUT mostró mayor efectividad para reducir los síntomas de DF, seguida de la SPM y SPD. Entre las concentraciones utilizadas se obtuvieron mejores resultados con la de 0.1 mM, mientras que la aplicación de cualesquiera de las poliaminas en concentraciones 4.0 mM resultó en un deterioro por frío casi igual al del control. Estos resultados concuerdan con los reportados por Martí–nez–Téllez et al. (2002) quienes encontraron una reducción de los síntomas de DF en frutos de calabaza zucchini infiltrados con poliaminas; sin embargo, en ese estudio se reportó que la poliamina que mostró mayor efectividad fue la SPD, en concentración 0.5 mM. Las diferencias entre esos resultados y los del presente trabajo podrían deberse a que los frutos fueron de diferente cosecha. Se ha propuesto que las poliaminas pueden prevenir el DF protegiendo a los lípidos de membrana contra la peroxidación (Kramer y Wang, 1989; Wang, 1993). También se ha encontrado que los niveles endógenos de PUT aumentan en frutos de calabaza zucchini durante el estrés por frío (Kramer y Wang, 1989). Sin embargo, algunos autores proponen que la acumulación de poliaminas debida a estreses abióticos puede causar daños a los frutos (Slocum y Flores, 1991). Esta puede ser la razón por la cual los frutos que se infiltraron con la concentración más alta de poliaminas manifestaron un mayor daño.

Actividad de β–galactosidasa
La aplicación de las tres poliaminas redujo significativamente (P≤0.05) la actividad de β–galactosidasa durante 12 días de almacenamiento a 2.5 °C. La SPM logró este efecto en mayor grado, con una reducción del 39.34%, mientras que la PUT y SPD, sin ser estadísticamente diferentes entre sí, redujeron la actividad de la enzima en un 30 y 28%, respectivamente (Figura 4). El tiempo de almacenamiento y la concentración de las poliaminas no fueron significativos sobre la actividad de β–galactosidasa.

La reducción en la actividad de enzimas por efecto de las poliaminas está reportado en otros sistemas vegetales. Se ha encontrado una reducción en la actividad de la enzima lipoxigenasa por incubación con SPM, atribuyendo este hecho a que las poliaminas actúan como secuestradores de radicales superóxido (Tiburcio et al. 1990). Al parecer el número de grupos amino en la molécula de poliamina es un factor determinante para su actividad como secuestrador de radicales (Bors et al., 1989). La SPM tiene cuatro grupos amino, lo cual la hace un secuestrador más efectivo de superóxidos que la triamina SPD. En el presente estudio la SPM con sus cuatro grupos amino, fue la poliamina más efectiva en reducir la actividad de β–galactosidasa, sin embargo, es necesario encontrar el mecanismo mediante el cual se da este efecto, así como su explicación a nivel bioquímico.
En otros estudios, Carley et al. (1983) reportaron que la SPM inhibe la actividad de poligalacturonasa, y se ha encontrado que esta misma poliamina estimula la actividad de la D–glucosa–6–fosfato–ciclohidrolasa, que está involucrada en la síntesis de sustancias pécticas y de hemicelulosa (Cho et al., 1986). Esto sugiere que las poliaminas contribuyen indirectamente en el mantenimiento de la estructura de las paredes celulares.
La β–galactosidasa no es una de las principales enzimas en el proceso de ablandamiento de frutos, ya sea durante la etapa de maduración o cuando ocurren eventos que aceleran dicho proceso, como los daños por estreses, bióticos o abióticos. De hecho, no se sabe con exactitud cuál es la función de las β–galactosidasas en la célula vegetal. Se sabe que el xiloglucano es el sustrato natural para la β–galactosidasa en algunas dicotiledóneas, pero su función in vivo no está clara aún. Se piensa que está involucrada en los cambios que sufre la pared celular durante el desarrollo y maduración de plantas y frutos, respectivamente (Smith et al., 2002). Se ha sugerido que la degradación de galactanos llevada a cabo por estas enzimas podría determinar cambios estructurales y afectar la porosidad de la pared celular, y que el aumento en el tamaño del poro permitiría el acceso de otras enzimas a su sustrato (Esteban et al., 2003).
Tampoco se conocen bien los mecanismos por los que se presenta el DF, pero existe la hipótesis de que dicho desorden se podría activar mediante oligosacarinas liberadas de la pared celular durante la exposición de los frutos sensibles a las bajas temperaturas (Balandrán–Quintana et al., 2002). En este escenario la β–galactosidasa intervendría aportando fracciones de oligómeros para la formación de oligosacáridos activos (oligosacarinas). Esto podría explicar la mayor actividad de β–galactosidasa en los frutos almacenados a 2.5 °C.
El hecho de que los tratamientos que reducen el DF también tengan un efecto significativo en la reducción de la actividad de β–galactosidasa sugiere una participación de esta enzima en el mecanismo del DF y se cree que esto ocurre con la liberación de oligosacáridos con funciones de señalización, lo cual motiva la necesidad de conducir trabajos de investigación adicionales a nivel de biología molecular para saber si esta enzima es sintetizada de novo en respuesta al frío.
CONCLUSIONES
Los frutos de calabaza zucchini acondicionados a 15 °C durante 48 h y posteriormente almacenados a 2.5 °C durante 12 días, así como los no acondicionados y almacenados a 10 °C durante el mismo periodo, manifestaron un menor IDF que aquellos almacenados a 2.5 °C por 12 días sin un acondicionamiento previo.
El acondicionamiento a 15 °C y la temperatura de almacenamiento no tuvieron efecto significativo sobre la actividad de β–galactosidasa. La interacción tiempo–temperatura fue significativa sobre la actividad de β–galactosidasa, con incrementos graduales en función del tiempo para todas las temperaturas, a excepción de una reducción significativa al cuarto día a 10 °C.
La aplicación de poliaminas redujo significativamente el IDF siendo la PUT más efectiva en este respecto, seguida de SPM y SPD. La aplicación de cualesquiera de las poliaminas en concentraciones 4.0 mM aumentó el IDF. El tipo de poliamina infiltrada causó una reducción significativa de la actividad de β–galactosidasa durante 12 días de almacenamiento a 2.5 °C, teniendo un mayor efecto la SPM.
LITERATURA CITADA
BALANDRÁN QUINTANA, R. R.; MENDOZA WILSON, A. M.; ÁLVAREZ MANILLA, G.; BERGMANN, C.; VARGAS ARISPURO, I.; MARTÍNEZ TÉLLEZ, M. A. 2002. Effect of pectic oligomers on physiological responses of chilling injury in discs excised from zucchini (Curcubita pepo L.). Biochemical and Biophysical Research Communications 290: 577–584. [ Links ]
BORS, W.; LANGEBARTEL, S. C.; MICHEL, C.; SANDERMANN, H. JR. 1989. Polyamines as radical scavengers and protectants against ozone damage. Phytochemistry 28: 1589–1595. [ Links ]
CARLEY, E.; WOLOSIUK, R. A.; HERTIG, C. M. 1983. Regulation of the activation of chloroplast fructosa–1,6–bis phosphatase (E.C.3.1.3.11). Inhibition by spermidine and spermine. Biochemical and Biophysical Research Communications 115: 717–710. [ Links ]
CHO, Y. D.; LEE, S. M.; KANG, Y. H.; KIM, M. W.; JIN, E. S. 1986. Cell biological studies on growth and development. Effect of polyamines on d–glucose–6–phosphate cyclohydrolase. Korean Journal of Botany 29: 263–274. [ Links ]
CÔTÉ, F.; HAHN, M. G. 1994. Oligosaccharins: structures and signal transduction. Plant Molecular Biology 26: 1379–1411. [ Links ]
DISTLER, J. J.; JOURDIAN, G. W. 1978. Methods in enzymology. Vol. L. In: Complex Carbohydrates. Part C. Ginsburg, V. (ed.). Academic Press. N.Y. 514 p. [ Links ]
EDWARDS, M.; BOWMAN, Y. J.; DEA, I. C.; REID, J. S. 1988. A beta–D–galactosidase from nasturtium (Tropaeolum majus L.) cotyledons. Purification, properties, and demonstration that xyloglucan is the natural substrate. J. Biol. Chem., 263: 4333–4337. [ Links ]
ESTEBAN, R.; DOPICO, B.; MUÑOZ, F. J.; ROMO, S.; MARTÍN, I.; LABRADOR, E. 2003. Cloning of a cicer arietinum β–galactosidase with pectin–degrading function. Plant & Cell Physiology 44: 718–725. [ Links ]
HANDERBURG, R. E.; WATADA, A. E.; WANG, Y. C. 1986. The Commercial Storage of Fruits, Vegetables, Florist and Nursery Stocks. USDA Handbook. 66 p. [ Links ]
HINTZE, J. 2001. Number Cruncher Statistical Systems (NCSS). Kaysville, Utah. [ Links ]
KRAMER, G. F.; WANG, C. Y. 1989. Reduction of chilling injury in zucchini squash by temperature management. HortScience 24: 995–996. [ Links ]
LAYNE, E. 1957. Spectrophotometric and turbidimetric methods for measuring proteins. Methods in Enzymology 10: 447–455. [ Links ]
LURIE, S. 1998. Postharvest heat treatments of horticultural crops. Horticultural Reviews 22: 91–119. [ Links ]
MARTÍNEZ TÉLLEZ, M. A.; RAMOS CLAMONT, M. G.; GARDEA, A.; VARGAS ARISPURO, I. 2002. Effect of infiltred polyamines on polygalacturonase activity and chillling injury responses in zucchini squash (Curcubita pepo L.). Biochemical and Biophysical Research Communications 295: 98–100. [ Links ]
PARKIN, K. L.; MARANGONI, A.; JACKMAN, R. L.; YADA, R. Y.; STANLEY, D. W. 1989. Chilling injury. A review of posible mechanisms. Journal of Food Biochemistry 13: 127–153. [ Links ]
SALTVEIT, M. E.; MORRIS, L. L. 1990. Overview on chilling injury of horticultural crops. pp. 3–15. In: Chilling Injury of Horticultural Crops. C. Y. Wang (ed.). CRC Press Inc., Boca Raton. FLO. [ Links ]
SERRANO, M.; PRETEL, T.; MARTÍNEZ–MADRID, M. C.; ROMOJARO, F.; RIQUELME, F. 1998. CO2 treatment of zucchini squash reduces chilling–induced physiological changes. Journal of Agricultural and Food Chemistry 46: 2465–2468. [ Links ]
SLOCUM R. D.; FLORES, H. E. 1991. Biochemistry and Physiology of Polyamines in Plants. CRC Press. Boca Raton, Fl. [ Links ]
SMITH, D. L.; ABBOTT, J. A.; GROSS, K. C. 2002. Down–regulation of tomato β–galactosidase 4 results in decreased fruit softening. Plant Physiology 129:1755–1762. [ Links ]
TIBURCIO, A. F.; FIGUEROA, X.; CAMPOS, J. L. 1993. Poliaminas. En: Fisiología y Bioquímica Vegetal. AZCÓN–BIETO, J.; TALÓN, M. (eds). McGraw–Hill. Madrid. 357–379. [ Links ]
WANG, C. Y. 1993. Approaches to reduce chilling injury of fruit and vegetables. Horticultural Reviews 15: 63–95. [ Links ]
WILSON, J. M. 1984. The economic importance of chilling injury. Outlook Agricultural 14: 197–203. [ Links ]














