Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.14 no.2 Chapingo Mai./Ago. 2008
Prohexadiona de calcio disminuye el contenido de giberelinas endógenas en ápices de tomate saladette y chile pimiento
Prohexadione calcium decreases the content of endogenous gibberellins in shoot apex of tomato saladette and bell pepper
H. Ramírez1*, B. Herrera–Gámez1, Y. H. Méndez–Quiroa1, A. Benavides–Mendoza1, J. A. De la cruz–Breton2, V. Álvarez–Mares3, J. H. Rancaño–Arrioja1 y J. A. Villareal–Quintanilla4
1 Departamento de Horticultura, Universidad Autónoma Agraria Antonio Narro. Buenavista, Saltillo, Coahuila. México. Correo–e: homeror@terra.com.mx (*Autor responsable).
2 Departamento de Fitomejoramiento, Universidad Autónoma Agraria Antonio Narro. Buenavista, Saltillo, Coahuila. México.
3 Impulsora Agropecuaria e Insumos para Invernaderos. Saltillo, Coahuila, México.
4 Departamento de Botánica, Universidad Autónoma Agraria Antonio Narro. Buenavista, Saltillo, Coahuila. México.
Recibido: 13 de marzo, 2007
Aceptado: 5 de diciembre, 2007
Resumen
Con el propósito de evaluar el efecto de prohexadiona de calcio (P–Ca) en el contenido endógeno de giberelinas en ápices de tomate saladette (Lycopersicon esculentum Mill.) y chile pimiento (Capsicum annuum L.), se aplicaron tres dosis del retardante (125, 175 y 200 mg·litro–1) y un testigo (H2O) en ambas hortalizas en el estadio de plántula con seis hojas verdaderas. Los ápices se cosecharon los días 0, 1, 3 y 6 después de haber realizado la aplicación de los tratamientos, y las muestras se liofilizaron para su análisis en laboratorio. Se realizaron análisis cuantitativo y cualitativo de giberelinas, mediante cromatografía de gases y espectrometría de masas. Se encontró que los ápices de tomate saladette tratados con P–Ca mostraron un menor contenido de las giberelinas A4 y A7 a partir del siguiente día de haberse aplicado los tratamientos. Esta tendencia fue consistente hasta el sexto día de evaluación. Resultados similares se registraron con los ápices de chile pimiento. Los análisis de cromatografía de gases y espectrometría de masas, permitieron identificar en ápices tratados con P–Ca la giberelina A20 en tomate saladette, mientras que las giberelinas A20 y A53 estuvieron presentes en chile pimiento. En los ápices testigo de ambas hortalizas, se encontraron las giberelinas A1, A4 y A7.
Palabras clave: tomate, chile pimiento, giberelinas, hormonas.
Abstract
To evaluate the effects of prohexadione–calcium (P–Ca) on endogenous gibberellins levels in saladette tomato (Lycopersicon esculentum Mill.) and bell pepper (Capsicum annuum L.) shoot apex this study was conducted. Growth retardant was sprayed at three dosages (125, 175 and 200 mg·liter–1) and a control (H2O) was also included in both vegetables crops when six true leaves appeared in seedlings. Shoots apex was collected at 0, 1, 3 and 6 days after treatments, and were later lyophilized. Gas chromatography and mass spectrometry assays (GCMS) was used for quantitative and qualititative gibberellins analysis. Results showed that saladette tomato apex sprayed with P–Ca reflected less A4 and A7 gibberellins from the first day after treatment. This tendency was similar in bell pepper samples. The GCMS analysis allowed A20 gibberellin identification in tomato, and A20 and A53 gibberellins in bell pepper samples from P–Ca treated plants. The A1, A4 and A7 gibberellins were detected in control samples.
Key words: tomato, bell pepper, gibberellins, hormones.
INTRODUCCIÓN
El cultivo de hortalizas contribuye en forma importante con la economía de México. En la actualidad se siembran 512,000 ha de este grupo hortícola con una producción de 8 millones de toneladas, de las cuales se exportan 600 mil toneladas anuales aproximadamente y tienen su destino principal a Estados Unidos y Canadá (SIAP, 2000).
De jitomate y chile, se cosechan 2.14 millones de toneladas del primero y 1.85 millones del segundo (INFOAGRO, 2002a y b). Debido a la importancia de estas hortalizas es necesario generar continuamente nuevas formas de manejo de los cultivos para eficientar los rendimientos y ofrecer calidad en los productos. En la actualidad las hormonas vegetales o biorreguladores ofrecen una magnífica oportunidad para mejorar los sistemas de producción hortícolas. El uso de estas sustancias tiene la ventaja de producir efectos que no son permanentes y por lo tanto, de ser modificados de acuerdo a las necesidades del horticultor (Ramírez, 2003).
Los retardantes de crecimiento de las plantas retrasan la división y elongación celular en tejidos de brotes, regulando de esta forma la altura de las plantas, de manera fisiológica, sin provocar malformaciones en las hojas o los tallos (Graebe, 1987; Weaver, 1996; Rademacher, 2000).
En tomate se han utilizado productos como daminozida y clormequat con acción en la inhibición de la biosíntesis de giberelinas otorgando un porte bajo a las plantas (Rojas y Ramírez, 1987). Sin embargo, Owens y Stover (1999) mencionan que estos productos además del paclobutrazol tienen la desventaja de prolongar su persistencia en las plantas, tienen propiedades toxicológicas y su uso es preocupante.
Prohexadiona de calcio (P–Ca) podría representar una interesante herramienta complementaria para las prácticas culturales y el material genético usado para conseguir y mantener un equilibrio vegetativo–reproductivo en cultivos hortícolas (Costa et al., 2004). Ya que se asume que reduce la elongación celular, teniendo como efecto una reducción de la estructura morfológica de las plantas (Grossmann et al., 1987) siendo antagonista de las giberelinas y auxinas que son las hormonas vegetales primarias responsables del crecimiento vegetativo (Rademacher, 2000).
El conocimiento sobre la influencia del prohexadiona–Ca en la fisiología vegetal de varios cultivos hortícolas (Ramírez, et al., 2005) permite considerar a este retardante de crecimiento como un biorregulador que puede contribuir a controlar el crecimiento vegetativo durante las primeras etapas de desarrollo de especies como el jitomate y chile pimiento. Por lo anteriormente expuesto, se tiene como objetivo determinar e identificar el contenido de giberelinas endógenas en ápices de tomate saladette y chile pimiento al aplicar prohexadiona de calcio.
MATERIALES Y MÉTODOS
La presente investigación se llevó a cabo en Buenavista, Saltillo, Coahuila, México, a 25° 23' latitud Norte y 101° 01' longitud Oeste, con una altitud de 1,743 m.
Se sembraron semillas de chile pimiento (Capsicun annuum L.) var. Capistrand y tomate saladette (Lycopersicon esculentum Mill.) var. Río Grande (crecimiento determinado), ambas en charolas de poliestireno de 200 cavidades cada una, utilizando como sustrato peat moss. La siembra se realizó el 20 de junio de 2005 en un invernadero con control de temperatura y humedad relativa. Se usaron cuatro tratamientos a dosis de 0 (testigo), 125, 175 y 200 mg·litro–1 de P–Ca. Los tratamientos se aplicaron mediante aspersión el día 25 de junio en las primeras horas de la mañana, cuando las plántulas tenían 6 hojas verdaderas. Las plantas fueron muestreadas los días 0, 1, 3 y 6 después de la aplicación de los tratamientos.
En cada muestreo se cosecharon cinco ápices de ambas hortalizas por cada tratamiento. Las muestras fueron envueltas en papel aluminio, selladas y perfectamente identificadas, se colocaron en hielo y se transportaron al laboratorio de fisiología hormonal para mantenerlas a una temperatura de –25 °C hasta su posterior liofilización antes de su análisis de giberelinas. Se empleó un diseño completamente al azar con los cuatro tratamientos anteriormente referidos con tres repeticiones. Los resultados obtenidos fueron analizados con el programa estadístico SAS (2000), para Windows versión 8.1 para obtener el análisis de varianza y comparación de medias mediante la prueba de DMS (P≤0.01) y fueron graficados con el programa Minitab versión 14 (Cinta et al., 2004).
Análisis de giberelinas
Análisis cuantitativo
Se utilizó una muestra consistente de 1 g de peso seco; se colocó en un matraz Erlen Meyer al cual se le agregaron 50 ml de metanol (80%). Las muestras obtenidas se conservaron durante 24 h en congelación (–15 °C). Posteriormente se filtraron en papel Wathman #1 a temperatura de 24 °C. Esta actividad se repitió con el filtrado en dos ocasiones con igual cantidad de metanol (100%) cada 4 h a la misma temperatura, los tres filtrados integrados en un matraz bola de 250 ml fueron evaporados a temperatura de 50 °C para separar la muestra del metanol utilizando un equipo de evaporación rotativa con baño maría. Enseguida se procedió a la purificación de las muestras a través de la separación de impurezas, empleando cápsulas de Sep Pack C18 para separación rápida de hormonas a base de sílica gel. Lo anterior se realizó utilizando la técnica reportada por Ramírez et al. (2001). Enseguida, las muestras se sometieron a cromatografía de capa fina (CCF) utilizando sílica gel GF254, y como solventes separadores isopropanol–amoniaco–agua (10:1:1) (v:v:v) durante 4 h, a temperatura de 20 °C. Como referencia se utilizó giberelina A4/7 la cual se localizó en los Rf 0.5–0.7 con luz ultravioleta. Al terminar este tiempo, las giberelinas en los Rf de cada muestra, fueron separadas y acondicionadas para su medición analítica (Stephan et al., 1998). Cada muestra purificada fue metilada con diazometano preparado in situ y el contenido de giberelinas fue analizado al inyectarse 0.1 ml de la solución a un cromatógrafo líquido de alta presición modelo Finnigan TSQ 7000 equipado con nitrógeno como gas y una columna Ultrasep Es 100 RP–18 de 1 m de largo por 0.43 mm de diámetro interno y empacada con acetonitrilo: agua conteniendo 0.2% de ácido acético en proporción 50:50 (v:v) con un flujo de 70 ml·min–1. La giberelina A4/7 fue utilizada como referencia analítica durante el programa de corridas por determinación cuantitativa de las giberelinas presentes en el tejido estudiado a través de la generación de la curva de calibración correspondiente, utilizando también 0.1 ml a concentraciones de 1, 10 y 100 ng de AG4/7 diluidos en acetona–metanol (50:50) (v:v).
Análisis cualitativo
Las muestras de CCF con mayor contenido de giberelinas fueron preparadas para identificar el tipo de giberelinas presentes, utilizando la técnica de cromatografía de gases (CG) y espectometría de masas (EM). Un gramo de peso seco de la muestra referida fue disuelta en 0.1 ml de acetona (98%)–metanol (98%) en la proporción 50:50 (v:v) y metilado con diazometano. Una proporción del extracto metilado fue disuelto en 0.1 ml de piridina y tratado con 0.1 ml de trimetil clorosilano y hexametildisilazano. Las alícuotas fueron examinadas con un separador de membrana de silicón Pye 104 CLC acoplado a un espectrómetro de masas AEI MS30. En este equipo se instalaron columnas de vidrio salinizadas (213 x 0.2 cm) con 2% de Se–33, en 88–100 de gas chorm Q. La proporción de flujo fue de 25 ml·min–1 y la temperatura de la columna fue programada entre 180 a 280 °C a 2 °C·min–1. La espectrometría de masas fue determinada a 24 eV en una fuente de temperatura de 190 °C y una velocidad de búsqueda de 6.5 s por década de masas. El espectro fue registrado por una computadora Dec Lin 8. La identificación fue conducida por la comparación del índice retención kovats (KRI) y el espectro de espectrometría de masas de sus metil ester trimetilsilil éter con sus derivados de las muestras originales.
RESULTADOS Y DISCUSIÓN
El contenido de giberelinas en ápices de tomate saladette var. Río Grande y chile pimiento var. Capistrand se muestran en las Figuras 1 y 2 respectivamente. Se observó entre los testigos de estas especies, que el tomate saladette siempre mostró un mayor contenido de giberelinas biológicamente activas comparándolo con el chile pimiento (P≤0.01). Esta mayor concentración de giberelinas de acuerdo con Nakayama et al. (1992) se vería reflejado en un mayor crecimiento de la especie.
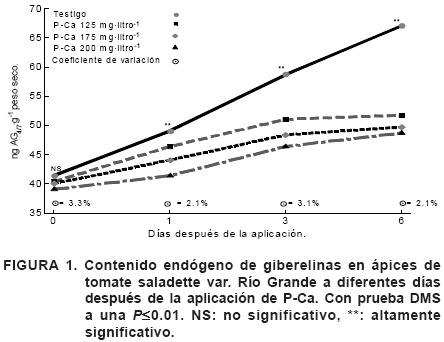

En los ápices de tomate saladette del primer muestreo, realizado inmediatamente después de la aplicación del tratamiento, no se encontró diferencia significativa entre tratamientos con un coeficiente de variación (CV) de 3.3%, sin embargo, el testigo presentó el nivel más alto de giberelinas siendo de 41.3 ng AG4/7·g–1 de peso seco; mientras que los ápices tratados con 200 mg·litro–1 de P–Ca presentaron un valor de 39.3 ng AG4/7·g–1 de peso seco. Los tratamientos presentaron una diferencia altamente significativa (P≤0.01) en el muestreo del primer día después de la aplicación de P–Ca con un CV de 2.1%, donde los niveles de giberelinas en los ápices tratados con P–Ca fueron menores en comparación al testigo. El nivel más bajo de giberelinas se presentó al aplicar 200 mg·litro–1 de P–Ca, seguido de las dosis 175 y 125 mg·litro–1 de P–Ca, y por último el testigo, cuyos valores fueron de 41.3, 44.0, 46.3 y 49.0 ng AG4/7·g–1 de peso seco respectivamente. Los valores del día 3 mostraron un CV de 3.1% y una diferencia altamente significativa (P≤0.01) en los niveles de giberelinas de cada tratamiento, nuevamente los ápices con aplicaciones de P–Ca presentaron niveles de giberelinas más bajos que el testigo. Las plantas que presentaron los niveles mas bajos de giberelinas, fueron las que recibieron la aplicación de 200 mg·litro–1 de P–Ca; las cuales mostraron un valor de 46.3 ng AG4/·g–1 de peso seco.
Los niveles de giberelinas en el tomate saladette aumentan conforme se desarrolla la planta, sin embargo, los tratamientos con prohexadiona de calcio mantienen sus niveles de giberelinas por debajo de los que presenta el testigo. En el muestreo del día 6 después de la aplicación de los tratamientos se presenta una diferencia altamente significativa (P≤0.01), y un CV de 2.1%. El testigo presentó niveles altos en comparación a los tratamientos con P–Ca. La aplicación de 200 mg·litro–1 de P–Ca originó un valor de 48.7 ng AG4/7·g–1 de peso seco; mientras que el testigo mostró un valor de 67.0 ng AG4/7·g–1 de peso seco (Figura 1).
Los resultados en los muestreos de los ápices de chile pimiento, fueron similares a los de tomate saladette (Figura 2). El primer muestreo de ápices realizado después de la aplicación de P–Ca, no mostró diferencia entre tratamientos y presentó un CV de 6.9%, determinando 38.0 ng AG4/7·g–1 de peso seco para 175 mg·litro–1 de P–Ca y el testigo.
Un día después de la aplicación de P–Ca los ápices seleccionados mostraron un CV de 2.9% y una diferencia altamente significativa entre tratamientos (P≤0.01), donde la aplicación de 200 mg·litro–1 de P–Ca presentó 43.7 ng AG4/7·g–1 de peso seco y el testigo 49.3 ng AG4/7·g–1 de peso seco, correspondientes al menor y mayor nivel de giberelinas respectivamente. En la colecta del día 3, los ápices de chile pimiento tratados con P–Ca mantenían sus niveles de giberelinas por debajo del testigo, mostrando también una diferencia altamente significativa entre los tratamientos (P≤0.01) con un CV de 2.4%. El menor nivel lo presentaron los ápices tratados con 200 mg·litro–1 de P–Ca con un valor de 46.3 ng AG4/7·g–1 de peso seco. Los ápices muestreados el día 6 también presentaron diferencia altamente significativa (P≤0.01) con un CV de 3.4%.
Los análisis de cromatografía de gases y espectrometría de masas, en ápices tratados con P–Ca, permitieron identificar AG20 en tomate saladette (Cuadro 1) y AG20 y AG53 en chile pimiento (Cuadro 2). En ápices testigo de ambas hortalizas, se encontraron las giberelinas A1, A4 y A7 (Cuadros 1 y 2).


Ciertos reguladores del crecimiento comerciales que inhiben la elongación del tallo y causan atrofia general tienen este efecto debido en parte a que inhiben la síntesis de giberelinas (Salisbury y Ross, 1994). Prohexadiona de calcio inhibe la biosíntesis de crecimiento activada por giberelinas (Evans et al., 1999), esto corresponde a los resultados obtenidos en los niveles endógenos de giberelinas que presentaron los ápices de tomate saladette y chile pimiento tratados con P–Ca.
No existió diferencia en los niveles de giberelinas en ápices de tomate saladette y chile pimiento muestreados inmediatamente después de la aplicación de los tratamientos (Figuras 1 y 2). Esto pudo deberse a lo mencionado por Evans et al. (1999), ya que para una máxima absorción en el follaje, en manzano, P–Ca requiere un mínimo de 8 h.
Ramírez et al. (2005), al aplicar diferentes dosis de P–Ca en tomate saladette de crecimiento determinado e indeterminado redujo los niveles de giberelinas en meristemos apicales, esto fundamenta el por que los ápices tratados con P–Ca registraron niveles de giberelinas menores a los registrados por el testigo.
En el presente experimento los niveles de giberelinas de ápices tratados con P–Ca aumentan al transcurrir los días, siempre por debajo de los niveles presentados por el testigo (Figuras 1 y 2), debido a que el crecimiento de las plantas tratadas con retardantes del crecimiento no se suprime por completo (Weaver, 1996; Srivastava, 2001; Jankiewicz, 2003). Resultados similares en diferentes cultivos se han obtenido con otros retardantes del crecimiento como clormequat y paclobutrazol, presentando ambos una prolongada persistencia además de poseer propiedades toxicológicas (Owens y Stovers, 1999). En contraste, P–Ca se degrada en las plantas en un tiempo medio de pocas semanas de vida (Evans et al., 1999).
Ramírez et al. (2006), encontraron AG12 y AG20 (giberelinas biológicamente inactivas) en ápices de tomate saladette de crecimiento determinado e indeterminado tratados con P–Ca. La aplicación de P–Ca reduce los niveles de AG1 (altamente activa) y causa acumulación de su inmediato precursor, AG20 (inactivo) (Nakayama et al., 1990; Junttila et al., 1991; Nakayama et al., 1992; Evans et al., 1999). Esto coincide con los resultados obtenidos en el presente experimento (Cuadros 1 y 2), ya que además de encontrar AG20 en los ápices de tomate saladette y chile pimiento tratados con P–Ca, también se presentó en chile pimiento AG53, ésta es, según Weaver (1996), también una giberelina biológicamente inactiva. La presencia de AG1 en el testigo está bien sustentada, debido a que hay suficiente evidencia que indica que ésta es una de las principales giberelinas necesarias para la elongación del tomate y otras especies (Salisbury y Ross, 1994; Srivastava, 2001).
Nakayama et al. (1992) al aplicar P–Ca en arroz en su estadio fenológico de cuatro hojas verdaderas y cosechar los brotes a los días 5 y 12 después de la aplicación, encontraron una disminución significativa en los niveles de AG1 del 36 y 18% respectivamente. Los niveles de AG19 y AG20 se incrementaron, pero los niveles de AG53 se mantuvieron estables en las plantas tratadas reduciendo el crecimiento en un 78 y 66% respectivamente con referencia a las plantas testigo.
Estos resultados sugieren que el mecanismo principal de acción de P–Ca in vivo es la inhibición de la 3β–hidroxilación de AG20 a AG1 (Rademacher, 1993) y soporta la hipótesis que AG1, no AG19 ni AG20 es activa en promover la elongación de los brotes en arroz. (Nakayama et al., 1991; Nakayama et al., 1992).
Ramírez et al. (2003) al aplicar 250 mg·litro–1 de P–Ca en brotes nuevos de manzano encontraron que disminuía de manera significativa el contenido de giberelinas a partir del día dos de muestreo hasta el día 17; posteriormente, el contenido de giberelinas en brotes tratados fueron superiores al testigo.
CONCLUSIONES
Con base en los resultados obtenidos y bajo las condiciones en que se realizó el trabajo experimental, se concluye lo siguiente:
La aplicación de prohexadiona de calcio a plántulas de tomate saladette y chile pimiento a dosis de 125, 175 y 200 mg·litro–1 reduce el contenido de giberelinas endógenas en el ápice. El retardante bloquea la síntesis de giberelinas A1, A4 y A7 en ambas especies.
LITERATURA CITADA
CINTA, G.; ALMAGRO, M.; LLABRÉS, T. M. 2004. Estadística práctica con minitab. Pearson educación, S. A. Madrid, España 448 pp. [ Links ]
COSTA, G.; SABATINI, E.; SPINELLI, F.; ANDREOTTI, C.; BOMBEN, C.; VIZZOTTO, G. 2004. Two years of application of prohexadione–ca on apple: Effect on vegetative and cropping performance, fruit quality, return bloom and residual effect. Acta Horticulturae 653: 35–40. [ Links ]
EVANS, J. R.; EVANS, R. R.; REGUSCI, C. L.; RADEMACHER, W. 1999. Mode of action, metabolism, and uptake of BAS 125 W, prohexadione–calcium. HortScience 34(7): 1200–1201. [ Links ]
GRAEBE, J. E. 1987. Gibberellin biosynthesis and control. Annual Review of Plant Physiology 38: 419–465. [ Links ]
GROSSMANN, K.; KWIATKOWSKI, J.; SIEBECKER, H.; JUNG, J. 1987. Regulation of plant morphology by growth retardants. Effects on phytohormone levels in soybean seedlings determined by immunoassay. Plant Physiology 84: 1018–1021. [ Links ]
INFOAGRO. 2002a. http://www.infoagro.com/hortalizas/tomate.htm (15 de febrero de 2007). [ Links ]
INFOAGRO. 2002b. http://www.infoagro.com/hortalizas/pimiento.htm (15 de febrero de 2007). [ Links ]
JANKIEWICZ, L. 2003. Reguladores del crecimiento, desarrollo y resistencia en plantas. Tomo I. Propiedades y acción. Ediciones Mundi Prensa. México. 487 pp. [ Links ]
JUNTTILA, O.; JENSEN, E.; ERNSTSEN, A. 1991. Effects of prohexadione (BX–112) and gibberellins on shoot growth in seedlings of Salix pentandra. Physiologia Plantarum 83(1): 17–21. [ Links ]
NAKAYAMA, I.; MIYAZAWA, T.; KOBAYASHI, M.; KAMIYA, Y.; ABE, H.; SAKURAI, A. 1990. Effects of a new plant growth regulator prohexadione calcium (BX–112) on shoot elongation caused by exogenously applied gibberellins in rice (Oriza sativa L) seedlings. Plant and Cell Physiology 31(2): 195–200. [ Links ]
NAKAYAMA, I.; KOBAYASHI, M.; KAMIYA, Y.; ABE, H.; SAKURAI, A. 1992. Effects of a plant–growth regulator, prohexadione–calcium (BX–112), on the endogenous levels of gibberellins in rice. Plant and Cell Physiology 33(1): 59–62. [ Links ]
OWENS, C. L.; STOVER, E. 1999. Vegetative growth and flowering of young apple trees in response to prohexadione–calcium. HortScience 34(7): 1194–1196. [ Links ]
RADEMACHER, W. 1993. On the mode of action of acylcohexadiones– a new type of plant growth retardant with possible relationships to daminozide. Acta Horticulturae 329: 31–34. [ Links ]
RADEMACHER, W. 2000. Growth retardants: Effects on gibberellin biosynthesis and other metabolic pathways. Annual Review of Plant Physiology and Plant Molecular Biology 51: 501–531. [ Links ]
RAMÍREZ, H.; HOAD, G. V.; BENAVIDES, A.; RANGEL, E. 2001. Gibberellins in apple seeds and the transport of (3H)–GA4. Revista de la sociedad Química de México 45(2): 47–50. [ Links ]
RAMÍREZ, H. 2003. El uso de hormonas en la producción de cultivos hortícolas para exportación. Memorias del 3er Simposio Nacional de Horticultura, Producción, Comercialización y Exportación de Cultivos Hortícolas. México. [ Links ]
RAMÍREZ, H.; PERALTA, R. M.; BENAVIDES, A.; SÁNCHEZ, A.; ROBLEDO, V.; HERNÁNDEZ, J. 2005. Efectos de prohexadiona – Ca en tomate y su relación con la variación de la concentración de giberelinas y citocininas. Revista Chapingo Serie Horticultura 11(2): 283–290. [ Links ]
RAMÍREZ, H.; ALONSO, S.; BENAVIDES, A. 2006. Prohexadione–ca modifies growth and endogenous hormones in the shoot apex in apple trees. Acta Horticulturae 727: 117–123. [ Links ]
ROJAS, M.; RAMÍREZ, H. 1987. Control hormonal del desarrollo de las plantas. Editorial Limusa. México. D.F. 239 pp. [ Links ]
SALISBURY, F. B.; ROSS, C. W. 1994. Fisiología vegetal. Grupo Editorial Iberoamérica. México, D. F. 759 pp. [ Links ]
SAS INSTITUTE. 2000. SAS / STAT, User's Guide. Release 8.1 ed. SAS Institute Inc., Cary, N. C. [ Links ]
SIAP, 2000. http://www.siap.sagarpa.gob.mx/InfOMer/analisis/antomate.html#export (15 de febrero de 2007). [ Links ]
SRIVASTAVA, L. M. 2001. Plant growth and development. Hormones and environment. Academic Press, U. S. A. 772 pp. [ Links ]
STEPHAN, M.; BANGERTH, F.; SCHNEIDER, G. 1998. Transport and metabolism of the gibberellins A1, A3 and A4 after application to developing apple fruits of Malus domestica cv. Jonagold. Acta Horticulturae 463: 113–119. [ Links ]
WEAVER, R. J. 1996. Reguladores del crecimiento de las plantas en la agricultura. Octava reimpresión. Editorial Trillas. México. 622 pp [ Links ]














