Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.14 no.2 Chapingo may./ago. 2008
Caracterización fisicoquímica y actividad antioxidante de extractos de jamaica (Hibiscus sabdariffa L.) nacional e importada
Physicochemical characterization and antioxidant activity of roselle extracts (Hibiscus sabdariffa L.) national and imported
L. A. Galicia–Flores1, Y. Salinas–Moreno2*, B. M. Espinoza–García2 y C. Sánchez–Feria2
1 Departamento de Ingeniería Agroindustrial, Universidad Autónoma Chapingo, Km. 38.5 Carretera México–Texcoco, Chapingo, Estado de México. C. P. 56230. México.
2 Laboratorio de maíz. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Km 38.5 Carretera México–Texcoco, Chapingo, Estado de México, C. P. 56230. México. Correo–e: yolysamx@yahoo.com (*Autor responsable)
Recibido: 18 de enero, 2007
Aceptado: 29 de noviembre, 2007
Resumen
En el presente estudio se analizaron muestras de jamaica importada (Sudán y China) y de México (Guerrero) para determinar el color de sus cálices las bebidas preparadas con sus extractos, además del pH, acidez, perfil de antocianinas y la actividad antioxidante, a fin de encontrar si existen diferencias que pudieran repercutir en su apreciación comercial. Las soluciones preparadas con los extractos de jamaica China y México presentaron una coloración rojo brillante, mientras la muestra de Sudán fue café–rojizo. La muestra de México mostró los porcentajes de acidez más altos y los valores más bajos de pH, en tanto que la jamaica China tuvo la mayor concentración de antocianinas. Los extractos de las tres jamaicas presentaron el mismo perfil de antocianinas, obtenido mediante HPLC. De acuerdo con los parámetros de calidad determinados, la jamaica de México y China tiene mejor calidad que la de Sudán. El extracto de jamaica de México fue el que presentó la mayor actividad antioxidante, lo que podría ayudar a darle un valor agregado a la jamaica (Hibiscus sabdaritfa L.) mexicana.
Palabras clave: parámetros de calidad, antocianinas, HPLC, DPPH.
Abstract
The aim of the present work was to determine the commercial quality of roselle samples of Hibiscus sabdariffa L. from Sudan and China, and from México (Guerrero State), measured as the color of the roselles and their extracts, the pH, the acidity, the antocyanin profile, and the antioxidant activity of the beverage prepared with them, in order to find out if there exists any differences among samples that could help to give a special place in the national market to the mexican Hibiscus sabdariffa L roselles. The beverages prepared with the roselles from China and México showed a deep–red color, while that from Sudan was brown–redness. The mexican roselles had the highest acidity and the lowest pH values, although China roselles presented the highest anthocyanin contents. The anthocyanin profiles obtained by HPLC of the roselles from the three countries were the same. According to the quality parameters evaluated, the roselles from México and China have better quality than that from Sudan. The roselle extracts from México had the highest antioxidant activity; this means that they possessed better nutraceutical properties than the extracts from China and Sudan, characteristic that could be useful to give an added value to the Mexican Hibiscus sabdariffa L. roselles.
Key words: quality parameters, anthocyanins, HPLC, DPPH.
INTRODUCCIÓN
Los cálices deshidratados de jamaica (Hibiscus sabdariffa L.) son apreciados comercialmente porque a partir de estos pueden obtenerse extractos concentrados de color rojo con aplicación en la industria alimenticia y farmacéutica. Las antocianinas son los compuestos responsables de esta coloración.
La jamaica pertenece a la familia de las malváceas. Su origen se ubica en los países tropicales de Asia, particularmente India y Malasia, de donde se dispersó hacia algunos países africanos con climas tropicales y subtropicales, así como a Centro y Sudamérica. En México fue introducida por los españoles durante la colonización (SAGARPA–ASERCA, 1999). Los principales países productores de jamaica son China, India y Sudán. México ocupa el séptimo lugar de esta lista, siendo el estado de Guerrero el mayor productor (INEGI, 2005).
A esta planta se le han dado diversos usos, su fibra se utiliza en la elaboración de cordones u otros productos similares sustituyendo al cáñamo o yute; sus hojas se usan en ensaladas (solas o en combinación con otras hortalizas), incluso se emplea como alimento forrajero para ganado o aves; los cálices deshidratados de jamaica se utilizan para la obtención de extractos concentrados cuyo uso más común es la elaboración de bebidas. A nivel industrial los extractos se usan en la elaboración de tintes y saborizantes de alimentos, cosméticos y productos farmacéuticos. Con la flor también se obtienen jaleas, mermeladas y harina para galletas (SAGARPA–ASERCA, 1999).
Los cálices de jamaica contienen diversos compuestos, entre los que se hallan alcaloides, ácido ascórbico, anisaldehído, antocianinas, β–caroteno, β–sitosterol, ácido cítrico, ácido málico, galactosa, mucopolisacáridos, pectina, ácido protocatecuico, polisacáridos, quercetina, ácido esteárico y cera (Hirunpanich et al., 2005; Duke et al., 2003; Li Thomas, 2002). A los extractos que se obtienen a partir de éstos se les han atribuido diversas propiedades medicinales como efectos diuréticos, coleréticos, reducción de la presión arterial, estimulación de la peristalsis intestinal, reducción de los niveles de colesterol; acción astringente, digestiva, emoliente y sedativa (Duke et al., 2003; Tsai et al., 2002). Por la actividad antioxidante de sus antocianinas, también pueden ayudar en la prevención y tratamiento de algunos tipos de cáncer (Chen et al., 2003).
Por su color rojo brillante y su sabor ligeramente ácido, la jamaica es un producto con gran potencial dentro de la industria alimenticia ya que cumple con las exigencias de los consumidores hacia alimentos que, además de buen sabor, aportan beneficios a la salud.
Aunque no existe una norma oficial que rija la calidad en los cálices de jamaica, los importadores exigen una serie de requerimientos para garantizar en lo posible la sanidad, inocuidad y calidad en los productos. Hasta hace algunos años la aceptación de la jamaica mexicana (Guerrero) era mayor en los mercados internacionales y en su comercio interno pero su competitividad ha declinado aceleradamente. Uno de los principales factores fue que en el 2003 los productores de Sudán y Senegal mejoraron la calidad de sus cálices y bajaron sus precios significativamente. En el mercado mexicano, dentro de los criterios de calidad de la jamaica se consideran la acidez del extracto y el número de extracciones que pueden realizarse a partir de los cálices. A pesar de que la jamaica producida en Guerrero tiene un alto contenido de ácidos, que resulta atractivo para usos medicinales, las características y condiciones que ha impuesto el mercado obligan a producir con calidad y bajos costos para ofrecer un producto competitivo (SAGARPA, 2004).
El objetivo de este estudio fue analizar algunas variables de calidad comercial en cálices de jamaica procedente de Sudán, China y México (Guerrero) y determinar la actividad antioxidante de sus extractos a fin de caracterizar las muestras y encontrar si existen diferencias que puedan respaldar una diferenciación de precios en el mercado.
MATERIALES Y MÉTODOS
Se obtuvieron tres muestras comerciales de cálices deshidratados de jamaica procedentes de China, México (Guerrero) y Sudán por medio del despacho de Comercio Internacional Nexos Global Solutions S.A. de C.V. Se determinó la humedad de las muestras de acuerdo al método 14.004 del AOAC (1984).
Obtención de extractos de antocianinas
Agua destilada. Se colocaron 10 g con base 12% de humedad de cada muestra en un vaso de precipitado de 500 mL y se le agregaron 100 mL de agua destilada. Los vasos se colocaron en una parrilla con un sistema de enfriamiento acoplado sobre la boca del vaso para evitar la pérdida de agua por evaporación y se dejaron ebullir por 15 y 60 min, considerando como t0 al tiempo en que la mezcla alcanzó la ebullición plena. Se realizaron tres extracciones sucesivas en cada caso.
Metanol acidificado. Las antocianinas se extrajeron a partir de 1 g de muestra molida a la que se añadieron 20 mL de metanol acidificado al 1% con ácido trifluoracético (TFA 99+%, Baker, México) y se mantuvo durante 24 horas bajo condiciones de refrigeración. Posteriormente se realizaron dos extracciones adicionales empleando como disolvente metanol: ácido acético: agua, (10:1:9 v/v), mantenidas bajo agitación y a temperatura ambiente durante 24 horas.
Determinación objetiva de color
Se midió a partir de una muestra de cálices molidos (para homogeneizar la muestra) que fue deshidratada durante 24 h a 60 °C. Adicionalmente, con el concentrado obtenido de la primera extracción en agua destilada a 15 min se prepararon diluciones 1:10 para apreciar las diferencias en el color que adquieren las bebidas preparadas con cada muestra. Las mediciones se hicieron por triplicado utilizando un colorímetro Hunter Lab MiniScan XE Plus (Modelo 45/O–L) en escala CIE L*a*b* con iluminante D/65 y un ángulo de 10°. Se obtuvieron los valores L* (luminosidad del color), a* y b* (coordenadas de cromaticidad), los valores L corresponden a la luminosidad de las muestras, el valor +a* significa que la muestra tiende al rojo; –a* al verde; +b* al amarillo y –b* al azul. A partir de estos datos se calcularon el ángulo de tono (Hue) y el índice de saturación de color (Croma), de acuerdo a lo descrito por Salinas et al. (2005).
pH y Acidez titulable
Estas determinaciones se realizaron en los extractos obtenidos con 15 y 60 minutos de ebullición de los cálices en agua destilada. El pH se midió con un potenciómetro Beckman (Modelo 45) y para la determinación de la acidez se siguió el método de la AOAC (1984) preparando las muestras según las indicaciones para soluciones ligeramente coloreadas. Se tituló con NaOH 0.1 N usando el pH de vire de la fenolftaleína (8.3–8.6) como punto final de la titulación. Las mediciones se realizaron por triplicado.
Antocianinas totales
La concentración de antocianinas se obtuvo midiendo la absorbancia de los extractos, utilizando un espectro–fotómeto PerkinElmer Lambda 25 UV/Vis de acuerdo a lo descrito por Salinas et al. (2003). Se elaboró una curva estándar con pelargonidina clorada (Sigma–Aldrich, México). Se realizó la cuantificación en las diferentes extracciones de cada muestra para finalmente considerar como antocianinas totales a la suma obtenida después de las tres extracciones. Los datos se expresan en mg·kg–1 de muestra seca.
Análisis de antocianinas por HPLC
El extracto de antocianinas que se obtuvo de la primera extracción empleando metanol acidificado con TFA, se purificó de acuerdo a lo descrito por Salinas et al. (2005). La muestra purificada fue filtrada con un Acrodisco PVDF 0.45 ì m (Millipore Corporation, M.A.) se depositó en viales ámbar para ser inyectada en el HPLC.
El equipo empleado fue un HPLC PerkinElmer Series 200, con una columna C18 Hypersil ODS (Thermo, Bellefonte, PA) de dimensiones 200x4.6 mm, con tamaño de partícula de 5 micras. El volumen inyectado de las muestras fue de 20 ì L. Los solventes empleados fueron ácido fórmico (98–100%, Merck): agua (1:9 v/v) como solvente A y ácido fórmico: agua: metanol (1:4:5 v/v) como solvente B. Todos los disolventes empleados fueron HPLC y antes de emplearse se filtraron a través de una bomba de vacío y membranas de nylon blanco de 0.45mm*47ì m (Millipore, Bedford, MA). Los gradientes y proporciones de solventes empleados fueron los reportados por Salinas et al. (2003). La detección de las antocianinas se hizo a 525 nm, manteniendo una temperatura en la columna de 25 °C.
Actividad antioxidante
El método para determinar la actividad antioxidante fue la estabilización del 2,2–difenil–1–picrilhidrazil (DPPH§) que se basa en la medición de la habilidad de compuestos antioxidantes para reducir el DPPH§ a partir del decremento en absorbancia de la reacción, en función del tiempo (Prior et al., 2005).
De los extractos de jamaica obtenidos de la primera extracción a 15 y 60 min de ebullición, se prepararon soluciones ajustadas a una concentración de 100 mg·mL–1 con agua destilada. También se preparó una solución de ácido gálico (Sigma–Aldrich, México) disuelto en metanol a una concentración de 100 mg/mL, para utilizarla como estándar de comparación. Para el seguimiento de la reacción se utilizó una solución 200 mM de DPPH (Sigma–Aldrich, México) disuelto en metanol al 80%. Las mediciones se llevaron a cabo en un espectrofotómeto PerkinElmer Lambda 25 UV/Vis. Para esto se colocaron 2,950 ì L de la solución de DPPH más 50 ì L de la solución a analizar, y se midió la absorbancia de la muestra cada 30 s durante 60 min a 515 nm, utilizando como blanco la solución de DPPH.
Siguiendo esta metodología se llevó a cabo otra serie de experimentos utilizando los mismos extractos (obtenidos a 15 y 60 min de ebullición) para preparar soluciones en proporción 1:1 (v/v) con agua destilada, a fin de identificar las diferencias que existen en la actividad antioxidante al emplear el mismo volumen de cada extracto de jamaica en las cinéticas de reacción con el DPPH. Con los datos obtenidos se calculó el porcentaje de DPPH reducido por las diferentes muestras, de acuerdo a lo descrito por Soler–Rivas et al. (2000).
RESULTADOS Y DISCUSIÓN
Aunque no existe una norma oficial que defina los parámetros de calidad con los que debe cumplir la jamaica, entre los importadores han fijado una serie de especificaciones para los cálices deshidratados y los extractos concentrados, con base en el cumplimiento de dichas especificaciones se fijan los precios en el mercado. Para flores deshidratadas los principales parámetros son la humedad (≤ 12%), el color (rojo–púrpura) y olor de las muestras, la presencia de insectos o fragmentos de insectos y la cantidad de terrones u otras partículas. En el caso de los extractos concentrados se verifica el color (rojo intenso con notas púrpura), la claridad de la solución, el aroma, el balance del sabor ácido–astringente, que este libre de sabores extraños o de notas de otras especies botánicas, además se requiere de pruebas microbiológicas que garanticen la inocuidad del producto (Anónimo, 1998).
Las tres muestras de cálices deshidratados de este estudio cumplen con los parámetros de olor y color característico, así como con lo relacionado a ausencia de fragmentos de insectos o materia extraña. En cuanto a humedad, la jamaica de Sudán presentó 10.2%, mientras la de China y Guerrero 12.2 y 16.9, respectivamente. Las muestras de jamaica importada se encuentran dentro del nivel de humedad aceptado para su comercialización, que debe ser menor al 12%. La jamaica nacional presenta valores de humedad elevados que podrían repercutir en la estabilidad del color de los cálices, ya que es afectado por la sorción de agua que incrementa las velocidades de reacción (Gradinaru et al., 2003). Estos resultados sugieren que se requiere implementar mejoras en el proceso de secado de la jamaica nacional para incrementar su calidad comercial y evitar así los riesgos de degradación de los cálices.
Color
De acuerdo a los resultados del Cuadro 1 las muestras se ubicaron en el cuadrante 1 (+a*,+b*) de la gráfica de color, que es el cuadrante que va del color rojo al amarillo. La muestra de China presentó la más alta luminosidad; el valor más alto en a* y el más bajo en b*, lo que significa que la muestra tiende al color rojo intenso. La jamaica de Guerrero se ubicó en valores similares a los de la China, pero la de Sudán presentó valores muy diferentes, con menor luminosidad y valores más bajos en a* y más altos en b*. El color de esta muestra tendió al guinda intenso, casi negro, mientras las otras dos fueron de color rojo–rosa.

La muestra de cálices molidos de Sudán presentó un mayor ángulo de tono y la menor pureza de color, esto es, aunque el color va del rojo al amarillo, no puede definirse como un color rojo puro ya que es muy oscuro. Las muestras de China y Guerrero fueron muy parecidas en sus atributos del color, ambas con un color rojo bien definido y con mayor pureza de color que la de Sudán.
En cuanto a las diluciones preparadas con los extractos de jamaica, el color de las muestras de China y Guerrero fue rojo–translúcido, mientras que el de Sudán rojo–oscuro, casi café. Las muestras de Guerrero y China mostraron valores de luminosidad diferentes a los de Sudán, que fueron más bajos y corresponden con el color oscuro de esta muestra (Cuadro 1). De acuerdo a los valores de Hue y Croma, el color rojo más brillante y puro lo presentó la jamaica procedente de China.
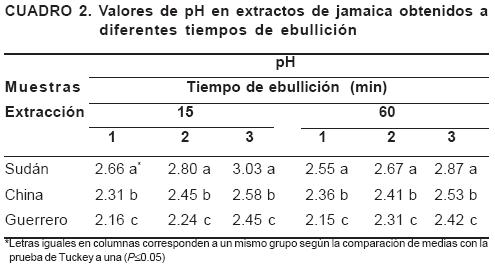
pH de los extractos a diferentes tiempos de ebullición
Se observó un incremento del pH conforme se aumentó el número de extracciones, siendo la muestra de Guerrero la que presentó el pH más bajo, a lo largo de las tres extracciones realizadas (Cuadro 2). El comportamiento del pH en los extractos obtenidos con 60 minutos de ebullición fue similar al observado con 15 minutos. Los extractos más ácidos los presentó la muestra de Guerrero mientras Sudán los menos ácidos.
Acidez
Las infusiones de la primera extracción presentaron los mayores valores de acidez, tanto a 15 como a 60 minutos de ebullición, siendo la muestra de China la que presentó el valor más alto, seguida de Guerrero y por último Sudán (Cuadro 3).

En la segunda y tercera extracción la acidez decreció abruptamente con respecto a la primera, este comportamiento fue más marcado en la muestra de Sudán que redujo su acidez en 75 y 93% para la segunda y tercera extracción, respectivamente; en el caso de las muestras de China y Guerrero la reducción fue del orden de 53% en la segunda y 85% en la tercera extracción.
En la Figura 1 se ilustra como se comporta la acidez y el contenido de antocianinas en la muestra de jamaica de Guerrero durante las extracciones sucesivas efectuadas con 60 minutos de cocimiento, en las demás muestras el comportamiento fue similar. La acidez de las extracciones está directamente relacionada con la cantidad de ácidos presentes en el medio, que en el caso de los cálices de jamaica se trata de ácido cítrico, ascórbico, málico, esteárico y ácido protocatecuico (Hirunpanich et al., 2005; Duke et al., 2003; Li Thomas, 2002).

Contenido de antocianinas
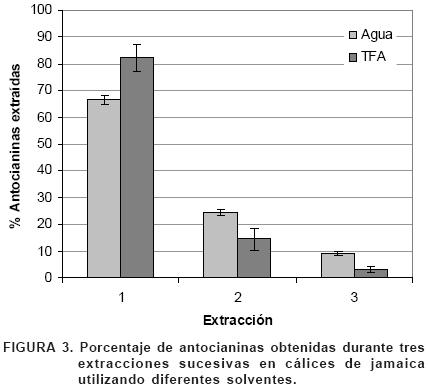
Entre las metodologías que se han probado para la extracción de antocianinas de diversas fuentes naturales (Salinas et al., 2003) se ha encontrado que al utilizar metanol acidificado con TFA al 1% como solvente de extracción, la cantidad de pigmentos extraídos aumenta considerablemente. Sin embargo, el TFA es tóxico, por lo que generalmente los pigmentos de jamaica se extraen utilizando agua como disolvente.
La eficiencia de la extracción con TFA se atribuye al bajo pH que se alcanza en el sistema (~1.3), a la mayor solubilidad de las antocianinas en metanol que en agua y a que bajo esta metodología, las muestras deben estar molidas, lo que aumenta la superficie de contacto de las partículas en el solvente.
En el estudio realizado por Marco et al. (2005) acerca de la degradación de las antocianinas de extractos de jamaica mediante un modelo PARAFAC (Parallel Factor Análisis), se pudo observar claramente la influencia del pH en el desplazamiento del equilibrio entre las especies cromóforas de las antocianinas (catión flavilium, base quinoidal, pseudobase carbinol y chalconas), ya que dependiendo de la acidez del medio las cantidades relativas de estas formas estructurales varían y por ende la longitud de onda de máxima absorción. Las antocianinas generalmente son aisladas en medios ácidos donde predomina la forma de catión flavilium, en este trabajo, al cambiar el pH de extracción de 3.0 (en el solvente 10:1:9) a 1.3 (en el metanol acidificado con TFA al 1%) el equilibrio se desplaza en mayor proporción hacia el catión flavilium, que absorbe a 520 nm, y eleva los valores de absorbancia de las muestras. Por lo tanto, al reportar antocianinas totales extraídas de cualquier fuente natural, es importante reportar el pH al que se hace el aislamiento y cuantificación de dichos pigmentos.
En la Figura 2 se pueden apreciar las diferencias en la concentración de antocianinas dependiendo del solvente con el que se extrajeron. Al emplear metanol los rangos de concentración estuvieron entre 3649.8 y 6066.7 mg·kg–1 de muestra seca y molida; mientras que en agua entre 1725.8 y 2969.9 mg·kg–1 muestra seca de cálices enteros.

Entre los factores que tienen influencia en la estabilidad de las antocianinas se encuentran el pH, temperatura, humedad, luz, oxígeno, enzimas, la presencia de ácidos, azúcares, co–pigmentos, entre otros. Gradinaru et al. (2003) reportan que la degradación térmica de las antocianinas de Hibiscus sabdariffa L. corresponde a una cinética de primer orden cuya energía de activación varía entre 13.3 y 15.1 Kcal·mol–1.
En este estudio se encontró que el tiempo de ebullición al que se sometieron los cálices de jamaica para obtener los extractos, presenta un efecto negativo en el contenido de antocianinas totales, esto fue más evidente en las muestras de China y Guerrero, donde se obtuvo una mayor concentración de antocianinas utilizando tiempos de ebullición de 15 min (Figura 2), de manera que al mantener las condiciones de temperatura elevada por un tiempo prolongado se tiene el riesgo de perder una mayor cantidad de antocianinas. Estos resultados tienen una aplicación práctica considerable, porque demuestran que no es necesario someter los cálices de jamaica a tiempos prolongados de ebullición para obtener extractos más concentrados, sino por el contrario, esta práctica demerita su calidad. Además, el disminuir los tiempos de ebullición puede representar ahorros significativos en el gasto de combustibles.
Los extractos de la jamaica Sudán presentaron un comportamiento diferente al mostrado por los de China y Guerrero, ya que la mayor concentración de pigmentos se obtuvo con 60 min de ebullición. Este comportamiento de los extractos de la jamaica Sudán ante las condiciones de tiempo y temperatura hacen suponer que en dicha muestra los compuestos responsables del color no son sólo antocianinas. Tal suposición se soporta con los resultados de las extracciones sucesivas, ya que al extraer antocianinas, usualmente el color de la muestra va reduciéndose porque el pigmento se va agotando, pero con la muestra de Sudán el color permaneció sin mayores cambios entre la primera y tercera extracción, lo que indica que hay otros compuestos diferentes a antocianinas que contribuyen al color, y que no pueden ser extraídos con los disolventes usados. Por el color café de los cálices, es posible que se trate de taninos.
Del total de antocianinas presentes en las tres muestras de jamaica analizadas, entre la primera y segunda extracción se obtiene aproximadamente el 90% del pigmento (Figura 3).
Análisis de antocianinas por HPLC
El perfil de antocianinas obtenido mediante HPLC se presenta en la Figura 4 y fue similar para las tres muestras de jamaica analizadas. Las antocianinas más importantes en los cálices de jamaica son delfinidina–3–sambubiósido (1) y cianidina–3–sambubiósido (4) (Gradinaru et a.l, 2003; Hou et al., 2005). Estos resultados revelan que las antocianinas dominantes en las muestras de Hibiscus sabdariffa L. son las mismas, independientemente del país donde se produce la planta.
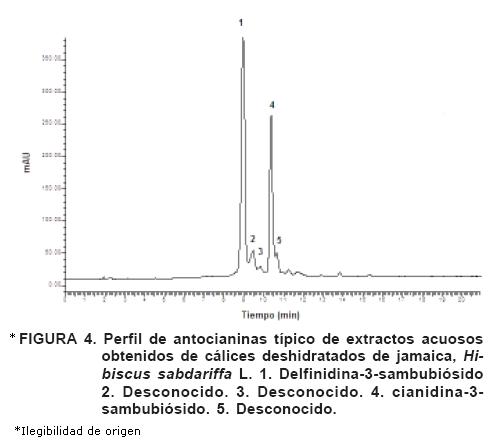
El tiempo de ebullición al que son sometidos los cálices de jamaica afecta la proporción de antocianinas extraídas. En la muestra de jamaica China, al incrementarse de 15 a 60 min, aumentó el porcentaje relativo de delfinidina–3–sambubiósido y disminuyó el de cianidina–3–sambubiósido (Cuadro 4), lo que podría indicar que la primera es más termosensible que la segunda. Este patrón no se presentó en las muestras de Sudán y Guerrero, donde las proporciones de las dos antocianinas no tuvieron cambios importantes.

Actividad antioxidante
El efecto antioxidante de los extractos de jamaica ha sido investigado de acuerdo a varios modelos experimentales (Hirunpanich et al., 2005; Farombi y Fakoya, 2005); en este estudio se empleó la reacción de reducción del radical libre DPPH que es la metodología más utilizada para la determinación de este tipo de actividad (Prior et al., 2005) debido a la facilidad con que puede llevarse a cabo, ya que como equipo importante sólo se requiere de un espectrofotómetro UV–Vis.
En la primera serie de experimentos se prepararon diluciones con los extractos de jamaica a fin de ajustar la concentración de antocianinas en todas las muestras a 100 mg/mL, los resultados se muestran en la Figura 5. En los extractos obtenidos a 15 min de ebullición la muestra de Guerrero presentó la mayor actividad antioxidante llegando a reducir un 92% del DPPH, seguida de Sudán y China con un 78 y 61% respectivamente. Las tres muestras presentaron una actividad antioxidante mucho mayor a la de la solución de ácido gálico empleada como estándar de comparación. Con los extractos obtenidos a 60 min de ebullición no se observó el mismo comportamiento de las muestras y en este caso la jamaica Sudán fue la que redujo una mayor cantidad de DPPH (96%) seguida de Guerrero con 93% y China con 77%.

La diferencia observada entre la Figura 5a y 5b, donde la actividad antioxidante presentada por la jamaica Sudán cambia radicalmente, podría deberse a la cantidad de extracto puro que fue agregado a la solución al hacer el ajuste de concentraciones, ya que Sudán fue la muestra que presentó una menor cantidad de antocianinas (Figura 2) y por lo tanto se requería de un mayor volumen de extracto puro para llegar a la misma concentración.
Tsai et al., (2002) afirman que son varios los constituyentes con actividad antioxidante en los cálices de jamaica, Hibiscus sabdariffa L., entre ellos se incluye a las antocianinas, quercetina, ácido ascórbico y protocatecuico, por lo que esta propiedad no es exclusiva de las antocianinas. Lo anterior apoya el supuesto de que el volumen agregado a la solución estaba influenciando los resultados de los análisis, ya que también se modificaba la concentración de los demás componentes del extracto.
Para corroborar lo anterior, se preparó otra serie de experimentos en los que se mantuvo constante el volumen del extracto añadido a la solución de DPPH que fue sometida al análisis de actividad antioxidante. Los resultados de esta segunda serie de experimentos se muestran en la Figura 6.
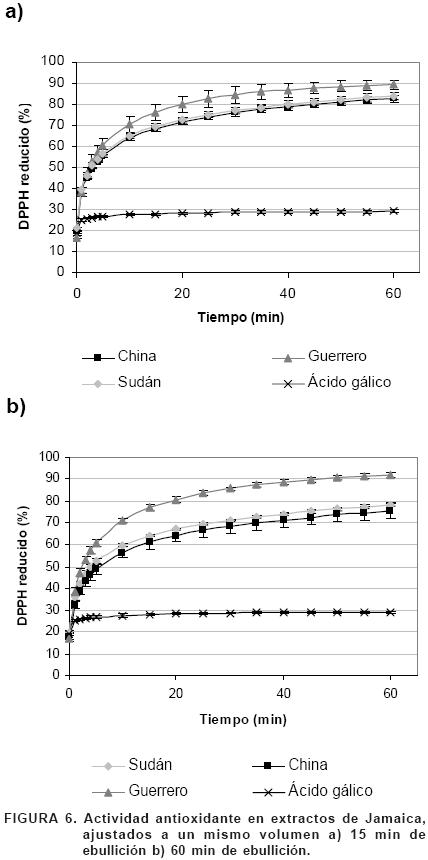
Puede observarse que la actividad antioxidante de los extractos fue en el orden Guerrero>Sudán>China>Ácido gálico (Figura 6). Esto demostró que el volumen estaba influyendo en los resultados del primer experimento y que la muestra Guerrero es la de mayor capacidad antioxidante.
Esta muestra también presentó los valores de pH más bajos y la mayor acidez (Cuadros 2 y 3 respectivamente) lo que puede indicar que tiene un contenido de ácidos más elevado que el resto de las muestras estudiadas y son éstos, además de las antocianinas, los que incrementan la actividad antioxidante de sus extractos. Tsai et al. (2002) reportan que del total de la actividad antioxidante que presentan los extractos de jamaica, el 51% es debido a las antocianinas presentes y un 24% a los demás compuestos fenólicos que se encuentran en la solución, mencionan además que la cantidad de ácidos fenólicos presentes en los extractos es de 23 mg·kg–1 de materia seca.
CONCLUSIONES
Las tres muestras de jamaica analizadas cumplen con las características físicas de olor, color y ausencia de materia extraña que pide el mercado, sin embargo considerando las variables de acidez, pH y contenido de antocianinas, la jamaica de China y México poseen mejor calidad que la de Sudán. El contenido de humedad de la jamaica Sudán y China estuvo por debajo del 12%, nivel máximo aceptado para su comercialización, mientras que la de México tuvo niveles de humedad más elevados. La mayor actividad antioxidante observada en los extractos de la jamaica de México puede significar una diferencia importante, ya que además de obtener extractos o bebidas con buena apariencia y sabor, aportaría un mayor beneficio a la salud de las personas que lo consumen.
LITERATURA CITADA
ANÓNIMO. 1998. Market survy: Hibiscus sabdariffa. Agribusiness in sustainable natural African plant products. A–SNAPP. [ Links ]
ASSOCIATION OF OFFICIAL ANALYTICAL CHEMIST INC. (AOAC). 1984. Oficcial Methods of Analysis. 12a Ed. St. Paul Minnesota, USA. [ Links ]
CHEN, C.–C.; HSU, J.–D.; WANG, S.–F.; CHIANG, H.–C.; YANG, M.–Y.; KAO, E.–S.; HO, Y.–C.; WANG, C.–J. 2003. Hibiscus sabdariffa Extract inhibits the development of atherosclerosis in cholesterol–fed rabbits. Journal of Agriculture and Food Chemistry. 51, 5472–5477. [ Links ]
DUKE, J. A.; JO BOGENSCHUTZ–GODWIN, M.; DUCELLIER, J.; K. DUKE, P.A. 2003. Handbook of medicinal spices. CRC Press LLC. New York, USA. 348 p. [ Links ]
FAROMBI, E.O.; FAKOYA, A. 2005. Free radical scavenging and antigenotoxic activities of natural phenolic compounds in dried flowers of Hibiscus sabdariffa L. Mol. Nutr. Food Res. 2005 Dec; 49(12): 1120–8. [ Links ]
GRADINARU, G.; BILIADERIS, C.G.; KALLITHARAKA, S.; KEFALAS, P.; GARCÍA–VIGUERA, C. 2003. Thermal stability of Hibiscus sabdariffa L. anthocyanins in solution and in solid state: effects of copigmentation and glass transition. Food Chemistry 83, 423–436. [ Links ]
HIRUNPANICH V.; UTAIPAT A.; MORALES N. P.; BUNYAPRAPHATSAEA N.; SATO H., HERUNSALEE A.; SUTHINSISANG C. 2005. Antioxidant effect of aqueous extracts from dried calyx of Hibiscus sabdariffa Linn. (Roselle) in vitro using rat low–density lipoprotein (LDL). Biological and Pharmaceutical Bulletin. 28(3), 481–484. [ Links ]
HOU, D.–X.; TONG, X.; TERAHARA, N.; LUO, D.; FUJII, M. 2005. Delphinidin 3–sambubioside, a Hibiscus anthocyanin, induces apoptosis in human leukemia cells through reactive oxygen species–mediated mitochondrial pathway. Archives of Biochemistry and Biophysics. 440, 101–109. [ Links ]
INSTITUTO NACIONAL DE GEOGRAFÍA E INFORMÁTICA (INEGI). 2005. Anuario estadístico del estado de Guerrero. México. [ Links ]
LI THOMAS, S. C. 2002. Chinese and related north American herbs. Phytopharmacology and therapeutic values. CRS Press. New York, USA. 598 p. [ Links ]
MARCO, P. H.; B. LEVI, M. A.; SCARMINIO, I. S.; POPPI, R J.; TREVISAN, M. G. 2005. Exploratory analysis of simultaneous degradation of anthocyanins in the calyces of flowers of the Hibiscus sabdariffa species by PARAFAC model. Analitycal sciences, 21, 1523–1527. [ Links ]
PRIOR, R. L.; WU, X.; SCHAICH, K. 2005. Standarized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agriculture and Food Chemistry. 53, 4290–4302. [ Links ]
SAGARPA. 2004. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Fortalecimiento de cadenas productivas: diagnóstico y estrategias, sistema producto jamaica en el estado de Guerrero. [ Links ]
SAGARPA–ASERCA. 1999. México, proveedor de plantas medicinales al mundo. Claridades Agropecuarias, 73, 13–21. [ Links ]
SALINAS–MORENO, Y.; MARTINEZ–BUSTOS, F.; SOTO–HERNÁNDEZ, M.; ORTEGA–PACZKA, R.; ARELLANO–VÁZQUEZ, J. L. 2003. Efecto de la nixtamalización sobre las antocianinas del grano de maíces pigmentados. Agrociencia 37, 617–628. [ Links ]
SALINAS–MORENO, Y.; SALAS–SÁNCHEZ, G.; RUBIO–HERNÁNDEZ, D.; RAMOS–LOBATO, N. 2005. Characterization of anthocyanin extracts from maize kernels. Journal of Chromatographic Science. 43, 1–6. [ Links ]
SOLER–RIVAS, C.; ESPÍN, J. C.; WICHERS, H. J. 2000. An easy and fast test to compare total free radical scavenger capacity of foodstuffs. Phytochemistry Anal. 11:330–338. [ Links ]
TSAI, P.–J.; MCINTOSH, J.; PEARCE, P.; CAMDEN, B.; JORDAN, B. R. 2002. Anthocyanin and antioxidant capacity in Roselle (Hibiscus sabdariffa L.) extract. Food Research International. 35, 351356. [ Links ]















