Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.3 Ciudad de México jul./sep. 2004
Revisión
Aplicación de la biocatálisis a la preparación de intermediarios para la síntesis de fármacos
Héctor Luna
Departamento Sistemas Biológicos, Universidad Autónoma Metropolitana, Unidad Xochimilco. Calzada del Hueso 1100, Col. Villa Quietud, México, D.F. CP 04960. Tel (55) 5483-7255, Fax: (55) 5483-7237. E-mail: lchm1964@correo.xoc.uam.mx
Recibido el 5 de julio del 2004.
Aceptado el 28 de agosto del 2004.
Resumen
La utilidad de las biotransformaciones para la preparación de compuestos orgánicos está bien establecida; debido no solo a las características de regio-, quimio- y enantioselectividad que las reacciones enzimáticas presentan, sino también por la bondad de las condiciones de reacción bajo las que se llevan a cabo. Actualmente la aplicación de la biocatálisis ha atravesado la frontera académica encontrando un campo fértil de acción en la industria farmoquímica, especialmente para la manufactura de compuestos enantiopuros. En este artículo se describen algunos problemas sintéticos resueltos a través del uso de biotransformaciones en la preparación de intermediarios para la síntesis de fármacos.
Palabras clave: Biocatálisis, fármacos, biotransformaciones, intermediarios.
Abstract
The utility of biotransformations for organic compounds preparation is well established; due not only to their regio-, chemo-and enantioselective characteristics, but also to the softness of the reaction conditions under which they are carried out. Nowadays biocatalysis has crossed the academic boundary, founding a special field of action in the pharmochemical industry, particularly in the manufacture of enantiopure compounds. Among the used enzymes are oxidoreductases, lyases, and specially lipases; they are used as isolated or immobilized enzymes as alive microorganisms. In this article some examples of how synthetic problems were solved through the use of biotransformations in the preparation of drugs intermediates are described.
Key words: Biocatalysis, drugs, biotransformations, intermediates.
Introducción
La quiralidad es un factor determinante en la eficacia de muchos fármacos, agroquímicos y aditivos para alimentos, ya que de ello depende su actividad biológica, por ello la producción de un solo enantiómero de estos compuestos quirales es muy importante en la industria agroquímica, de alimentos y especialmente farmacéutica [1].
Los compuestos enantiopuros pueden producirse por métodos químicos o químico-enzimáticos, siendo los procedimientos catalíticos de ambas metodologías los preferidos. Las ventajas que los procedimientos biocatalíticos tienen sobre los químicos se basan en que las reacciones catalizadas por enzimas son frecuentemente más regio-, quimio- y estereoselectivas. Aquí sería pertinente definir que las biotransformaciones involucradas en los procesos biocatalíticos, son conversiones de sustratos no naturales catalizadas por enzimas, ya sean aisladas o presentes en los microorganismos que las contienen.
Aunque la principal aplicación de las biotransformaciones en síntesis orgánica está en la preparación de compuestos enantiopuros, estas también se usan para efectuar transformaciones de grupos funcionales aquirales; ya que las biotransformaciones se llevan a cabo generalmente a temperatura ambiente y presión atmosférica, evitándose con ello el uso de condiciones de reacción extremas, las cuales pudieran causar isomerizaciones, racemizaciones, epimerizaciones o transposiciones. Las biotransformaciones también encuentran aplicación en la preparación de algunos compuestos en los que la transformación química es, hasta ahora, imposible. Adicionalmente, cuando el biocatalizador, microorganismos o enzimas aisladas, están inmovilizados se pueden reciclar varias veces sin pérdida significativa de sus propiedades catalíticas.
Las enzimas para la biocatálisis pueden usarse de varias maneras, pueden ser del tipo salvaje, recombinadas, o genéticamente modificadas para incrementar su actividad o especificidad. Una o más enzimas que llevan a cabo los pasos sintéticos requeridos pueden estar presentes en las células completas de un microorganismo y actuar simultáneamente sin interferencias. El microorganismo involucrado puede estar en pleno crecimiento, en fase estacionaria o inmovilizado. Alternativamente, las enzimas libres pueden estar en solución, en un reactor de membrana, como suspensión, "cross-linked" o inmovilizadas. El medio de reacción puede ser acuoso, orgánico o en dos fases [2-9].
Por otro lado, con los avances en la ingeniería genética, las enzimas pueden sobreexpresarse haciendo los procesos biocatalíticos más económicos y eficientes; además los avances en la modificación estructural de las enzimas permite la creación de nuevas moléculas protéicas con actividades catalíticas hechas a la medida de las necesidades, por ejemplo la preparación de enzimas termoestables o estables a cierto pH, por medio de la mutagénesis aleatoria o dirigida.
Numerosos artículos de revisión han sido publicados sobre el uso de enzimas en síntesis orgánica [10-24], en este artículo se describen algunos ejemplos de la aplicación de la biocatálisis en la preparación de intermediarios importantes en la síntesis de fármacos. Cabe aclarar que en ningún momento se pretende que esta revisión sea exhaustiva, solo se muestran algunos ejemplos interesantes de la aplicación de las biotransformaciones, especialmente en la preparación industrial de fármacos.
Aplicaciones
El Omapatrilat (1), es un fármaco antihipertensivo que actúa como inhibidor de la enzima convertidora de la angiotensina [25]. Para su síntesis se siguió una estrategia convergente para la cual se requirieron dos intermediarios (2 y 5), los cuales se prepararon por rutas biocatalíticas independientes; después de su condensación, seguida de una reacción de ciclización se produjo el compuesto 10, el cual ya contiene la estructura bicíclica básica de 1.
El primer intermediario es la (S)-6-hidroxinorleucina, 2, para la cual se han reportado las rutas biocatalíticas mostradas en el Esquema 1. En la Ruta A se efectuó una aminación reductiva usando la glutamato deshidrogenasa de hígado bovino [26], a escala preparativa y con una concentración de substrato de 100 g/L, se tuvo un rendimiento del 92% y un exceso enantiomérico (ee) mayor al 99%. El procedimiento anterior presentó el inconveniente de que el ácido 2-oxo-6-hidroxihexanoico, 3, requiere de varios pasos para su preparación. Por lo anterior, se desarrolló la Ruta B (Esquema 1); en esta alternativa el tratamiento de la 6-hidroxinorleucina racémica, rac-2, con una D-aminoácido oxidasa de riñón porcino y catalasa de hígado de bovino o con células de T. variabilis (conteniendo ambas enzimas) produjo una mezcla de (S)-2, con un >99% ee, y el cetoácido 3; dicha mezcla de reacción se sometió a la aminación reductiva de la Ruta A, llegando a obtenerse un 97% de rendimiento de (S)-2 con un 98% ee, a partir de la norleucina racémica.
El segundo intermediario, el ácido (S)-2-amino-5-(1,3-dioxolan-2-il)-pentanoico, 5, para cuya preparación se requieren 8 pasos químicos, fue preparado a través de la aminación reductiva mostrada en el Esquema 2, utilizando para el proceso células de Escherechia coli, secadas con calor y clonadas con la fenilalanindeshidrogenasa (PDH) de Thermoactinomyces intermedius y células igualmente secadas de Candida boidinii [27]. El proceso optimizado produjo 197 Kg de 5, en tres lotes de 1600 L, a una concentración de sustrato del 5%, con un rendimiento promedio de 91% y un ee del 98%.
Con la misma finalidad se generó un biocatalizador por medio del desarrollo de una cepa recombinante de Pichia pastoris conteniendo la fenilalanindeshidrogenasa (PDH) de T. intermedius y una formatodeshidrogenasa (FDH) endógena, ambas inducibles con metanol. El proceso resultó con la producción de 15.5 Kg de 5 con 97% de rendimiento y un ee >98%, en un lote de solo 180 L, usando una concentración de 10% del substrato 4 (Esquema 2). El cetal cíclico 5 fue posteriormente transformado al dimetilacetal 6, el cual posteriormente se utilizó para la preparación del ácido [4S-(4a,7a,10ab)]-1-octahidro-5-oxo-4-{[(fenilmetoxi)carbonil]amino}-7H-piridino-[2,1-b][1,3]-tiazepin-7-carboxílico, 10, como se muestra en el Esquema 3.
En otra ruta alternativa para preparar al compuesto bicíclico 10, se utilizó la fácilmente disponible L-lisina, para generar al intermediario 11 (Esquema 4), equivalente sintético de 8; cuya ciclización promovida por la L-lisina ε-aminotransferasa (LAT) de Sphingonomas paucimobilis SC16113 sobrexpresada en E. coli [28], seguida de la reacción insitu con tributilfosfina produjo el intermediario 11a, la posterior ciclización con ácido trifluoroacético (TCA) produjo 10, con un rendimiento del 70% M.
En un estudio para la preparación de compuestos antagonistas del tromboxano A2 (TxA2), el cual es un vasoconstrictor con actividad antiagregatoria de plaquetas, se encontró que la lactona 14 y el lactol 15 son intermediarios versátiles para la preparación de una serie de derivados que condujeron al ácido {1S-[1α,2α(Z),3α,4α]}-7-{3-[(2-heptanoilaminoacetilamino)metil]-7-oxabiciclo[2,2,1]hepta-2-il}-hepta-5-enoico, 12, como un nuevo agente cardiovascular, útil para el tratamiento de enfermedades trombóticas (Esquema 5) [29].
Una de las estrategias utilizadas para la preparación del lactol 15 y lactona 14, fue la oxidación biocatalítica del diol meso, (exo,exo)-7-oxabiciclo[2,2,1]heptan-2,3-dimetanol, 13. Aunque esta bioxidación ya había sido reportada anteriormente [30], un estudio más profundo encontró que una suspensión (10% P/V, de células húmedas) de Nocardia globerula ATCC21505 produjo un 70% de rendimiento molar de la lactona 14 con 96% ee, a una concentración del sustrato del 5 g/L [31]. Por otro lado, una suspensión de células de Rhodococcus sp. ATCC15592, a la misma concentración de sustrato produjo un rendimiento global de 46% M de una mezcla del lactol 15, y la lactona 14, con 96.7 y 98.4% ee respectivamente.
En una segunda aproximación, partiendo del mismo diol meso 13, se empleó una reacción de asimetrización enzimática de su diéster 16. Para ello se preparó el diacetato 16, el cual sometido a hidrólisis con la lipasa inmovilizada PS-30 produjo el monoacetato de configuración S en un rendimiento del 75% M y >99% ee, en sistema de reacción bifásico y a una concentración de substrato de 5g/L. La enzima inmovilizada se reutilizó por cinco ciclos sin pérdida de eficiencia ni esteroselectividad. El monoacetato fue entonces convertido al lactol 15 vía hidrólisis y oxidación químicas [32].
Desde la introducción en la terapéutica para la hipertensión del Diltiazem, 18, este ha presentado el inconveniente de su corta duración de efecto por ello se han buscado modificaciones estructurales que promuevan una mayor duración del efecto. En esa dirección se ha encontrado que el (cis)-3-(acetoxi)-1-[2-(dimetilamino)etil]-1,3,4,5-tetrahidro-4-(4-metoxifenil)-6-trifluorometil)-2H-1-benzazepin-2-ona, 19, presenta un efecto más prolongado y que además es más potente.
El intermediario clave en la síntesis de 19 fue la (3R-cis)-1,3,4,5-tetrahidro-3-hidroxi-4-(4-metoxifenil)-6-(trifluorometil)-2H-1-benzazepin-2-ona, 20; la cual fue preparada vía una reducción microbiana estereoselectiva del compuesto 21, el cual se encuentra como una mezcla de enantiómeros a través de un tautomerismo cetoenol. En dicho equilibrio la forma cetónica, racémica (21a y 21c), es la preferida (Esquema 6). Una evaluación de microorganismos condujo a encontrar que Nocardia salmonicolor SC6310 es capaz de biocatalizar la trasformación selectiva de 21c a 20 en 96% de rendimiento y 99.8% ee, a una concentración de 2 g/L de sustrato [33].
El grupo funcional feniletanolamino está presente en muchos compuestos con actividad biológica, entre ellos esta el (R)-Sotalol, 24, un β-bloqueador. Se ha determinado que el enantiómero R es 50 veces más activo que el enantiómero S [34] y por ello se ha propuesto a la clorhidrina 23 como un precursor adecuado para la preparación enantioselectiva del (R)-Sotalol (Esquema 7). Después de probar una serie de microorganismos se encontró que Hansenula polymorpha ATCC26012 cataliza la reducción enantioselectiva del carbo-nilo en el 4-[(2-cloroacetil)-fenil]-metansulfonato, 22, produciendo el intermediario deseado, (R)-23, en un 95% de rendimiento y con >99% ee [35].
En otro ejemplo de reducción enantioselectiva de un grupo carbonilo, el 4-cloro acetoacetato de metilo, 25, es biotransformado al ácido (S)-4-cloro-3-hidroxibutanóico, 26, por una suspensión de células de Geotrichum candidum SC5469 [36], en 95% de rendimiento y 96% ee (Esquema 8). El hidroxiéster quiral ha sido utilizado para sintetizar al compuesto 27, el cual es un inhibidor de la hidroximetilglutaril-CoA reductasa.
El aislamiento, purificación e inmovilización de la oxido-reductasa de G. candidum involucrada condujo al mejoramiento de la biotransformación, llegandose a obtener (S)-26 en un rendimiento del 90% y un exceso enantiomérico de 98% ee.
Las epóxido-hidrolasas catalizan la hidrólisis enantioselectiva de epóxidos racémicos a los correspondientes diol y epóxido remanente, quirales. Se ha reportado que el (S)-1-(2',3'-dihidrobenzo[b]furan-4'-il)-1,2-oxirano, 29, es un intermediario importante para la preparación de numerosos prospectos de fármacos. Aunque se han encontrado varios microorganismos capaces de efectuar la transformación deseada (Esquema 9), existe un problema de estereoselectividad debido a que la hidrólisis espontánea del epóxido en el medio de reacción puede ocurrir, aunque ésta puede ser reducida al efectuar la reacción a pH >8. Por ello fue necesario encontrar microorganismos capaces de catalizar la hidrólisis del epóxido racémico más rápido que lo que ocurre la reacción química. Después de una amplia búsqueda de microorganismos se encontró que dos cepas de Aspergillus níger (SC16310 y SC16311) y Rhodotorula glutinis SC16293 hidrolizan selectivamente el epóxido 28, de configuración R dejando al epóxido, (S)-29, en un 45% de rendimiento (del 50% teórico) y >95% ee (Esquema 9). La enantioselectividad se incremento al 99.9% al adicionar al medio de la reacción éter t-butilmetílico [37].
Para la síntesis del ácido 5-metilpirazin-2-carboxílico (MPCA), 34, el cual es un intermediario para la producción de Acipimox, 31, un antilipolítico y de Glipicida, 32, un agente antidiabético, se sometió la 2,5-dimetilpirazina, 33, a oxidación con Pseudomona putida crecida en xileno (Esquema 10). El producto, MPCA, se precipita por simple acidificación del medio de reacción libre de células; el proceso soporta hasta 2 g/L de sustrato, con un rendimiento del 95%; la producción de MPCA, 34, está en la escala de 15 m3 [38].
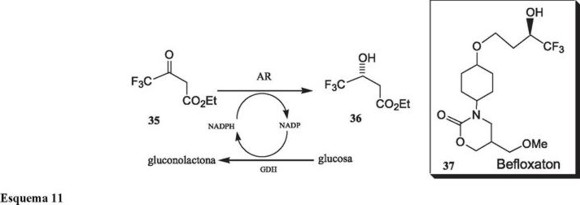
Para la síntesis de Befloxaton, 37, un antidepresor, se utiliza al (R)-4,4,4-trifluoro-3-hidroxibutanoato de etilo, 35 [39], el cual se prepara por una reducción enantioselectiva utilizando células de E. coli que contiene dos plásmidos. Uno de ellos lleva el gen de una aldehído-reductasa de la levadura Sporobolomices salmonicolor, la cual reduce el carbonilo de 35; y el segundo lleva el gen de una glucosa deshidrogenasa de Bacillus megaterium para la regeneración del NADPH necesario para la reducción [40]. La productividad del procedimiento llega hasta los 300 g/L con valores de hasta 92% ee.
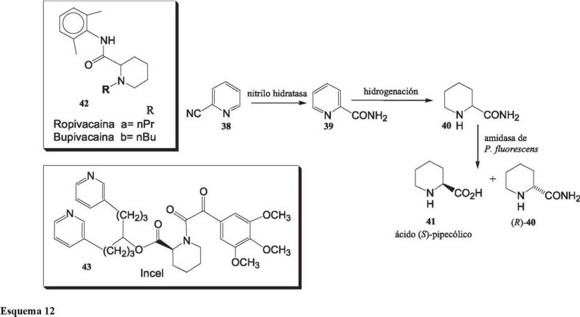
El ácido (S)-pipecólico, 41, es intermediario en la síntesis de varios fármacos, entre ellos el Incel, usado para el tratamiento del cáncer y los anestésicos locales Ropivacaina, 42a y Levobupivacaina. 42b. Lonza combina eficientemente la química y la biotenología para producirlo con ee mayores a 99% [41]. En el primer paso biocatalítico, células de un microorganismo, que contiene una nitrilohidrolasa, efectúan la hidrólisis de la 2-cianopiridina, 38, produciendo la piridin-2-carboxamida, 39, la cual por reducción química produce la amida racémica 40. En el segundo paso biocatalítico, células de Pseudomonas fluorescens DSM9924 efectúan la hidrólisis enantioselectiva del grupo amido de 40, produciendo el ácido (S)-Pipecólico, 41, y la amida (R)-40.
Siguiendo una estrategia similar, se ha preparado la (S)-2,2-dimetilciclopropancarboxamida, 44, la cual es un intermediario para la síntesis de Cilastatina, 46, un inhibidor de la dehidropeptidasa renal. Aunque se desarrollaron paralelamente procesos químicos y biotecnológicos, el bioproceso demostró ser superior ya que presentó menos operaciones unitarias y una mejor calidad en el producto. Nuevamente el primer paso consistió en una hidrólisis no estereoespecífica de un grupo nitrilo, utilizando una nitrilohidrolasa para producir cuantitativamente la ciclopropancarboxamida rácemica, rac-44. Posteriormente una búsqueda de microorganismos condujo al aislamiento de la cepa Comomonas acidovorans A:18 [42], la cual fue particularmente efectiva para llevar a cabo la resolución de la mencionada amida. El proceso fue mejorado a través de la clonación del gen de la amidasa en E. coli. Esta amidasa hidroliza específicamente al enantiómero R, produciendo la amida S en un 35% de rendimiento y un ee >98%. El reciclado del ácido (R)-45, involucrando una racemización, conduce a aumentar la eficiencia del proceso, y a reducir desechos.
Un ejemplo impactante de lo que pueden hacer los procesos biocatalíticos es la producción de L-carnitina o vitamina Bt, 51, utilizando células de un microorganismo, el cual utiliza una ruta natural que involucra cuatro enzimas en el proceso (Esquema 14) [43].
En este proceso la 4-butirobetaina, 47, es transformada a L-carnitina, 51, la cual es excretada por las células al medio, facilitando su aislamiento. En este proceso se utilizó un microorganismo nuevo, relacionado a los géneros Agrobacterium y Rhizobium, en su fase de crecimiento estacionaria [43]. Como se observa en el Esquema 14, las cuatro enzimas tienen una función particular, es de mencionar la introducción de la quiralidad por la liasa, crotonobetainil-CoA hidrolasa. Bajo este procedimiento se produce L-carnitina a una escala de 50 m3, con un rendimiento volumétrico de 80 g/L, con una conversión analítica del 99.5 % y un ee del 100%.
Referencias
1. Food & Drug Administration: FDA's statement for the development of new stereoisomeric drugs. Chirality 1992, 4, 338-340. [ Links ]
2. Patel, R. N. Enz. Microb. Tech. 2002, 31, 804-826. [ Links ]
3. Rozzell, J. D. Bioorg. Med. Chem. 1999, 7, 2253-2261. [ Links ]
4. Bornscheuer, U. en: Biotechnology, Kelly, D. R:, Ed., Wiley-VCH, Weinheim, 2000, 278-294. [ Links ]
5. Straathof, A. J. J.; Panke, S.; Schmid, A. Curr. Opin. Biotech. 2002, 13, 548-556. [ Links ]
6. Faber, K. Biotransformations in Organic Chemistry, Springer, Berlin, 1997. [ Links ]
7. Wong, C.-H.; Whitesides, G. M. Enzymes in Synthetic Organic Chemistry, Pergamon, Oxford, 1994. [ Links ]
8. Roberts, S. M.; Casy, G.; Nielsen, M.-B.; Phythian, S.; Todd, C.; Wiggins, K. Biocatalysts for Fine Chemicals Synthesis, Wiley, New York, 1999. [ Links ]
9. Roberts, S. M. J. Chem. Soc. Perkin Trans. 2001, 1475-1499. [ Links ]
10. Buckland, B. C.; Robinson, D. K.; Chartrain, M. Metabolic Engineering, 2000, 2, 42-48. [ Links ]
11. Crout, D. H. G.; Davies, S.; Heath, R. J.; Miles, C. O.; Rathbone, D. R.; Swoboda, B. E. P. Biocatalysis 1994, 9, 1-30. [ Links ]
12. O'Brien, M.; Vanasse, B. Curr. Opin. Drug Discov. Dev. 2000, 3, 793-806. [ Links ]
13. Pesti, J. A.; Dicosimo, R. Curr. Opin. Drug Discov. Dev. 2000, 3, 764-782. [ Links ]
14. Mahmoudian, M. Biocat. Biotrans. 2000, 18, 105-116. [ Links ]
15. Sheldon, R. A. J. Chem. Technol. Biotechnol. 1996, 67, 1-14. [ Links ]
16. Gotor, V. Biocat. Biotrans. 2000, 18, 87-103. [ Links ]
17. Santaniello, S.; Ferraboschi, P.; Grisenti, P.; Manzocchi, A. Chem. Rev. 1992, 92, 1071-1140. [ Links ]
18. Stewart J. D. Biotechnol. Gen. Eng. Rev. 1997, 14, 67-143. [ Links ]
19. Zak, A. Curr. Opin. Chem. Biol. 2001, 5, 130-136. [ Links ]
20. Patel, R. N. Adv. App. Microbiol. 1997, 43, 91-140. [ Links ]
21. Patel, R. N. Ann. Rev. Microbiol. 1998, 98, 361-395. [ Links ]
22. Patel, R. N., en: Stereoselective Biocatalysis, Patel, R. N., Ed., Marcel Dekker, New York, 1999; pp.87-130. [ Links ]
23. Mori, K. Synlett 1995, 1097-1109. [ Links ]
24. Wong, C. H.; Whitesides, G. M. Enzymes in Synthetic Organic Chemistry, Elsevier Science, 1994, New York. [ Links ]
25. Robl, J. A.; Sun, C.; Stevenson, J.; Ryono, D. E.; Simpkins, L. M.; Cimarusti, M. P.; Dejneka, T.; Slusarchyk,W. A.; Chao, S.; Stratton, L.; Misra, R. N.; Bednarz, M. S.; Asaad, M. M.; Cheung, H. S.; Aboa-Offei, B. E., Smith, P. J.; Mathers, P. D.; Fox, M.; Schaeffer, T. R.; Seymour, A. A.; Trippodo, N. C. J. Med. Chem. 1997, 40, 1570-1577. [ Links ]
26. Hanson, R.; Schwiden, M. D.; Banerjee, A.; Brzozowski, D.; Chen, B.-C.; Patel, B. P.; McNamee, C.; Kodersha, G.; Kronenthal, D.; Patel, R. N.; Szarka, J. Bioorg. Med. Chem. 1999, 7, 2247-2252. [ Links ]
27. Hanson, R.; Howell, J.; LaPorte, T.; Donovan, M.; Cazzulino, D.; Zannella, V.; Montana, M.; Naduri, V.; Schwarz, S.; Eiring, R.; Durand, S., Wasylyk, J.; Parker, L.; Liu, M.; Okuniewicz, F.; Chen, B.-C.; Harris, J.; Natalie, K.; Ramig, K.; Swaminathan, S.; Rosso, V.; Pack, S.; Lotz, B.; Bernot, P., Rusowicz, A.; Lust, D.; Tse, K.; Venit, J.; Szarka, L.; Patel, R. N. Enzyme Microb. Technol. 2000, 26, 348-358. [ Links ]
28. Patel, R. N.; Banerjee, A.; Nanduri, V.; Goldberg, S.; Johnston, R.; Hanson, R.; McNamee, C.; Brzozowski, D.; Tully, T.; Ko, R.; LaPorte, T.; Cazzulino, D.; Swaminathan, S.; Parker, L.; Venit, J. Enzyme Microb. Technol. 2000, 27, 376-389. [ Links ]
29. (a) Das, J.; Haslanger, M. J.; Gougoutas, J. S.; Malley, M. F. Synthesis 1987, 1100-1112. [ Links ] (b) Hamanaka, N.; Seko, T.; Miyazaki, T.; Kawasaki, A. Adv. Prostaglandin, Thromboxane and Leukotriene Res. 1990, 21, 359-362. [ Links ]
30. Luna, H.; Prasad, K.; Repic, O. Tet.:Asymmetry 1994, 5, 303-306. [ Links ]
31. Patel, R. N.; Lui, M.; Banerjee, A.; Thottathil, J. K.; Kloss, J.; Szarka, L. J. Enzyme Microb. Technol. 1992, 14, 778-784. [ Links ]
32. Patel, R. N.; Lui, M.; Banerjee, A.; Szarka, L. J. Appl. Microbiol. Biotechnol. 1992, 37, 180-183. [ Links ]
33. Patel, R. N.; Robison, R. S.; Szarka, L. J.; Kloss, J.; Thottathil, J. K.; Mueller, R. H. Enzyme Microb. Technol. 1991, 13, 906-912. [ Links ]
34. Somani, P.; Bachand, T. Eur: J. Pharmacol. 1969, 7, 239-247. [ Links ]
35. Patel, R. N.; Banerjee, A.; McNamee, C. G.; Szarka, L. J. Appl. Microbiol. Biotechnol. 1993, 40, 241-245. [ Links ]
36. Patel, R. N.; McNamee, C. G.; Banerjee, A.; Howell, J. M.; Robison, R. S.; Szarka, L. J. Enzyme Microb. Technol. 1992, 14, 731-738. [ Links ]
37. Goswami, A.; Totleben, M. J.; Singh, A.; Patel, R. N. Tetrahedron Asymmetry 1999, 10, 3167-3175. [ Links ]
38. Kiener, A. Angew. Chem. Int. Ed. Engl. 1992, 31, 774-775. [ Links ]
39. Rovei, V.; Caille, D.; Curet, O.; Ego, D.; Jarreau, F.-X. J. Neural. Transm. 1994, 41, 339-347. [ Links ]
40. Kataoka, M.; Rohani, L. P. S., Wada, M.; Kita, K.; Yanase, H.; Urabe, I.; Shimizu, S. Biosci. Biotechnol. Biochem. 1998, 62, 167-169. [ Links ]
41. a) Petersen, M.; Sauter, M. Chimia 1999, 53, 608-612. [ Links ] b) Eichhorn, E.; Roduit, J. P.; Shaw, N.; Heinzmann, K.; Kiener, A. Tet.: Asymmetry 1997, 8, 2533-2536. [ Links ]
42. Zimmermann, T.; Robins, K.; Birch, O. M.; Boehlen, E. EP 0 524 604 B1. [ Links ]
43. Kulla, H. G. Chimia 1991, 45, 81-85. [ Links ]