Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.3 Ciudad de México jul./sep. 2004
Investigación
Sensor óptico para mediciones de PH obtenido por el método sol-gel con moléculas orgánicas dopadas en matriz vítrea
Carlos Córdoba*, Jenny Mera, Omar Paredes y Javier Benavides
Grupo de Investigación en Materiales Cerámicos y Vítreos, Universidad de Nariño, Colombia. Laboratorio de materiales, Torobajo, ciudad universitaria. Teléfono 7312289 ext 254 San Juan de Pasto A. A 1175. E-mail: ceramicos@udenar.edu.co
Recibido el 22 de marzo del 2004.
Aceptado el 27 de agosto del 2004.
Resumen
Se preparó un sensor de respuesta óptica para medir acidez ambiental, a partir de la mezcla de cuatro moléculas orgánicas, p-dimetilaminoazobenceno (amarillo de dimetilo), (ácido o-[[p-(dimetilamino)fenil]azo]benzoico) (rojo de metilo), α,α Bis (6 bromo 5 hidroxicarvacril) a hidroxi -o- tolueno g sulfona (azul de bromotimol), y ácido α-hidroxi- α,α-bis (5 hidroxicarvacril)-p-toluensulfonico (azul de timol), incorporadas a una matriz vítrea, obtenida vía sol-gel utilizando como precursores tetraetóxido de silicio (TEOS) y metiltrietóxido de silicio (ME3S); el intervalo de pH varía entre 1 y 10. La caracterización óptica de las películas depositadas en pequeñas láminas de vidrio de silicato sódico potásico, se llevó a cabo por espectrometría de absorción con un equipo Perkin Elmer 11. Los ensayos de fotoestabilidad se realizaron mediante exposiciones con una lámpara ultravioleta de 10 w. La adherencia y la resistencia química se llevaron a cabo sometiendo las películas a diferentes ambientes acuosos y alcalinos (NaOH 0.5M, Na2CO3 0,1M). El sensor obtenido es sensible a las variaciones de pH, tanto en líquidos como en gases húmedos, además es reversible y estable a los cambios químicos.
Palabras clave: Sensor óptico, método sol- gel, absorción.
Abstract
A sensor for optical response to measure the environmental acidity was prepared with four- organic molecules mixture: p-dimethylaminazobenzene (dimethyl yellow), (o-[[p-(dimethylamin)phenyl]azo]benzoic) acid (methyl red), α,α Bis (6 bromo 5 hydroxycarvacryl) a hidroxi -o- toluene g sulphone (bromothymol blue), and α-hidroxi-α , α-bis (5 hydroxycarvacryl)-p-toluensulphonic acid (timol blue), which were incorporated to the vitreous network through a sol-gel process using tetraethylortosilicate (TEOS) and methyltrietoxide of silicon (ME3S) as precursors; the pH ranged from 1 to 10. The films were deposited over a small pieces of soda lime glass, and the optical characterization of films was carried out by absorption spectrometry using a Perkin Elmer Lambda 11. The Photostability surveys of the samples were performed with an ultraviolet lamp of 10W at different exposure times, after that they were immersed in different acid, aqueous and alkaline environments (NaOH 0.5M, Na2CO3 0,1M) to probe adherence and chemical resistance properties. The Sensor obtained is sensitive to pH variations both in liquids as in moist gases, in addition, it is a reversible and stable sensor to chemical changes.
Key words: Optical sensor, sol-gel method, absorption
Introducción
Las investigaciones realizadas usando matrices porosas obtenidas por el método sol-gel, para atrapar moléculas orgánicas o inorgánicas, fueron inicialmente propuestas por Tobacco y colaboradores[1]. Los materiales preparados y densificados vía sol-gel, a partir de alcóxidos o alquilalcóxidos, ofrecen la posibilidad de obtener interesantes materiales con diversas propiedades como las biológicas al atrapar en matriz de vidrio biomoléculas[2], ó atrapar complejos de metales de transición[3,4], metales nobles[5], etc. La incorporación de moléculas orgánicas, en particular pigmentos ha sido investigado por Hobacker[6]. Sin embargo, Villegas[6-11] ha realizado investigaciones sobre sensores de pH aplicables a mediciones de acidez ambiental, particularmente sensores para protección de vidrieras históricas, y sus trabajos nos sirvieron de base para proponer un sensor que cubra un amplio intervalo de pH, mediante la incorporación de moléculas orgánicas, por mezclas de indicadores, en matriz de vidrio, preparado por sol-gel. La utilidad de los sensores propuestos se basa en primer lugar, en que permiten conocer cuál es la acidez ambiental mediante un cambio de color cuando varía la acidez. El sensor permite medir la acidez en forma cualitativa en un amplio intervalo de pH; permiten evaluar cualitativamente el grado de acidez ambiental mediante comparación del color que adquiere respecto a una escala de color preestablecida, y cuantitativamente el pH se mide por el registro de los espectros de absorción visible del sensor, una vez empiezan a modificar el color de origen, cuando se exponen a atmósferas ácidas, son sensores de respuesta óptica.
La matriz obtenida por el método sol-gel, es una matriz porosa de vidrio (SiO2), a la que se le incorpora una o varias moléculas orgánicas. La química que gobierna el cambio de color de las moléculas orgánicas, es explicada por la teoría de los indicadores y la teoría cromófora. De igual manera uno de los requerimientos para que actúen los sensores en exteriores, es su fotoestabilidad a la radiación solar. Esto supone estabilidad a las radiaciones ultravioleta, que es la radiación más energética del espectro solar, y por lo tanto, la que mayor daño puede causar en el indicador cromático.
Los indicadores de neutralización cambian de color por la introducción de iones H+ o OH- en sus soluciones. Sin embargo la introducción de estos iones obviamente altera el pH de la solución. Se puede afirmar, entonces, que el color de un indicador depende de su pH y en consecuencia los indicadores pueden ser descritos como indicadores de pH.
Según Alexeyev[12], la relación entre el color de un indicador de pH particular y el pH de la solución puede ser establecido con la ayuda de la teoría cromófora de indicadores. Según esta teoría el siguiente sistema de equilibrio, existe en una solución de un indicador ácido:
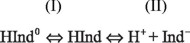
En este equilibrio HInd0 representa una forma tautomérica y HInd la otra y Ind- es el anión formado. Para un indicador básico, será equivalente (IndOH0 ⇔ IndOH ⇔ Ind+ + OH-)
Materiales y métodos
Los sensores ópticos de pH son películas delgadas entre 270-310 nm (±10 nm)[11] obtenidas por el método sol-gel sobre pequeñas láminas de vidrio común de silicato sódico cálcico. Esa capa se obtiene a partir de una suspensión coloidal (sol) que se prepara con la mezcla de dos precursores: tetraetóxido de silicio (TEOS) y metiltrietóxido de silicio (ME3S) en relación molar 1:1, que son responsables de aportar una matriz amorfa de óxido de silicio y un dopante orgánico, (en este caso mezcla de cuatro dopantes orgánicos) capaces de cambiar el color cuando se produce un cambio de pH. La tabla 1 muestra los dopantes orgánicos preparados con sus porcentajes, para un total en peso de 1.5%. Para la preparación del sol, se utilizó la relación molar TEOS /ME3S/:H2O:C2H5OH/ 1:4:8 al que se agrega un catalizador, HCl concentrado, que facilita la hidrólisis de los alcóxidos y la homogeneidad del sol. Una vez preparado el sol, la pieza de vidrio a recubrir se sumerge en él, y se extrae a velocidades que varían entre 0.5 y 13.5 cm/min por una sol vez, para obtener espesores alrededor de los 300 nm en al superficie del vidrio al que queda adherida, medidos según el método reportado por Córdoba y colaboradores[14]. Posteriormente, el sistema compuesto por el vidrio común y la capa, se somete a un secado a temperatura ambiente y se forma lo que se denomina un gel. Luego se densifica el gel por cinco días a 25 ºC, para garantizar la estabilidad de la película.

La caracterización óptica de los recubrimientos se llevó a cabo por espectrometría de absorción con un equipo Perkin Elmer Lambda 11.
Los ensayos de fotoestabilidad se realizaron mediante exposiciones con una lámpara ultravioleta (UV) de 10 w. La adherencia y la resistencia química se realizaron sometiendo las películas en un medio neutro-ácido (agua desionizada) y alcalino (NaOH 0.5M, Na2CO3 0,1M) y también a diferentes temperaturas. La exposición a un medio gaseoso se realizó colocando la película en un ambiente cerrado (desecador) expuesta a un ambiente de una solución de HCl 3.6M, para que por evaporación hace que produzcan gases ácidos.
Discusión de resultados
Las películas obtenidas toman un color permanente anaranjado, y se sumergen en soluciones tamponadas de diferentes pH, con valores de pH =1, 2, 4, 6, 8, y 10 a temperatura ambiente por 5 min. Se extrae la película, se seca con papel suave y se coloca en el espectrofotómetro UV-VIS para la lectura de la absorbancia, para cada pH. La figura 1 muestra los espectros de absorción óptica del sensor para los valores de pH ya mencionados. Se puede comprobar cómo la banda característica de pH = 1 a 552 nm, disminuye su absorbancia a 532 nm con pH = 2 y luego un corrimiento de la banda hasta 480.3 nm con pH 4. A partir del pH 6, nuevamente la absorbancia empieza a aumentar con un corrimiento a 453.5 nm para pH = 6, un desplazamiento de 447.1 nm a pH = 8 y 439 nm a pH = 10. Este desplazamiento del máximo de absorción indica un cambio de la zona ácida a básica y además un cambio de color complementario, que en este caso varía de púrpura a pH = 1, pasando por anaranjado a pH = 4, amarillo a pH = 6, verde amarillo menos intenso a pH = 8 hasta verde amarillento intenso a pH =10. Las intensidades de las bandas predominantes son para valores de pH ácidos.
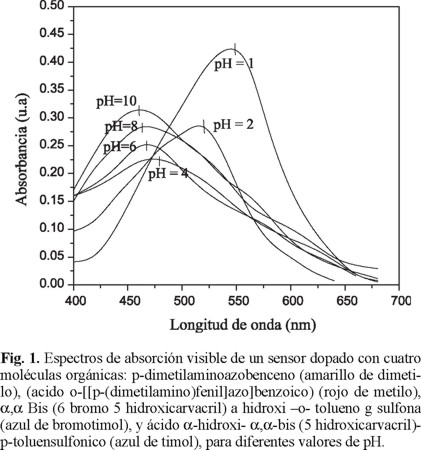
Se registra una banda alrededor de 480 nm, presente en todos los espectros. Esta banda es debida según lo indican varios autores[6-11], a las moléculas de dopantes orgánicos, localizadas en las zonas del poro de la matriz vítrea muy profundas, dónde el reactivo de la solución tamponada de los diferentes pH, no alcanza a sensibilizar por no estar en contacto.
La evolución del cambio de color se puede observar en la figura 2, en la cual se representan los máximos de absorción y las longitudes de onda (λ), para los diferentes valores de pH.

Este gráfico nos muestra que en las zonas de mayor pendiente, en la curva de las absorciones, el sensor presenta la mayor sensibilidad, es decir a valores de pH entre 1 y 3 así como en la curva de longitudes de onda, que corresponde según Villegas[7], al intervalo en que las moléculas dopantes se encuentran inmovilizadas en el recubrimiento. Se puede concluir que este sensor es mucho más sensible para los ácidos que para las bases. Una de las características del sensor, es ser reversible, es decir puede cambiar de color al variar su pH de ácido a básico y a continuación de básico a ácido.
La figura 3 indica la recuperación del color al someter el sensor a 15 ciclos ácido - básico, para cada extremo de pH, en este caso pH = 2 y pH = 10. La reversibilidad se produce sin fatiga, es decir sus longitudes de onda permanecen constantes y no se modifica la superficie de la película. La inmersión se realizó por períodos de tiempo de cinco min. Cuando la película del sensor es sometida a prueba en fase vapor, tal como una atmósfera húmeda con gases de HCl 3.6 M, su color cambia a púrpura (absorción visible a 534 nm) mas sensible en atmósfera húmeda que en medio líquido. Si la película deja de ser expuesta a la atmósfera húmeda, el sensor regresa espontáneamente a su color inicial, anaranjado (absorción visible a 480.6 nm) y las absorciones disminuyen. Así el sensor muestra un color púrpura a pH = 2 y un color verde - amarillo a pH = 10. La figura 4 registra la disminución paulatina del máximo de absorción, así como la longitud de onda, cuando se expone a los vapores y la recuperación espontánea en función del tiempo, en una hora. Se observa que los valores de absorción y longitud de onda después de la exposición se aproximan a la línea discontinua, que representan los valores antes del cambio de color del indicador.


Otra manera de probar la estabilidad del sensor, es sometiéndolo a la acción térmica desde 25 ºC hasta 220 ºC en un horno mufla durante cinco horas y medir sus absorciones en diferentes tiempos. La gráfica 5 muestra el comportamiento de las absorciones respecto a las temperaturas y se puede observar que el máximo de absorción visible disminuye, hecho atribuible a la pérdida paulatina de agua absorbida y al inicio de la descomposición o combustión de aquellas moléculas dopantes que se encuentran en la matriz vítrea, hasta la pérdida total de los cromóforos orgánicos. A si mismo la figura 5, indica que en condiciones habituales, del medio ambiente, el sensor no se vería seriamente alterado en su uso, porque a temperaturas inferiores a 100ºC, la disminución del máximo de absorción es relativamente pequeño, pero a temperaturas superiores a 100ºC los problemas de estabilidad térmica se vuelven significativos.

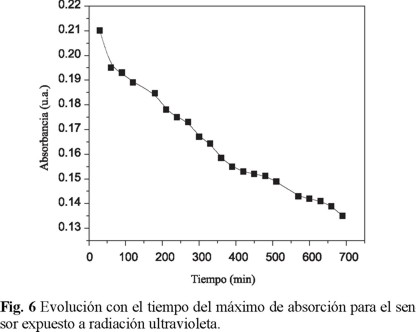
La estabilidad a la radiación solar, se mide exponiendo el sensor a una luz ultravioleta de 10 w, que es la de mayor energía en el espectro solar. Expuesto el sensor a una lámpara UV por 10 horas, se tomaron sus absorciones cada media hora y la gráfica 6 indica la evolución del máximo de absorción, mostrando un comportamiento bastante estable durante esas 10 h de iluminación permanente, tras la cual la intensidad se reduce en un 50 %. Finalmente, el sensor fue sumergido en un lavado hidrolítico en H2O, NaOH 0.5M, y Na2CO3 0.1 M, en proporción 70:30.
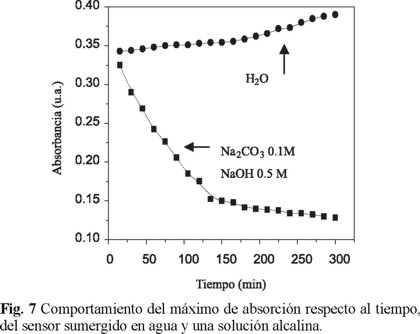
Los resultados se observan en la figura 7, que muestra la evolución con el tiempo de la intensidad del máximo de absorción, con agua el sensor prácticamente no se ve alterado, pero en las soluciones alcalinas la absorciones disminuyen drásticamente con el tiempo. Lo anterior demuestra que el sensor es resistente al ataque hidrolítico, y es apto para ser usado como sensor ambiental.
Conclusiones
Se preparó un sensor óptico de pH por el método sol-gel, con intervalo de medida de pH 1 a 10, de pequeño tamaño, reversible y estable a cambios térmicos inferiores a 100ºC, y a la radiación UV. Para efectos prácticos los cambios de absorción óptica, se traducen en un cambio de color, visualmente perceptible y espectrofotométricamente medible. Son sensibles a las variaciones de pH, tanto en medios líquidos como gaseosos y resisten al ataque hidrolítico y alcalino a temperatura ambiente. Su uso es sencillo y la utilidad práctica es para la protección de piezas de museos, vidrieras y control de ambiente gaseosos húmedos.
Agradecimientos
Los autores agradecen al Sistema de Investigaciones de la Universidad de Nariño, Colombia, por la financiación de esta investigación aprobada por acuerdo No 139 de julio 28 del 2003.
Referencias
1. Tobacco, M. B.; Zhou, Q.; Nelson, B. In Ceramic Transactions. Vol 28. Solid State Optical Materials, ed. A. J. Bruce and B. V. Hiremath. The American Ceramic Society, Westerville, Ohio, 1992, pp. 657-672. [ Links ]
2. Bronshteim, A.; Aharonson, N.; Avnir, D.; Turniansky, A.; Altstein, M. Chem. Mater, 1997, 9, 2632-2639. [ Links ]
3. García, M. A.; Paje, S. E.; Villegas, M. A.; Llopis, J. Appl. Phys., 2002, A 74, 83-88. [ Links ]
4. Villegas, M. A.; García M. A.; Llopis, J.; Fernández Navarro, J. M. J. Sol-Gel Sci. Technol., 1998, 11, 251-265. [ Links ]
5. Hofacker, S.; Schottner, G. J. Sol-Gel Sci. Technol., 1998, 13, 479-484. [ Links ]
6. Dulebohn, J. I.; Haefner, S. C.; Berglund, K. A.; Dunbar, K. R. Chem. Mater., 1992, 4, 506-508. [ Links ]
7. Matsui, K.; Momose, F. Chem. Mater., 1997, 9, 2588-2591. [ Links ]
8. Villegas, M. A.; Pascual, L. Thin solid films, 1999, 351 103-108. [ Links ]
9. Villegas, M. A.; Pascual, L. J. Mat. Science, 2000, 35, 4615-4619. [ Links ]
10. Villegas, M. A.; Pascual, L.; Paje, S. E.; García, M.A.; Llopis, J. J. Eur. Ceramic Soc., 2000, 20, 1621-1628. [ Links ]
11. Villegas, M. A.; García, M. A.; Paje, S. E.; Llopis, J. J. Of the European Ceramic Society, 2002, 22, 1475-1482. [ Links ]
12. Alexeyev, V. Quantitative Analysis. MIR publisher, Moscow. 1986, p. 234-243. [ Links ]
13. Villard, H. H., Furman, N. H., Bricker, C. E. Análisis químico cuantitativo. Ed. Marin 1980, p.190. [ Links ]
14. Córdoba C.; Paredes, O.; Benavides, J.; Ortega A.; Arturo, P. Rev. Soc. Quím. Mex. 2002, 46, Número especial, 306. [ Links ]














