Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.3 Ciudad de México jul./sep. 2004
Investigación
Estudio de los complejos de inclusión de ácido nalidíxico y ácido oxolínico con ciclodextrinas
Elisa Leyva*, Edgar Moctezuma, Roberto Leyva y Socorro Oros
Facultad de Ciencias Químicas, Universidad Autónoma de San Luis Potosí. Av. Manuel Nava No. 6, Zona Universitaria, San Luis Potosí, S.L.P., CP 78210, México. E-mail: elisa@uaslp.mx
Recibido el 7 de junio del 2004.
Aceptado el 20 de julio del 2004.
Resumen
Los ácidos nalidíxico y oxolínico son compuestos farmacéuticos que pertenecen a la familia de las quinolonas y que se usan para combatir enfermedades bacterianas en las vías urinarias, en la piel y en el tracto respiratorio. Ambos ácidos son prácticamente insolubles en agua por lo que se excretan demasiado rápido, debido a esto es de interés modificar sus propiedades químicas al insertar estos fármacos dentro de la cavidad de las ciclodextrinas. En este trabajo se estudió la formación de los complejos de asociación de estos fármacos con β- y γ-ciclodextrina por medio de espectroscopia de fluorescencia para evaluar las constantes de equilibrio, las cuales sirven para determinar si es factible encapsular estos ácidos en las ciclodextrinas y mejorar así sus propiedades farmacológicas. Los resultados experimentales indican que ambas ciclodextrinas forman complejos de inclusión con estos ácidos. Sin embargo, tanto el ácido nalidíxico como el ácido oxolínico forman un complejo más fuerte con β-ciclodextrina.
Palabras clave: Ácido nalidíxico, ácido oxolínico, quinolonas, ciclo-dextrinas, complejo de inclusión.
Abstract
Nalidixic and oxolinic acids are pharmaceutical compounds that belong to the quinolone family. They are used in the treatment of skin, urinary tract and respiratory tract infections. Since they have very low water solubility, they are rapidly excreted. Physicochemical properties of both quinolones may be modified by insertion of the organic molecule in the cavity of a cyclodextrin. In this work, the formation of complexes of these acids with β- and γ-cyclodextrins was studied by fluorescence spectroscopy to evaluate the equilibrium constants in order to determine if it is possible to encapsulate oxolinic and nalidixic acids in cyclodextrins and improve their pharmacological properties. The experimental results showed that both cyclodextrins form inclusion complex with these acids. However, nalidixic and oxolinic acids form stronger complexes with β-cyclodextrin.
Key words: Nalidixic acid, oxolinic acid, quinolones, cyclodextrins, inclusion complex.
Introducción
Uno de los avances dentro de la industria química ha sido el empleo de ciclodextrinas como agentes encapsulantes, para transportar todo tipo de ingredientes activos como fármacos [1], cosméticos, saborizantes, vitaminas [2]; así también como desechos industriales [3] y compuestos tóxicos [4-6] entre otras muchas aplicaciones, ya que las ciclodextrinas pueden formar mezclas o complejos de gran estabilidad química con mayor solubilidad en el agua. Las ciclodextrinas sirven también para liberar en forma controlada ingredientes activos de medicamentos. El principal propósito del sistema de liberación controlada de fármacos es dosificar la cantidad de fármaco necesaria en el lugar específico durante un periodo de tiempo controlado de forma precisa y efectiva. Para diseñar medicamentos de alto rendimiento, se utilizan portadores compatibles con los fármacos para enmascarar las propiedades no deseables del fármaco, por lo que se ha buscado desarrollar varios tipos de biomateriales de alto rendimiento que se puedan mezclar con los fármacos y liberarlos en forma controlada [7]. Las ciclodextrinas son candidatos potenciales para este rol debido a su habilidad de alterar las propiedades físicas, químicas y biológicas de la molécula huésped a través de la formación del complejo de inclusión. Los factores principales que están involucrados en la formación del complejo son las fuerzas de Van der Waals, interacciones hidrofóbicas, enlaces de hidrógeno y efectos estéricos. La constante de asociación es el resultado de todas estas interacciones [8-12].
Las ciclodextrinas (Figura 1) son oligómeros cíclicos que contienen varias unidades de glucosa unidas por medio de enlaces α(1→4) conformando un anillo [13,14]. Las ciclodextrinas se forman por la acción de ciertas enzimas sobre la molécula del almidón. Las moléculas de ciclodextrina tienen un extremo que contiene grupos hidroxilo primarios, en el otro extremo grupos hidroxilos secundarios y en el interior de la cavidad los grupos CH y oxígenos glicosídicos. El extremo con los grupos hidroxilo primarios tiene un diámetro reducido comparado al extremo en donde se encuentran los grupos hidroxilo secundarios. Estos extremos de la ciclodextrina que contienen los grupos hidroxilo son bastante polares, mientras que su interior es relativamente no polar. Las ciclodextrinas más comunes son: α-ciclodextrina, que contiene seis unidades de glucosa, β-ciclodextrina con siete unidades de glucosa y γ-ciclodextrina que contiene 8 unidades de glucosa.
Las quinolonas son antibióticos sintéticos que actúan inhibiendo la DNA girasa y la topoisomerasa IV en bacterias susceptibles [15]. Las quinolonas originales tienen una modesta actividad contra enterobacterias y algunas otras bacterias facultativas gram negativas [16]. Las quinolonas fluoradas, llamadas también fluoroquinolonas, fueron desarrolladas a partir de las quinolonas clásicas y aumentaron sustancialmente el espectro de actividad [17,18]. Anualmente, se producen una gran cantidad de agentes antibacteriales entre los que se encuentran las quinolonas que se usan en el tratamiento de infecciones en humanos y animales. Desde el desarrollo de las primeras quinolonas y su producción a mediados de 1960, han sido aprobadas y usadas intensivamente para el tratamiento de una gran variedad de infecciones clínicas, incluyendo enfermedades genitales, gastrointestinales y del tracto respiratorio, así también como para infecciones de huesos, articulaciones y de la piel.
Las fórmulas químicas de las dos quinolonas más importantes, ácido nalidíxico y ácido oxolínico se encuentran en la Figura 2.

Las principales aplicaciones terapéuticas de quinolonas y fluoroquinolonas son: infecciones de vías urinarias, prostatitis, enfermedades venéreas, infecciones de tubo digestivo y abdomen, infecciones de vías respiratorias, infecciones de huesos, articulaciones y tejidos blandos. El ácido nalidíxico y el ácido oxolínico son compuestos prácticamente insolubles en agua, por lo cual se excretan demasiado rápido, propiedad que incide en forma negativa en el uso del fármaco, por lo que es de interés modificar sus propiedades fisicoquímicas al incluir estos fármacos dentro de la cavidad de las ciclodextrinas.
Existen algunos reportes sobre los complejos de ácido nalidíxico con ciclodextrinas [19-22]. Sin embargo, estos reportes han presentado resultados contradictorios. En el caso de α-ciclodextrina, se ha reportado que aumenta la solubilidad del ácido nalidíxico debido a la formación de un complejo. En dos reportes diferentes [20, 21], se concluye que no se forma un complejo de ácido nalidíxico con β-ciclodextrina porque la molécula de este ácido es muy grande para acomodarse en la cavidad de la ciclodextrina o debido a impedimento estérico. Por otra parte, se reportaron dos constantes de asociación diferentes para la formación del complejo de ácido nalidíxico con γ-ciclodextrina. [20,22]. Las diferentes constantes de asociación reportadas en la literatura se obtuvieron por medio de espectroscopía de UV-VIS, IR, Rayos X y fluorescencia [19-22]. Recientemente, se estudió la formación de complejos de ácido nalidíxico con α- y β-ciclodextrina por métodos electroquímicos [23]. A pesar de que existen varios reportes sobre la formación de complejos de ciclodextrinas con ácido nalidíxico, existen muy pocos reportes sobre los complejos de ciclodextrinas con ácido oxolínico que también es muy utilizado en la industria farmacéutica. En un artículo reciente, reportamos la formación de complejos de ácido oxolínico con γ-ciclodextrina [24]. En el presente trabajo se hace un estudio comparativo de la formación de complejos de asociación de ácido oxolínico y nalidíxico con β- y γ-ciclodextrina.
Parte experimental
Los ácidos nalidíxico y oxolínico se obtuvieron de Sigma-Aldrich. Las ciclodextrinas (β y γ) fueron donadas por la compañía Cerestar. Los estudios de fluorescencia se hicieron en un espectrofotómetro de fluorescencia Photon Technology International. El estudio de la formación de complejos de inclusión de ácido nalidíxico con β-ciclodextrina se hizo a partir de una solución estándar del ácido (5 × 10-4 M) en HCl al 25 % en volumen con agua desionizada y una solución acuosa de β-ciclodextrina (1 × 10-2 M). Para preparar las mezclas de reacción se miden 0.2 mL de la solución de ácido nalidíxico (5 × 10-4 M) y se colocan en un matraz volumétrico de 10 mL al que se le añade un volumen predeterminado (2, 4, 6, 8, ó 9 mL) de la solución de β-ciclodextrina (1 × 10-2 M). El matraz se afora con agua desionizada hasta la marca de 10 mL. De esta forma se preparan soluciones que tienen una concentración fija de ácido nalidíxico (1 × 10-5 M) y diferentes concentraciones de β-ciclodextrina (2 × 10-3, 4 × 10-3, 6 × 10-3, 8 × 10-3 o 9 × 10-3 M).
Cada una de las mezclas se deja reaccionar a temperatura constante de 25 ºC por 10 minutos para promover la formación del complejo de inclusión.
El estudio de formación de complejos de ácido nalidíxico con γ-ciclodextrina se lleva a cabo de la misma manera. Se utilizan soluciones estándar de ácido nalidíxico (5 × 10-4 M) y γ-ciclodextrina (1 × 10-2 M). En este caso, se miden 2, 4, 5 ó 6 mL de la solución de γ-ciclodextrina y se mezclan con 0.2 mL de la solución de ácido nalidíxico en matraces volumétricos de 10 ml para preparar mezclas de reacción con una concentración fija del ácido (1 × 10-5 M) y diferentes concentraciones de γ-ciclodextrina (2 × 10-3, 4 × 10-3, 5 × 10-3 o 6 × 10-3 M).
El estudio de la formación de los complejos de ácido oxolínico con β-ciclodextrina y γ-ciclodextrina se lleva a cabo repitiendo el procedimiento anterior, solo se sustituye la solución estándar de ácido nalidixico por una solución estándar de ácido oxolínico con la misma concentración (1 × 10-5 M).
Resultados y discusión
La asociación de las moléculas de sustrato y ligando, así como la disociación del complejo formado están gobernados por un equilibrio termodinámico que se representa como una constante de asociación Ka [25] de la reacción que se describe en la Figura 3. El complejo molecular tiene una estequiometría definida en donde las moléculas de sustrato y ligando se encuentran unidas por efectos fisicoquímicos.

Generalmente, las moléculas de ciclodextrinas pueden contener una sola molécula de sustrato dentro de su cavidad (complejo 1:1). En casos especiales, las moléculas de ciclodextrina pueden contener dos moléculas de sustrato para formar un complejo 2:1. Sin embargo, la relación más frecuente es 1:1; ésta es la esencia del encapsulamiento molecular.
La formación de complejos de inclusión ha sido estudiada por medio de una gran variedad de métodos espectroscópicos como UV-Vis, RMN y Fluorescencia [26,27]. La mayoría de las aplicaciones de fluorometría a la formación de complejos de inclusión hacen uso de mediciones en la intensidad de fluorescencia. Se pueden usar varios tipos de arreglos experimentales para estudiar la asociación de dos compuestos orgánicos. En nuestro caso, los componentes del sistema son el sustrato (S) y el ligando (L), uno de los cuales presenta fluorescencia. En la formación del complejo de estas especies, ocurre un decremento en la fluorescencia. Este fenómeno es llamado extinción, y tiene lugar cuando la banda de emisión de la especie fluorescente (S) cubre la banda de absorción del extinguidor (L). A distancias intermoleculares cortas, como en el complejo entre sustrato y ligando, se transfiere energía del estado excitado de (S) al estado basal de (L), y se reduce la intensidad de fluorescencia. De acuerdo a lo reportado por Connors [25], a concentraciones bajas, la intensidad de fluorescencia es directamente proporcional a la concentración de soluto fluorescente de acuerdo a:

Donde F es la intensidad de fluorescencia, Io es la intensidad de la fuente de excitación, ε es la absortividad molar a la longitud de onda de excitación, b es el camino óptico, C es la concentración molar y φ es el rendimiento cuántico de la cantidad de fluorescencia emitida. Debido a esta proporcionalidad directa, el tratamiento cuantitativo de la fluorescencia en la formación de complejos puede llevarse a cabo en la misma forma que la espectroscopia de absorción UV-Vis. Sin embargo, existen diferencias cuantitativas importantes entre absorción y la espectroscopia de emisión, y una de ellas es que la proporcionalidad entre F y C se pierde cuando la concentración se vuelve lo suficientemente alta. El tratamiento cuantitativo de los datos de formación de complejos y su análisis por fluorescencia comienzan con la premisa de que la intensidad es una suma de contribuciones de las moléculas que presentan fluorescencia [25]. Si consideramos un sistema que contiene sustrato S, ligando L y el complejo SL, tenemos:

Donde kS, kSL y kL representan las constantes de proporcionalidad que relacionan las intensidades de los espectros de fluorescencia y las concentraciones de las especies S, L y SL respectivamente. Dado que la ciclodextrina no presenta fluorescencia, la intensidad del espectro en cualquier momento está dada por la siguiente ecuación:

Al inicio de los experimentos, el sustrato no se ha combinado con la ciclodextrina y la intensidad inicial del espectro se describe por una ecuación simplificada.

Donde St es la concentración total del sustrato. El valor de la variable St se puede calcular por medio de un balance de materia para el sustrato:

El valor de SL se obtiene a partir de la constante de equilibrio de la reacción representada en la Figura 3.

Al combinar las ecuaciones anteriores se obtiene una expresión que describe la isoterma de asociación de un complejo 1:1 en términos de la concentración total de sustrato y de la concentración de ligando libre.

Generalmente, la ecuación anterior se escribe en términos de la intensidad (F¥) del espectro de fluorescencia que se obtiene cuando todas las moléculas del sustrato se encuentran combinadas con la ciclodextrina cuyo valor se puede calcular con la siguiente ecuación:

Al sustituir los valores de kS y kSL obtenidos a partir de las ecuaciones (4) y (8) en la ecuación (7) se obtiene la isoterma de asociación en términos de la concentración de ligando libre y de las intensidades de los espectros de fluorescencia.

El doble recíproco de esta ecuación es conocida como la ecuación de Benesi-Hildebrand (10), cuyos parámetros nos permiten calcular la constante de asociación del complejo K11:

En la Figura 4 se muestran los espectros por fluorescencia de la formación de complejo entre el ácido nalidíxico y la β-ciclodextrina. Para el ácido nalidíxico se utilizó una longitud de onda de excitación de 320 nm y una longitud de onda de emisión de 357 nm. Como podemos apreciar en el espectro, la intensidad de fluorescencia del espectro del ácido nalidíxico disminuye al aumentar la concentración del ligando, como efecto del encapsulamiento molécular.

También se obtuvieron los espectros de la formación de los complejos del ácido nalidíxico con γ-ciclodextrina y del ácido oxolínico con β- y γ-ciclodextrina. Los datos de los espectros de fluorescencia sirven para obtener las isotermas de asociación que son las gráficas de ΔF = Fo-F como función de la concentración de la ciclodextrina o ligando L.
Dichos datos se encuentran en las tablas 1, 2, 3 y 4. Dado que las constantes de asociación se calcularon por medio de la ecuación (10), en las tablas mencionadas anteriormente también se incluyen columnas con los valores de 1/ΔF y con los valores de 1/L.
En las Figuras 5 y 6 se muestran las isotermas de asociación de la formación de complejos del ácido nalidíxico y del ácido oxolínico respectivamente con Beta-ciclodextrina y Gama-ciclodextrina. Cabe mencionar que la línea que pasa por los puntos es generada mediante la ecuación de Benesi-Hildebrand con los valores de las constantes obtenidas, sólo para indicar la tendencia de los datos. Como se puede apreciar, la formación del complejo de inclusión es mayor para ambos ácidos con Beta-ciclodextrina. En las Figuras 7 y 8 se muestran las gráficas de la ecuación de Benesi-Hildebrand para obtener las constantes de asociación del ácido nalidíxico y ácido oxolínico con β- y γ-ciclodextrina.




Conclusiones
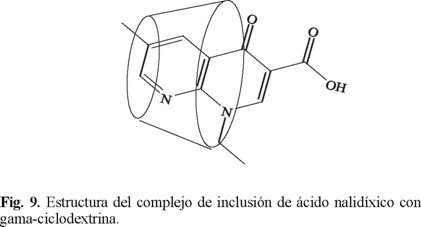
Para determinar las constantes de asociación del ácido nalidíxico y oxolínico con las ciclodextrinas se determinó el cambio en el espectro de fluorescencia de estos ácidos al agregar una cantidad de la ciclodextrina correspondiente. En general, se observó un decremento en la intensidad de fluorescencia. Para el ácido nalidíxico se obtuvo una constante de asociación de 223.26 M-1 con β-CD y de 163.85 M-1 con γ-CD. Para el caso del ácido oxolínico se obtuvieron constantes de asociación de 603.75 M-1 con β-CD y 257.93 M-1 con γ-CD. Estos valores indican que ambas ciclodextrinas pueden acomodar a las moléculas del ácido nalidíxico y ácido oxolínico en su cavidad. Sin embargo, los resultados experimentales indican que se forma un complejo más fuerte entre estos ácidos y la cavidad de la β-ciclodextrina. En los complejos formados con ambas ciclodextrinas existen las mismas fuerzas de atracción, sin embargo en el caso de β-ciclodextrina debe existir una mejor relación entre el sustrato y la ciclodextrina que ocasiona un aumento en las fuerzas de atracción. Valero y col. [28] calcularon la constante dieléctrica de la cavidad de α-, β- y γ-ciclodextrina y encontraron que la cavidad de la β-ciclodextrina es la más hidrofóbica de las tres. Esto puede conducir a la formación de un complejo mas fuerte en el caso de la β-ciclodextrina ya que se logra una mayor penetración de la molécula del ácido nalidíxico u oxolínico en la cavidad. Nuestros resultados confirman que la constante de asociación es mayor para los complejos de la β-ciclodextrina a pesar de que la cavidad es de menor tamaño que la cavidad de la γ-ciclodextrina. En el caso de ácido nalidíxico y oxolínico es de esperarse que los grupos carboxílicos se acomoden en un ambiente hidrofílico mientras que la región aromática se acomode en una región hidrofóbica. Por lo tanto, se puede proponer en ambos casos la formación de complejos con la estructura que se muestra en la Figura 9. En un estudio reciente, se propone esta misma topología para los complejos de ácido nalidíxico con β-ciclodextrina basándose en estudios de mínima energía conformacional [23].

En los diferentes reportes que hay en la literatura sobre complejos de ácido nalidíxico y ciclodextrinas se han obtenido valores de constantes de asociación muy diferentes [19-23]. Estas discrepancias en los valores pueden ocasionarse por la sensibilidad de la técnica analítica o por las características del solvente utilizado en el estudio, ya que en algunos casos se tiene un medio acuoso ácido [20], acuoso básico [24] o acuoso alcohólico [23]. Esto definitivamente modifica las constantes de asociación ya que se modifican algunos factores fisicoquímicos como solubilidad y estado iónico. Por lo tanto, lo que es importante no es sólo el valor, sino la tendencia que se observa en las constantes de asociación. En este estudio en particular, se observa la misma tendencia en las constantes de asociación que se determinaron en un medio acuoso ácido para el ácido nalidíxico con β y γ-ciclodextrina y las constantes de asociación previamente determinadas en un medio acuoso alcohólico [23].
Los resultados que se presentan en este trabajo indican que se pueden formar complejos de β y γ-ciclodextrina con ácido oxolínico y nalidíxico por lo que se puede esperar un aumento en la solubilidad de estos fármacos una vez encapsulados en estas ciclodextrinas.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología por el proyecto de investigación Ref. 31338U, al Sistema de Investigación Miguel Hidalgo (SIGHO) No. Ref. 20000206022. Gracias a Cerestar por la donación de las ciclodextrinas.
Referencias
1. Nagai, T.; Ueda, H. Aspects of Drug Formulation with Cyclodextrins, 1996, 3, 441-449, [ Links ] Cyclodextrins, Szejtli, J.; Osa, T.; Comprehensive Supramolecular Chemistry, Atwood, L.; Davies, D.; Macnicol, D.; Vögtle, F., Lehn, J-M., Ed. Pergamon Press, New York. [ Links ]
2. Hedges, A.R. Chem. Rev. 1998, 98, 2035-2044. [ Links ]
3. Olah, J.; Cserháti, T.; Szejtli, J. Wat. Res. 1988, 22, 1345-1351. [ Links ]
4. Pospisil, L.; Colombini, M.P. J. Incl. Phenom. Molec. Rec. Chem. 1993, 16, 255-266. [ Links ]
5. Leyva, E.; Moctezuma, E.; Monreal, E.; Beltrán, J. Educ. Quím. 2002, 13, 2, 82-84. [ Links ]
6. Leyva, E.; Moctezuma E.; Strouse, J.; García-Garibay, M. J. Incl. Phenom. Macro. Chem. 2001, 39, 41-46. [ Links ]
7. Uekama, K.; Hirayama, F.; Irie, T. Chem. Rev. 1998, 98, 2045-2076. [ Links ]
8. Inoue, Y.; Rekharsky, V.; Mikhail, V. Chem. Rev. 1998, 98, 1875-1917. [ Links ]
9. Hirose, K. J. Incl. Phenom. Macro. Chem. 2001, 39, 193-209. [ Links ]
10. Ou-Yang, H.D., Lau, W.; Islam, M.F.; Meyer, E.E. Langmuir 2000, 16, 5519-5522. [ Links ]
11. Rekharsky, M.V.; Goldberg, R.N.; Schwartz, F.P.; Tewari, Y.B.; Ross P.D.; Yamashoji Y.; Inoue Y. J. Am. Chem. Soc. 1995, 117, 8830-8840. [ Links ]
12. Park, J.H.; Nah, T.H. J. Chem. Soc. Perkin Trans. 1994, 1359-1362. [ Links ]
13. Szejtli, J., Chem. Rev. 1998, 98, 1743-1753. [ Links ]
14. Connors K.A. Chem. Rev. 1997, 97, 1325-1357. [ Links ]
15. King D., Malone R., Lilley S. American Family Physician 2000, 61, 2741-2762. [ Links ]
16. Kaminski, D.; Meltzer, R.I. J. Med. Chem. 1968, 11, 160-168. [ Links ]
17. Leyva, E.; Monreal, E.; Hernández, A.; Leyva, S. Rev. Soc. Quím. Méx. 1999, 43, 2, 63-68. [ Links ]
18. Leyva, E.; Monreal, E.; Hernández, E. J. Fluor. Chem. 1999, 94, 7-10. [ Links ]
19. Kimura, K.; Endo, T.; Nagasae, H.; Ueda, H.; Tomono, K.; Kobayashi, S.; Nagai, T. S.T.P. Pharma. Sci. 2000, 10, 409-414. [ Links ]
20. Duran-Meras, I.; De la Peña, A.M.; Salinas, F.; Caceres, I.R. Analysts 1994, 119, 1215-1219. [ Links ]
21. Duran-Meras, I.; De la Peña, A.M.; Salinas, F.; Caceres, I.R. Appl. Spectrosc. 1997, 51, 684-688. [ Links ]
22. Celebi, N.; Shirakura, O.; Mizushima, N.; Machida, Y.; Nagai, T. Med. Pharma. 1987, 11, 216-222. [ Links ]
23. Saeta, I.S., Ibrahim, M.S., Sultan, M.R. Can. J. Chem. 2002, 80, 1313-1319. [ Links ]
24. Leyva, E., Moctezuma, E., Monreal, E., Espinosa, C., Tovar, E. Educ. Quím. 2002, 13, 3, 158-159. [ Links ]
25. Connors K.A., "Binding Constants", Ed. John Wiley & Sons Inc., U.S.A., 1987. [ Links ]
26. Hirose, K. J. Incl. Phenom. Macro. Chem. 2001, 39, 193-209. [ Links ]
27. Yang, C.; Liu, L.; Mu, T.W.; Guo, Q.X. J. Incl. Phenom. Macro. Chem. 2001, 39, 97-101. [ Links ]
28. Valero, M.S.; Rodríguez, L.J.; Vélazquez, M.M.; Il Farmaco, 1996, 51, 525-529. [ Links ]














