Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química de México
versão impressa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.2 Ciudad de México Abr./Jun. 2004
Investigación
Aplicación de poli(metacrilatos de carboxialquilo) en sistemas de liberación de propranolol por intercambio iónico
José Manuel Cornejo-Bravo,1* Ángel Licea-Claverie2 y Miguel Ángel Velázquez1
1 Facultad de Ciencias Químicas e Ingeniería. Universidad Autónoma de Baja California. Circuito Mirasol 14094 Fraccionamiento Altabrisa, Mesa de Otay, C.P. 22390, Tijuana, Baja California, México. * Tel/Fax (+52-664)-682-2790. E-mail: jmcornejo@uabc.mx
2 Centro de Graduados e Investigación, Instituto Tecnológico de Tijuana, A.P. 1166, C.P. 22000 Tijuana, B.C., México.
Recibido el 8 de diciembre del 2003.
Aceptado el 17 de mayo de 2004.
Resumen
Se reporta la preparación y caracterización de complejos de propranolol con dos poli(metacrilatos de carboxialquilo). Se estudió la cinética de liberación del fármaco a partir de tabletas preparadas con los complejos, en medio gástrico e intestinal simulado. Los resultados fueron comparados contra tabletas que contienen propranolol·HCl y un complejo fármaco-Eudragit® L. Los resultados indican que la velocidad de liberación decrece, en ambos medios, a medida que aumenta el tamaño de la cadena alquílica y la densidad de carga. Los polímeros preparados son buenos candidatos para sistemas de liberación prolongada de fármacos por intercambio iónico.
Palabras clave: Liberación de fármaco, polielectrolitos, metacrilatos, hidrofóbico.
Abstract
Complexes of propranolol with carboxyalkylmethacrylates were prepared and characterized. Kinetics of drug release from tablets prepared with the complexes were studied in gastric and intestinal simulated fluids. Results were compared to those of tablets containing propranolol·HCl and a complex of drug and Eudragit® L. The results indicate that drug release rate, in both media, is reduced as alkyl side chain and charge density increases. The prepared polymers are good candidates for extended drug release systems.
Key words: Drug release, polyelectrolites, methacrylates, hydrophobic.
Introducción
Los polímeros que contienen grupos ionizables a lo largo de su cadena se conocen como polielectrolitos. Los polielectrolitos con grupos ácido (aniónicos) pueden formar complejos con fármacos que contienen grupos amino (catiónicos) de acuerdo al esquema:

Cuando estos complejos son administrados por vía oral, el fármaco es liberado por un proceso de intercambio iónico como se muestra en los siguientes esquemas:
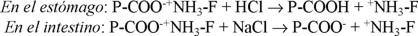
El proceso de intercambio iónico ha sido estudiado ampliamente para la liberación prolongada de fármacos usando polielectrolitos reticulados (resinatos) [1-3].
Últimamente ha habido un interés en la aplicación de polielectrolitos hidrofóbicos lineales (no reticulados) para el mismo propósito. Estos materiales forman complejos insolubles en agua con fármacos de carga opuesta. Dichos complejos pueden ser formulados como tabletas para obtener un mecanismo combinado de liberación entre erosión de la tableta e intercambio iónico con las sales del medio [4-8].
Para la aplicación farmacéutica es necesario que el material tenga cierto grado de hidrofobicidad, medida como la capacidad de los materiales para absorber vapor de agua (Q) [9], de tal forma que los complejos con fármacos sean insolubles en agua pura de manera que puedan ser recuperados, y para que el proceso de hidratación del complejo en las formas farmacéuticas sea lento, permitiendo una liberación prolongada del fármaco. Para esto se han estudiado copolímeros aleatorios de un monómero ionizable y un monómero no ionizable que le confiera hidrofobicidad a las cadenas [4-6]. Esta copolimerización reduce la interacción iónica entre polielectrolito y fármaco, y posiblemente reduce la capacidad de carga del polielectrolito.
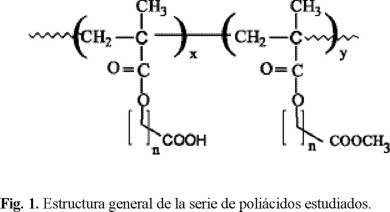
Recientemente desarrollamos los pasos de síntesis para una nueva serie de poli(metacrilatos de carboxialquilo) los cuales contienen unidades repetitivas hidrofóbicas con grupos ácido carboxílico terminal como se observa en la figura 1 [10].
En este trabajo se evaluó la capacidad de estos materiales para formar complejos con el fármaco propranolol (Fig. 2). Se seleccionó este fármaco como modelo ya que existen reportes previos de la formación de complejos con poliácidos [4, 6]. Además, se evaluó el potencial de los complejos formados para la liberación del fármaco por intercambio iónico. Propranolol representa a una familia de antihipertensivos (bloqueadores beta) con tiempos de vida corto (2 a 3 h), por lo que sistemas de liberación prolongada reducen la frecuencias de dosificación, haciéndolo mas conveniente para el paciente y optimizando la farmacoterapia.
Los materiales estudiados fueron poli(ácido 4-metacriloiloxibutanoico-co-4-metacriloiloxibutanoato de metilo) (Pn3), poli(ácido 6-metacriloiloxihexanoico-co-6-metacriloiloxihexanoato de metilo) (Pn5) y poli(ácido 10-metacriloiloxidecanoíco-10-metacriloiloxidecanoato de metilo) (Pn9). Se evaluó la cinética de liberación a partir de tabletas que contienen los complejos preparados. Dichas tabletas fueron formuladas para desintegración rápida, de tal manera que el mecanismo de liberación principal fuera el intercambio iónico y así poder estudiar los factores que afectan este fenómeno. Los resultados fueron comparados con los obtenidos a partir de tabletas de propranolol·HCl (no acomplejado), con complejos de propranolol con el polielectrolito comercial Eudragit® L [poli(ácido metacrílico-co-metacrilato de metilo) 1:1], y con una mezcla de propranolol·HCl y Pn5.
Resultados y discusión
La Tabla 1 presenta el peso molecular en peso (Mw) de los polielectrolitos utilizados, el % de grupos ácidos, los valores de Q, el % de carga esperada y la carga real de fármaco. La carga esperada se calculó de acuerdo a la fórmula química de la unidad monomérica básica:

Donde Mu es el peso molecular de la unidad monomérica básica, χx es la fracción de grupos ácidos, Mx es el peso molecular del monómero ácido y My es el peso molecular del monómero ácido protegido (véase figura 1, al monómero ácido se le debe eliminar el protón ionizable para calcular Mx). Considerando que una unidad monomérica (anión) se une a una molécula de propranolol protonado (catión), la carga esperada se obtiene usando ecuación 2:

donde Mp es el peso molecular del propranolol protonado.
Eudragit® L, Pn3 y Pn5 fueron completamente solubles a un pH de 7.4 y formaron complejos con propranolol, insolubles en agua pura. Por otra parte, para el Pn9 fue necesario un pH arriba de 8.5 para disolución completa del polielectrolito. Esto es debido a que a un aumento en la hidrofobicidad, incrementa el pKa aparente de los grupos ácidos [11], por lo que se requiere un mayor pH para la ionización de las cadenas. Los pKa previamente calculados son 5.8, 6.3 y 7.6 para Pn3, Pn5 y Pn9 respectivamente [10]. Debido a su hidrofobicidad, se requiere que Pn9 tenga un alto grado de ionización (87%) para su solubilización. Al mezclar la solución del polielectrolito con la solución del propranolol·HCl (pH = 5.11) precipitó el polímero no ionizado, por lo que no se le realizaron estudios posteriores.
La carga de fármaco en el complejo con Eudragit® L es más alta que la esperada. Esto corrobora reportes previos donde se muestra que interacciones hidrofóbicas colaboran en la interacción del fármaco con el polielectrolito [4]. Se obtuvieron resultados similares en el complejo con Pn3. Sin embargo para Pn5 la carga de fármaco es menor que la esperada. Esto puede deberse al hecho de que Pn5 precipita a valores de pH mayores que los otros polielectrolitos como se desprende de los estudios de las curvas de titulación reportadas previamente [10]. Por lo tanto, algunas cadenas pueden precipitar como la forma no ionizada al ponerse en contacto con la solución ácida de propranolol·HCl, sin la formación del complejo, mientras que las cadenas que permanecen ionizadas en solución forman complejo con el fármaco y precipitan como tal. El fenómeno de precipitación fraccionada de cadenas no ionizadas para dejar las cadenas ionizadas en solución ha sido demostrado para otros polielectrolitos hidrofóbicos [12,13].
El espectro de FT-IR de los complejos, presenta una banda de absorción a 1555 cm-1, la cual no está presente en las mezclas físicas correspondientes. Esta banda ha sido asignada a las vibraciones autosimétricas de los grupos COO- resultantes de la formación de sal entre el propranolol y el polímero. La figura 3 presenta el espectro para el complejo y la muestra con Pn5 como ejemplo. Las señales en la mezcla representan las señales observadas en los espectros del propranolol·HCl y Pn5 puros, por lo que no se detecta interacción en la mezcla.

La figura 4 muestra el análisis de calorimetría diferencial de barrido (DSC) para la mezcla y el complejo de propranolol·HCl y Pn5. La mezcla física muestra un pico agudo a 166 oC correspondiente al punto de fusión del propranolol·HCl. Sin embargo, este pico característico desaparece en las curvas de DSC para los complejos, lo que indica que todo el propranolol en el complejo se encuentra interaccionando con el polielectrolito. Resultados similares se observaron con los otros polilectrolitos estudiados.

Debido a que la disolución de polvo de propranolol·HCl es demasiado rápida para obtener parámetros de disolución, la velocidad de disolución de los complejos en polvo no pueden ser comparados con los del fármaco. Por lo tanto, se prepararon tabletas para estudiar las velocidades de disolución. La figura 5 presenta los resultados de la prueba de disolución en fluido intestinal simulado (pH 7.4) de las tabletas de propranolol·HCl, de los tres diferentes complejos preparados y de la mezcla propranolol·HCl/Pn5

Las pruebas de disolución muestran que la velocidad de liberación disminuye en la medida que aumenta el tamaño de las cadenas alifáticas. Los valores del Tiempo Medio de Disolución (tDmed) calculados para cada sistema se muestran en la Tabla 2. El valor de Q (Tabla 1) para Eudragit L es muy similar al de Pn3; sin embargo, Pn3 tiene una mayor proporción de grupos ácido carboxílico por lo tanto cuando estos se ionizan la densidad de carga lineal es mayor, afectando la velocidad de liberación al tener una mayor fuerza de interacción iónica con el fármaco con carga opuesta.
La cinética de liberación es más lenta para el complejo con Pn5 que con Pn3, a pesar de que los dos tienen similares proporciones de grupos ionizables. En este caso podemos atribuir la disminución en la cinética a una mayor hidrofobicidad (menor valor de Q) para el Pn5, lo que reduce la velocidad de hidratación del las partículas de la formulación, reduciendo así la velocidad de liberación.
Se observa una tendencia similar en las curvas de disolución en medio gástrico simulado (pH 1.2) (Fig. 6). Los tDmed calculados se muestran también en la tabla 2. Se observa que la velocidad de disolución disminuye considerablemente a medida que la disolución avanza, en ambos medios. Las tabletas contienen el super desintegrante Explotab® para una desintegración rápida, con la intención de que el principal proceso que controle la disolución fuera el intercambio iónico. Sin embargo, el proceso de liberación parece proceder en varios pasos, como se ha observado con otros polielectrolitos solubles [14]: penetración del frente de disolución con una liberación simultánea de una fracción del fármaco; hinchamiento subsiguiente del polímero con la formación de una barrera gelosa; liberación del fármaco por intercambio iónico y difusión a través de la matriz gelosa, y la eventual disolución del complejo con la liberación del fármaco por intercambio iónico.
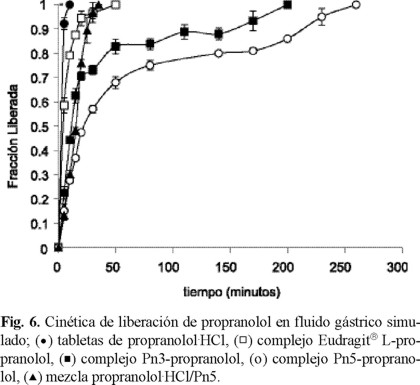
La disminución de la velocidad de liberación en los estados tardíos de la liberación es mas pronunciada en medio ácido. A pH 1.2, los polielectrolitos son prácticamente insolubles en agua y pueden producir una barrera de polímero no ionizado, con las cadenas colapsadas, lo que reduce la difusión de las moléculas del fármaco. El efecto es más marcado para Pn5, debido a su mayor hidrofobicidad. Este comportamiento es opuesto al observado con otros poliácidos débiles donde la protonación en medio ácido de los grupos carboxilo produce una rápida ruptura del complejo y liberación del fármaco. Tal fenómeno se observa en el complejo con Eudragit® L. Al parecer, la hidratación lenta y la relajación de las cadenas de los complejos con Pn3 y Pn5 evitan la conversión rápida del polielectrolito a la forma no ionizada reduciéndose la velocidad de ruptura del complejo.
Los datos de liberación fueron analizados de acuerdo al modelo semiempírico que se muestra en la ecuación 1 [15,16]
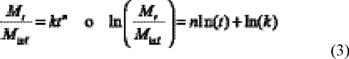
Los términos en esta ecuación son los siguientes Mt, la cantidad liberada a tiempo t; Minf, la cantidad total de fármaco liberada, k la constante cinética; y n, el mecanismo de liberación del fármaco. El valor de n varía entre 0.5 (dependiente del t1/2, difusión Fickiana) a 1 (representa el transporte Caso II, controlado por relajación). Valores de n entre 0.5 y 1 indican un comportamiento anómalo correspondiente a un acoplamiento entre difusión y relajación. Valores de n >1 se conocen como transporte Super Caso II.
Al ajustar los datos a este modelo se observa un cambio en el proceso de liberación para los complejos con los polielectrolitos Pn3 y Pn5. En la tabla 2 se presentan los resultados de la regresión para las curvas de liberación en fluidos intestinal simulado y gástrico simulado. Como puede verse las tabletas de propranolol·HCl y el complejo con Eudragit® L no se ajustan a este modelo en ninguno de los medios, debido quizá a la rápida disolución del fármaco. En la primera fase de la disolución, se observa un valor de n cercano a 1 para el complejo con Pn3 en fluidos gástrico e intestinal, así como para el complejo Pn5 en fluido intestinal. Este tipo de cinética de liberación se observa cuando se combinan los mecanismos de intercambio iónico y disolución/erosión de cadenas del polímero [7,8]. El complejo Pn5 presenta un valor de 0.758 en medio gástrico. En este caso hay una influencia del proceso de difusión del fármaco debido a la formación de la barrera de polímero no ionizado. En la segunda fase el proceso de liberación no se ajusta al modelo en ninguno de los casos; esto se puede atribuir a que, en el caso del fluido intestinal, la barrera gelosa cambia su espesor con el transcurso del tiempo. En el caso del fluido gástrico se espera que el coeficiente de difusión no sea constante al incrementarse el tamaño de la barrera de polímero no ionizado a medida que avanza la disolución.
En el caso de las mezclas físicas entre fármaco y Pn5, se observa que la disolución en fluido intestinal es similar a la del propranolol·HCl (Fig. 5). En este caso se observa una rápida desintegración de la tableta y la completa disolución del polielectrolito. La disolución en fluido gástrico simulado presenta una disgregación mas lenta de la tableta con la presencia del polielectrolito no disuelto al final de la disolución del fármaco. El valor de n de 1.08 indica que el proceso de liberación es controlado por la disgregación/erosión de la tableta. En este caso no se observa una reducción en la velocidad de disolución del fármaco a medida que avanza el proceso de disolución como en el caso del complejo. Estos resultados indican que, si bien puede existir una interacción hidrofóbica entre fármaco y polielectrolito, ésta no afecta la cinética de liberación del fármaco, contrario a lo observado en otros sistemas de liberación estudiados que contienen un dominio hidrofóbico [17].
Parte experimental
Síntesis y caracterización de los polielectrolitos. Pn3, Pn5 y Pn9 fueron preparados como ha sido reportado [10]. El polímero fue caracterizado por 1H-RMN de 200 MHz (Varian Gemini 200). La proporción de grupos ácido (desprotegidos) a grupos protegidos se obtuvo a partir de la integración de la señal a 3.667 ppm que se asigna al grupo metilo del metoxiéster en los ácidos protegidos y la integración de la señal a 4.006 ppm que se asigna al grupo metileno unido al grupo metacriloxi el cual da una sola señal tanto para ácidos protegidos como los desprotegidos. El peso molecular promedio en peso (Mw) fue determinado por dispersión de luz estática (SLS-Systemtechnik).
Determinación de la capacidad de absorción de agua por los polielectrolitos. Con el fin de conocer la hidrofobicidad de los materiales se realizó la siguiente prueba de absorción de agua (método isopiéstico). Se colocó una cantidad conocida de cada polielectrolito en un pesafiltros, próximo a un vaso de precipitado con agua destilada. Todo dentro de un matraz invertido con chaqueta para circulación de agua. La temperatura fue mantenida a 25 °C usando un recirculador de agua. La muestras fueron pesadas repetidamente por varias semanas hasta que se obtuvo un peso constante. La cantidad de agua absorbida por peso del polímero, Q, fue calculado a partir Q = (peso final/peso inicial). Cada determinación se realizó por duplicado.
Preparación de los complejos. Los complejos de propranolol-polielectrolito fueron preparados siguiendo un procedimiento previamente reportado [4]: el propranolol·HCl (40 g) fue disuelto en agua destilada (200 ml). Esta solución es saturada a temperatura ambiente pero se disuelve a 37 °C, de esta forma se tiene la mayor concentración de propranolol disuelto posible. El poliácido correspondiente (Eudragit® L, de Helm de México y Pn3, Pn5 y Pn9 sintetizados) (10 g) fue disuelto en agua (200 mL) ajustando el pH a 7.4 mediante la adición de 1 N NaOH (excepto Pn9 que requirió un pH de 8.5 para su disolución completa). La solución de polímero fue adicionada lentamente a la solución de propranolol·HCl con agitación constante a 37 °C. El precipitado obtenido fue filtrado y lavado con agua destilada. El producto fue secado a 40 °C por 5 días, molido y tamizado por malla 100.
Caracterización de los complejos. El espectro FTIR (Perkin-Elmer 1600) de los complejos fue obtenido usando el método de la tableta de KBr. De igual manera se obtuvo el espectro de mezclas físicas (1:1) de los polielectrolitos correspondientes y propranolol·HCl. Se realizó Análisis por Calorimetría Diferencial de Barrido (DSC) en los complejos preparados, así como en las mezclas físicas de cada polímero y propranolol·HCl, usando un calorímetro TA-Instruments modelo MDSC 2920 a una velocidad de calentamiento de 5 K/min, con un programa de calentamiento modulado de 1 °C cada 60 s.
El contenido de propranolol en cada complejo fue determinado de la siguiente manera: se disolvió una muestra previamente pesada del complejo correspondiente en amortiguador de fosfatos 1M a pH 7.4. La solución fue filtrada en filtros millipore de 0.22 µm y ensayada por espectroscopia UV a 288 nm. La concentración de propranolol en la solución fue calculada mediante curva de calibración utilizando propranolol·HCl como estandar. El contenido de propranolol en la muestra fue calculada a partir del contenido de propranolol en la solución y el peso de la muestra, haciendo una corrección por el hecho de que el estandar utilizado es el propranolol·HCl y en el complejo se considera que el propranolol se encuentra como la base protonada.
Estudios de disolución. Se prepararon tabletas de los complejos por compresión directa usando una prensa Carver a 3000 kg usando una matriz de 1.3 cm de diámetro. Cada tableta contiene una formulación con una cantidad de complejo correspondiente a 100 mg de propranolol base (50% del peso total de la tableta), celulosa microcristalina (15%), lactosa (29.3%) almidón glicolato de sodio (Explotab), 5% y estearato de magnesio (0.7%). Se prepararon también tabletas conteniendo una mezcla de propranolol·HCl (25%), Pn5 (25%) y el resto de los excipientes. Los estudios de disolución fueron realizados en 900 ml de fluido gástrico simulado (sin enzimas), pH (1.2) y fluido intestinal simulado, pH 7.4 (USP XXIII). Los estudios de disolución fueron realizados en un disolutor Sotax, usando paletas a 37 °C y 100 rpm. Cada prueba se realizó utilizando 3 tabletas. Las muestras fueron tomadas a tiempos predeterminados (5, 10, 15, 20, 30, 50, 80, 110 min). En algunos casos se ajusto el muestreo de acuerdo a los resultados previos. Las muestras fueron filtradas en filtros millipore de 0.22 µm. El contenido de propranolol en las muestras fue determinado por espectroscopía UV a 288 nm. La cantidad de propranolol utilizado por tableta permitió una evaluación adecuada de la liberación mantenido condiciones "resumidero" en el medio de liberación.
Conclusiones
Los poli(metacrilatos de carboxialquilo) forman complejos con propranolol excepto en el caso donde la hidrofobicidad del polímero impide la disolución del mismo a pH de 7.4 (Pn9). Los complejos formados son insolubles en agua pura. Las pruebas de disolución de los complejos muestran que la velocidad de liberación del fármaco a partir de los polielectrolitos estudiados decrece a medida que el tamaño de la cadena alifática incrementa. Esto es debido a un incremento en la hidrofobicidad a medida que se incrementa el número de metilenos en la cadena lateral de los polímeros. La densidad de carga también tiene un efecto sobre la cinética de liberación. A medida que el porcentaje de grupos ionizables aumenta, disminuye la velocidad de liberación. Los resultados indican que la nueva serie de poli(metacrilatos de carboxialquilo) son buenos candidatos como sistemas de liberación de fármacos por intercambio iónico. Sin embargo, existe la limitación de que el polielectrolito debe ser soluble al pH al cual pueda formarse complejo con el fármaco, lo que limita el uso de polielectrolitos mas hidrofóbicos como es el caso del Pn9.
La liberación del fármaco está controlada por el intercambio iónico y la erosión de la tableta en los estadíos tempranos de la liberación. En una segunda fase del proceso de liberación se involucra la formación de una barrera gelosa o de polímero insoluble, produciendo un proceso de liberación complejo.
Agradecimientos
Los autores agradecen el apoyado otorgado por CONACYT (28022-U) y por SEP-CONACYT-2002-C01-40262 para la realización de este proyecto.
Referencias
1. Raghunathan, Y.; Amsel, L.; Hinsvark, O.; Brynt, W. J. Pharm. Sci. 1981, 70, 379-384. [ Links ]
2. Burke, G. M.; Mendes, R. W.; Jambhekar, S. S. Drug Dev. Ind. Pharm. 1986, 125, 713-732. [ Links ]
3. Irwin, W. J.; McHale, R.; Watts P. J. Drug Dev. Ind. Pharm. 1990, 16, 883-989. [ Links ]
4. Lee, H.; Hajdu, J. P.; McGoff, P. J. Pharm. Sci. 1991, 80, 178-180. [ Links ]
5. Nujoma, Y. N.; Kim, C. J.; Chern, R. T. J. Pharm. Sci. 1996, 85, 1091-1095. [ Links ]
6. Konar, N.; Kim C. J. J. Pharm. Sci. 1997, 86, 1339-1344. [ Links ]
7. Konar, N.; Kim, C. J. J. Control. Rel. 1999, 57, 141-150. [ Links ]
8. Konar, N.; Kim, C. J., in: Polymeric Drugs & Drug Delivery Systems, Ottenbrite, R., and Kim, S.W. Eds., Technomics Publishing Co, Lancaster PA, 2001, 68-85. [ Links ]
9. Martin, A. Physical Pharmacy, 4th Ed., Lea & Febinger, Philadelphia, 1993, 111. [ Links ]
10. Rogel-Hernández, E.; Licea-Claverie, A.; Cornejo-Bravo, J. M.; Arndt, K. F. Desig. Monom. Polym. 2001, 4, 343-356. [ Links ]
11. Conio, G.; Patrone, E.; Russo, S.; Trefiletti, V. Makromol. Chem. 1976, 177, 49-61. [ Links ]
12. Shatkay, A.; Michaeli, I. J. Phys Chem. 1966, 70, 3777-3782. [ Links ]
13. Siegel, R. A.; Cornejo-Bravo, J. M., in: Polyelectrolyte Gels, ACS Symposium Series, 1991, 131-145. [ Links ]
14. Ranade, V. V.; Holliger, M. A. Drug Delivery Systems, CRC Press, New York, 1996, 73-78. [ Links ]
15. Masaro L.; Zhu X. Prog. Polym. Sci. 1999, 24, 731-775. [ Links ]
16. Narasimhan B.; Mallapragada S. K.; Peppas N. A., in Encyclopedia of Controlled Drug Delivery, Vol. 2, Mathiowitz, E., Ed., John Wiley & Sons, Inc., New York, 1999, 921-935. [ Links ]
17. Inoue T.; Chen G.; Nakamae K.; Hoffman A. S. J. Control. Rel. 1997, 49, 167-176. [ Links ]














