Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.2 Ciudad de México abr./jun. 2004
Investigación
Inhibidores de la germinación en el residuo seco del tallo del amaranto (Amaranthus hypochondriacus)
Olga Tejeda-Sartorius,1* J. Alberto Escalante-Estrada,1 Marcos Soto-Hernández,1 Ma. Teresa Rodríguez-González,1 Heike Vibrans y Martha E. Ramírez-Guzmán2
1 Programa de Postgrado en Botánica, Colegio de Postgraduados, Carretera México-Texcoco, km 35.5, Montecillo, México 56230, México. Teléfono/Fax: 01 (595) 952 02 47. E-mail: olgats@colpos.mx
2 Programa de Postgrado en Estadística, Colegio de Postgraduados. Teléfono/Fax: 01 (595) 952 02 55.
Recibido el 24 de octubre del 2003.
Aceptado el 12 de mayo de 2004.
Resumen
Se evaluó el efecto del extracto acuoso del residuo seco del tallo del amaranto (Amaranthus hypochondriacus L. var. Azteca) a diferentes concentraciones, en la germinación y longitud de radícula y vástago de Amaranthus hybridus L. Dicho extracto, a 108 y 54 ppm inhibió la germinación de la especie en 100% y 68.42%, respectivamente, disminuyendo significativamente la longitud del vástago y la radícula, cuando la inhibición de la germinación no fue total. Se identificaron los ácidos ferúlico (AFE) y p-cumárico (APC) como los principales ácidos fenólicos del residuo, los cuales se reportan por primera vez en este material vegetal. El aislamiento, separación e identificación de estos compuestos se hizo mediante hidrólisis alcalina, cromatografía en capa fina, cromatografía de líquidos de alta resolución y resonancia nuclear magnética de hidrógeno. Se comparó la toxicidad del extracto acuoso con la de los estándares de AFE y APC. La combinación de ambos ácidos a 10-3 M retrasó más la germinación de A. hybridus, comparada con el efecto de los ácidos individuales. La concentración 10-3 M de los ácidos individuales y combinados inhibió significativamente el crecimiento de las plántulas de A. hybridus.
Palabras clave: Amaranthus hypochondriacus, A. hybridus, alelopatía, ácido ferúlico, ácido p-cumárico, maleza.
Abstract
We evaluated the effect of the aqueous extract of amaranth (Amaranthus hypochondriacus L. var. Azteca) stem dry residue on germination and radicle and shoot length of Amaranthus hybridus L., at different concentrations. The aqueous extract at concentrations of 108 and 54 ppm inhibited the germination of this species (100% and 68.42%, respectively) and also significantly decreased radicle and shoot length, when the inhibition was not total. Ferulic (FEA) and p-coumaric (PCA) acids were identified as the main phenolic acids in amaranth dry stems. The present study represents the first report on the presence of both phenolic acids in this plant material. The isolation, separation and identification of these compounds were performed by alkaline hydrolysis, thin layer chromatography, high performance liquid chromatography and hydrogen nuclear magnetic resonance. The toxicity of aqueous extract was compared with standards of AFE and APC. Combination of both acids at 10-3 M caused more delay in the germination of A. hybridus compared with the individual acids. Concentration of 10-3 M of individual and combined acids significantly decreased seedlings growth.
Key words: Amaranthus hypochondriacus, A. hybridus, allelopathy, ferulic acid, p-coumaric acid, weed.
Introducción
En México, algunas especies de Amaranthus fueron cultivadas por los aztecas como uno de los principales cultivos de grano. A pesar de que ellos conocían las bondades nutricionales del amaranto, han tenido que pasar seis siglos para confirmar este hecho por medio de la bioquímica moderna [1]. En 1975, en un estudio llamado "Underexploited Tropical Plants With Promising Economic Value", el amaranto fue seleccionado como uno de los cultivos más prometedores a nivel mundial [2]. Los amarantos también han sido cultivados como verduras desde hace aproximadamente 2000 años y continúan siendo consumidas de esta forma en diferentes lugares del mundo [2], entre ellos, México [3,4].
Por otro lado, algunos autores han reportado propiedades alelopáticas en algunas especies del género Amaranthus. En A. palmeri, los aleloquímicos más activos fueron compuestos volátiles [5]. Posteriormente, se encontró que metil cetonas y alcoholes eran los componentes predominantes de los volátiles asociados a panojas, tallos y raíces de A. palmeri [6]. Otras especies de este género (A. retroflexus, A. hybridus, A. cruentus, A. spinosus, A. hypochondriacus) también emiten compuestos orgánicos volátiles de la parte aérea, tales como alcoholes, aldehídos, ésteres, hidrocarburos, cetonas y un grupo misceláneo [7]. Algunos autores proponen a los esteroles como aleloquímicos, por ejemplo, condrilasterol en A. palmeri [8]; así como ácidos grasos libres, esteroles y triterpenoles, entre otros [9]. Sin embargo, el conocimiento relacionado a la alelopatía en este género es aún limitado [8], principalmente en aspectos de actividad biológica, por ejemplo, germinación de semillas de cultivos agrícolas y de maleza.
Los herbicidas naturales están basados en el uso de productos naturales, conocidos como compuestos alelopáticos; dichos compuestos, además, han servido para el descubrimiento y desarrollo de herbicidas sintéticos [10]. Varias especies de cultivos y maleza pueden ser el origen de dichos productos naturales [11]. Así, los cultivos con propiedades alelopáticas pueden ser estudiados mediante el efecto de la descomposición de los residuos de la cosecha en el desarrollo de maleza y la producción de los cultivos [12-15].
El objetivo de esta investigación fue analizar, a través de pruebas biológicas in vitro, el potencial alelopático del residuo seco del tallo del amaranto (A. hypochondriacus L. var. Azteca), en la germinación y el crecimiento de A. hybridus L.; así como realizar un análisis fitoquímico para identificar los principales compuestos responsables de dicha actividad.
Resultados y discusión
El extracto acuoso crudo del residuo seco del tallo del amaranto mostró propiedades alelopáticas, al igual que varias de las concentraciones probadas de AFE y APC. La concentración inicial del extracto acuoso, 108 ppm, y la de 54 ppm fueron las que más afectaron la germinación de A. hybridus. La primera inhibió 100% su germinación durante las 72 h que duró el experimento; la segunda, inhibió 68.42 %, respecto al testigo. A menores concentraciones, se presentó una actividad estimulante en la mayor parte de los tratamientos (Tabla 1). Por otro lado, el extracto acuoso a las 54 ppm, donde sí hubo germinación, inhibió (P < 0.05) el crecimiento de la radícula y el vástago de A. hybridus, comparado con las concentraciones inferiores y el testigo (Tabla 2). Los extractos crudos de muchas plantas inhiben significativamente la germinación y crecimiento de otras especies; teóricamente, dichos extractos podrían ser usados como herbicidas naturales, aunque aún se necesita mucha investigación para explotar esta vía [10]. Un acercamiento muy fructífero ha sido utilizar productos de deshecho de las plantas que son procesadas para alimento [16-18].
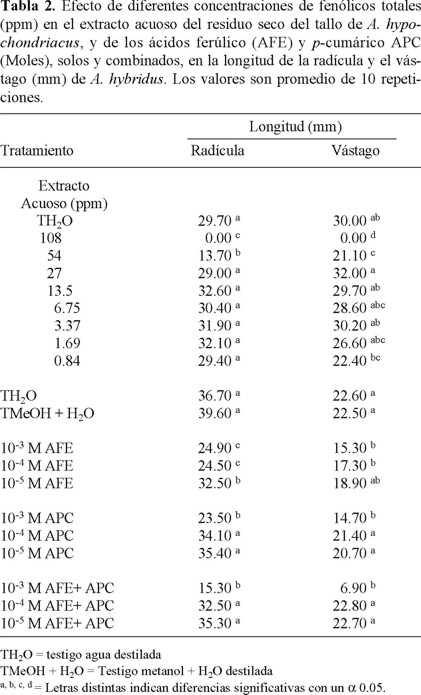
La actividad biológica de AFE y APC fue determinada en semillas de A. hybridus. Los ensayos indicaron que la concentración 10-3 M (194.2 ppm para AFE y 164.2 ppm para APC) del combinado de ambos ácidos produjo un retraso (P < 0.05) en la germinación de esta especie hasta las 48 h; sin embargo, este retraso disminuye a las 72 h. Las concentraciones 10-4 y 10-5 M tienden a estimular la germinación, aun cuando la diferencia con el testigo no fue significativa. Asimismo, la concentración 10-3 M de los ácidos fenólicos individuales produjo un retraso significativo (P < 0.05) de la germinación a las 24 h (APC inhibió 100%, y AFE, 57.69%), aunque la inhibición casi desapareció a las 48 h (Tabla 3).
En relación con el efecto de los estándares de AFE y APC, probados solos y combinados, en el crecimiento de la radícula y el vástago de A. hybridus, se observó que el AFE usado individualmente inhibió (P < 0.05) el crecimiento de la radícula y el vástago de A. hybridus, en las concentraciones ensayadas; mientras que APC probado también en forma individual, únicamente lo inhibió a la concentración de 10-3 M. La combinación de ambos ácidos también resulta inhibitoria a esta misma concentración (Tabla 2).
Se identificaron dos ácidos fenólicos principales en el residuo seco del tallo del amaranto, ferúlico y p-cumárico, los cuáles no habían sido reportados previamente en este material. Inicialmente, un análisis fitoquímico preliminar basado en características cromogénicas, proporcionó pruebas positivas de la presencia de compuestos fenólicos. Los análisis por CCF preparativa revelaron señales de la presencia de ácidos fenólicos.
Los extractos acuosos y alcalinos crudos presentaron una concentración de 108 y 114 ppm (6.50 y 6.85 mg mL-1, respectivamente) de compuestos fenólicos, siendo significativamente diferentes (t = 0.0240); sin embargo, esta diferencia no tuvo efecto en los análisis de CCF, ya que los dos tipos de extractos mostraron las mismas cinco bandas, las que al ser comparadas con los estándares, tuvieron correspondencia con el APC (fracción 1) y el AFE (fracción 2), como compuestos principales en el sistema cromatográfico cloroformo: ácido acético (9:1). Las tres fracciones restantes no fueron identificadas, ya que se observaron muy tenues por fluorescencia UV y con muy baja sensibilidad al revelar las placas con diferentes reactivos cromogénicos, de los cuales, el reactivo de Gibss resultó más sensible a los compuestos señalados (Tabla 4). En un ensayo de germinación de 72 h, la fracción 1 inhibió 80% la germinación de A. hybridus; la fracción 2 inhibió 100%, mientras que las otras tres fracciones mostraron bajos porcentajes de inhibición (20%) (datos no publicados).
Las propiedades espectrales de las fracciones indicaron una λmax 310 nm para la fracción 1, y 325 nm para la fracción 2. Estos valores son muy similares a los reportados por otros autores: λmax 310 nm para APC y 324 nm para AFE [19]; 307 nm para APC y 321 nm para AFE [20].
El análisis por CLAR de estos dos ácidos fenólicos se hizo de acuerdo a su tiempo de retención (Tr) en minutos, comparado con el de los estándares. El Tr para el estándar APC fue 9.645, y el de AFE fue 10.053. Las fracciones 1 y 2 obtenidas del extracto alcalino, mezcladas con sus respectivos estándares, mostraron picos bien definidos con un Tr de 9.591 y 10.201, respectivamente. Las mismas dos fracciones pero obtenidas del extracto acuoso, tuvieron los mismos Tr .
El espectro de RMN-1H confirmó la presencia de APC y AFE. Las estructuras se muestran en la figura 1.

Hasta ahora, sólo se han estudiado los compuestos volátiles de las partes aéreas de A. hypochondriacus, tales como alcoholes, aldehídos, ésteres, hidrocarburos, cetonas y un grupo misceláneo de compuestos [7]. No existían reportes del AFE ni del APC para A. hypochondriacus. El presente trabajo constituye el primer reporte de la presencia de estos ácidos en esta especie de amaranto. Estos compuestos son derivados del ácido cinámico y se forman a partir del aminoácido aromático fenilalanina, a través de la ruta del ácido shikímico, y han sido implicados en algunos casos de alelopatía [21,22]. Entre los ácidos fenólicos más comunes en las plantas, se encuentran los ácidos clorogénico, p-cumárico, ferúlico y cafeico [22]. Se ha reportado ácido ferúlico, p-cumárico, siríngico, vainíllico y p-hidroxibenzoico en residuos de maíz, avena, trigo y sorgo [23]. También se indica que los ácidos ferúlico y p-cumárico se encuentran en las inflorescencias de caña de azúcar [24]. Además, los ácidos ferúlico y p-cumárico han sido identificados en los lixiviados fitotóxicos de hojas de Eucalyptus camaldulensis [25].
En relación con el efecto del extracto acuoso del tallo seco y los dos ácidos fenólicos, AFE y APC, en el ensayo de germinación, debemos considerar que la concentración de los fenólicos totales en el extracto acuoso es menor que la de los estándares de los ácidos utilizados; por lo tanto, es lógico pensar que el extracto acuoso posee más compuestos bioactivos, ya que cuando están combinados puede existir una actividad sinergística entre compuestos a muy bajas concentraciones, tal como señalan algunos autores, quienes encontraron inhibición de la germinación de tomate, cebolla y zanahoria con 2-heptanona y (±) 2-heptanol, probados individualmente a concentraciones tan bajas como 1 ppm [6]. Se ha mostrado que cantidades aparentemente insignificantes de los fenólicos individuales llegan a ser relevantes cuando demuestran su capacidad sinergística [26]. En la rizosfera, este fenómeno es de considerable importancia en la germinación de semillas y crecimiento de plantas, y puede afectar el rendimiento de los cultivos [26]. Además de lo anterior, los compuestos volátiles emitidos por A. hypochondriacus también podrían estar influyendo en la germinación, pues se ha mencionado que, en su mayoría, inhiben significativamente la germinación de cebolla, zanahoria y tomate (significancia > 90 % de inhibición, con 8.6 × 10-5 mol de cada compuesto volátil auténtico) [7]. Así mismo, 2-heptanona y (±) 2-heptanol presentes en A. palmeri, inhibieron la germinación de algunas especies de maleza, tales como Capsella bursapastoris y Portulaca oleracea, entre otras, a concentraciones de 68.8 µM [27]. Otros autores han analizado el efecto de varias metil cetonas [28], 3-pentanona y ocho alcoholes alifáticos de bajo peso molecular, identificados en las mezclas de volátiles liberados por A. palmeri, en la germinación de cebolla, zanahoria y tomate, la cuál fue inhibida significativamente por dichos compuestos; el grado de inhibición dependió de la especie de prueba, el tiempo de exposición a los compuestos volátiles y su concentración [27]. Desde este punto de vista, la presencia de AFE y APC en A. hypochondriacus puede ser determinante en la actividad alelopática sinergística que esta especie posee. Esto concuerda con lo que señalan otros autores al afirmar que la xanthotoxina puede estar actuando de manera sinergística con otros aceites esenciales en la actividad alelopática de la ruda (Ruta graveolens) [29].
En el presente trabajo, la concentración 10-3 M de ácidos fenólicos individuales y la combinación de ambos, inhibieron significativamente la elongación tanto de la radícula como del vástago de A. hybridus, comparadas con las otras concentraciones y los testigos (Tabla 2). Sin embargo, la concentración 10-3 M de los ácidos individuales y combinados sólo tiene un efecto temporal de retraso sobre la germinación. Desde este punto de vista, los ácidos fenólicos tendrían diferentes mecanismos de acción sobre la germinación versus crecimiento [26]. Además, se han reportado los efectos de seis compuestos fenólicos presentes en pimienta (ácidos ferúlico, gálico, p-cumárico, p-hidroxibenzoico, vainíllico y vainillina) sobre la germinación de seis especies de maleza, donde la concentración más alta (10-2 M) tuvo el mayor efecto inhibitorio de la germinación de todas las especies, y las concentraciones más bajas (10-3, 10-4 y 10-5) no tuvieron efecto o fueron estimulantes. No obstante, de manera general, los ácidos fenólicos afectaron más el crecimiento de las plántulas que la germinación de las semillas; además, este autor hace notar que la mezcla de los seis ácidos fenólicos no fue, en un análisis global, más inhibitoria que los ácidos individuales [30]. Al contrario, otros autores reportaron que la combinación de ácidos ferúlico, p-cumárico y vainíllico causaron niveles de inhibición más altos en semillas de sorgo que los compuestos individuales, señalando esto como una evidencia de actividad sinergística [26]. Cuando estos autores utilizan 3.3 × 10-3 M de AFE y APC individuales y la combinación de ambos, los porcentajes de inhibición de la germinación de sorgo fueron menores durante las primeras 48 h, comparados con la inhibición causada por la mezcla de AFE + APC a una concentración de 10-3 M en A. hybridus, obtenida en el presente trabajo. Así mismo, dichos autores reportan que esa concentración inhibió significativamente el crecimiento del vástago. Lo anterior muestra que el efecto de los compuestos depende de factores tales como especie de prueba, concentración y/o combinación del compuesto y de otras situaciones específicas, por ejemplo, algunas interacciones bióticas, en particular, la competencia [23, 30].
Se observó que AFE y APC son dos compuestos importantes en el residuo seco del tallo del amaranto, en relación con la inhibición producida por el extracto acuoso sobre el crecimiento de A. hybridus, sin descartar la posible influencia sinergística de otras sustancias, por lo que se necesita más evidencia experimental para demostrar en qué grado están afectando las otras fracciones no identificadas.
A. hypochondriacus es una especie importante como productora de grano y no ha sido ampliamente investigada desde el punto de vista de sus propiedades alelopáticas; esto sería muy relevante en relación con el manejo de maleza y cultivo. Con un correcto manejo de su aplicación en campo, los residuos de la cosecha anterior ayudarían a suprimir, durante un tiempo determinado, el desarrollo de maleza sin efecto residual para los cultivos como lo han experimentado algunos autores utilizando residuos de girasol (Escalante y Rodríguez, comunicación personal). De esta manera, con los resultados presentados aquí y los reportes de otros autores, se podría ayudar a explicar algunos aspectos fundamentales de la actividad alelopática de los residuos de algunas especies de amaranto en el campo [6].
Parte experimental
Material vegetal. Se utilizó el tallo seco y molido del residuo de A. hypochondriacus L. var. Azteca, cosecha del ciclo 2000. El material fue secado en invernadero y almacenado posteriormente en bolsas de papel de plástico, las cuales fueron conservadas a temperatura ambiente. Dicho material fue proporcionado por el Área de Ecofisiología de Cultivos de la Especialidad de Postgrado en Botánica del Colegio de Postgraduados, Montecillo México. La estación experimental donde se realizó el presente estudio, está ubicada a 19°29' N y 98°54' O, a una altitud de 2250, y tiene una temperatura anual promedio de 15 °C y un promedio de precipitación pluvial de 558.5mm [31].
Extracto acuoso e hidrólisis alcalina. Los ácidos fenólicos se encuentran en forma conjugada en las plantas, por lo que se procedió a hacer tratamientos de hidrólisis al material vegetal para separarlos. Se preparó extracto acuoso (con H2O destilada) del material vegetal en proporción 1:2.5 (v/v), agitando durante 20 h y posteriormente filtrando. Para la hidrólisis, se siguió la técnica de Guenzi y McCalla para ácidos fenólicos [23]. El extracto se alcalinizó con NaOH 2N, se llevó a pH 12, se dejó en este medio durante 15 min y se acidificó con HCl 0.5N a pH 2; esta solución se extrajo tres veces con 20 mL de acetato de etilo, recuperándose la fase orgánica. A esta fase se le añadió NaHCO3 al 5% y se llevó a un pH 8; se recuperó la fase acuosa, la cual se aciduló con HCl a pH 2; dicha solución se extrajo tres veces con acetato de etilo y se recuperó finalmente la fase orgánica; a ésta se le añadió sulfato de sodio anhidro (Na2SO4) para eliminar el agua residual. Este procedimiento proporcionó un extracto orgánico con ácidos fenólicos libres, el cual se concentró en el rotaevaporador.
Extracto alcalino (hidrólisis alcalina directa). Con la misma proporción v/v que el extracto acuoso, se prepararon extractos alcalinos con NaOH 1% (hidrólisis alcalina directa), agitándose durante 1 h. El extracto crudo alcalino se acidificó con HCl 2N a pH 2; la solución se extrajo tres veces con acetato de etilo y se recuperó la fase orgánica, la que se concentró en rotaevaporador.
A los extractos acuoso y alcalino crudos se les determinó la presencia de fenólicos totales [32]. Al observar que la CCF donde se usó extracto derivado de la hidrólisis alcalina directa, proporcionó el mismo número de fracciones que cuando se usó el extracto acuoso hidrolizado, se utilizó el primero para los propósitos de identificación de los compuestos por CCF, CLAR y RMN-1H, mientras que el extracto acuoso crudo fue usado para los ensayos de geminación.
Ensayos de germinación con extracto acuoso de A. hypochondriacus y los ácidos ferúlico y p-cumárico. Se utilizó A. hybridus como especie de prueba de maleza para analizar la actividad biológica del extracto acuoso crudo del residuo seco del tallo del amaranto, porque se ha visto que esta especie es un serio problema en diferentes cultivos de la zona de estudio, y en muchos casos es la más abundante y la de mayor biomasa. Con base en el análisis de los ácidos fenólicos totales, el extracto acuoso crudo fue usado en concentraciones de 108, 54, 27, 13.5, 6.75, 3.38, 1.69 y 0.84 ppm. El pH se mantuvo estable en todas las concentraciones (6.56). Para comparar la actividad de los ácidos fenólicos principales presentes en el extracto acuoso, se utilizaron estándares de APC y AFE en concentraciones de 10-3, 10-4 y 10-5 M de cada uno, así como la combinación de ambos (1:1) para observar su efecto en la germinación de A. hybridus.
Los ensayos de germinación se realizaron en cajas Petri con cuatro divisiones (cada división actuó como una repetición del tratamiento), usando papel filtro Whatman # 1; se aplicó 1.1 mL del respectivo tratamiento y se colocaron 10 semillas en cada división [33]. Las cajas se incubaron en una cámara de crecimiento Freas 815 Low Temperature Incubator, PS GCA Corporation, a 25 ± 1 °C, en oscuridad, por 72 h. Al final del experimento, se evaluó el porcentaje de inhibición o estimulación de la germinación y la longitud del vástago y la radícula.
Identificación de ácidos fenólicos. Análisis por CCF.
Varios ácidos aromáticos, aldehídos y compuestos fenólicos relacionados, han sido implicados en relaciones alelopáticas; en particular, los compuestos derivados del ácido benzoico y cinámico, han sido aislados de un amplio grupo de especies de vegetales [22]. Por lo anterior, y por los resultados obtenidos en el análisis fitoquímico preliminar, para la identificación mediante CCF de los probables ácidos fenólicos presentes en el tallo de amaranto, se usaron estándares derivados del ácido hidroxibenzoico (ácidos: siríngico, salicílico, vainíllico, 2,5-dihidroxibenzoico, p-hidroxibenzoico, 2,3-dihidroxibenzoico, 2,4-dihidroxibenzoico y 3,4-dihidroxibenzoico); y del ácido cinámico (cafeico, cinámico, p-cumárico, sinápico, o-cumárico, ferúlico y clorogénico). Se tomaron en consideración los valores de Rf, fluorescencia UV y sensibilidad de color a reactivos cromogénicos (Gibss). Mediante raspado de bandas de las placas en escala semipreparativa y su posterior filtración, se obtuvieron fracciones puras de ácidos fenólicos para analizar sus valores espectrales de UV, y su posterior identificación por CLAR y RMN-1H.
Análisis por CLAR. Se utilizó un equipo GBC, bomba LC 1150 HPLC con un detector LC 1210 UV/VIS y Software WinchromTM, versión 1.3. La columna empleada fue una SGE C8 (250 mm de longitud, 4.6 mm de diámetro y 5µm). Los estándares de ácidos fenólicos (AFE y APC) fueron de la marca SIGMA (Sigma Chem. Co. St. Louis MO). La bomba se trabajó en forma de gradiente, y se utilizó una fase móvil de agua-acetonitrilo 87:13, 87:13 y 70:30, respectivamente, a una velocidad de flujo de 1 mL min-1; la detección se hizo a 326 nm y a una temperatura de 40 °C.
Análisis por RMN 1H. Las muestras se disolvieron en CDCl3 + DMSO-d6 y se usó TMS como referencia. Se corrieron en un espectrómetro marca Varian-Unity a 300 MHz.
Análisis estadístico. Los datos se analizaron a partir del modelo de un diseño completamente al azar, mediante un análisis de varianza. Las diferencias entre tratamientos se establecieron mediante una prueba de Tukey.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología por el financiamiento otorgado para los estudios doctorales de O.T.-S. Al M. C. René Díaz Serrano por sus sugerencias en el análisis de los compuestos fenólicos y al Dr. Arturo Galvis Spinola por las facilidades brindadas para la utilización del CLAR.
Referencias
1. Stallknecht, G. F.; Schulz-Schaeffer, J. R., in: New Crops, Janick, J. and Simon, J. E., Eds., Wiley, New York, 1993, 211-218. [ Links ]
2. National Academy of Sciences. Amaranth: Modern Prospects for an Ancient Crop. National Academic Press, Washington, D. C., 1984, 39-40. [ Links ]
3. Mapes, C.; Basurto, F.; Bye, R. Economic Botany 1997, 51, 293-306. [ Links ]
4. Vieyra, O. L.; Vibrans, H. Economic Botany 2001, 55, 426-443. [ Links ]
5. Bradow, J. M.; Connick, W. J. J. Chem. Ecol. 1987, 13, 185-202. [ Links ]
6. Connick, W. J.; Bradow, J. M.; Legendre, M. G.; Vail, S. L.; Menges, R. M. J. Chem. Ecol. 1987, 13, 463-472. [ Links ]
7. Connick, W. J.; Bradow, J. M.; Legendre, M. G. J. Agric. Food Chem. 1989, 37, 792-796. [ Links ]
8. Fischer, N. H.; Quijano, L., in: The Chemistry of Allelopathy, Biochemical Interactions Among Plants. Thompson, A. C., Ed., American Chemical Society, Washington, D. C., 1985, 133-147. [ Links ]
9. Dailey, O. D.; Severson, R. F.; Arrendale, R. F. J. Agric. Food Chem. 1997, 45, 3914-3920. [ Links ]
10. Duke, S. O.; Dayan, F. E.; Rimando, A. M.; Schrader, K. K.; Aliotta, G.; Oliva, A.; Romagni, J.G. Weed Sci. 2002, 50, 138-151. [ Links ]
11. Rice, E. L. Allelopathy, Academic Press, New York, 1984, 8-73. [ Links ]
12. Einhellig, F. A.; Rasmussen, J. A. J. Chem. Ecol. 1989, 19, 369-375. [ Links ]
13. Masiunas, J. B.; Weston, L. A.; Weller, S. C. Weed Sci. 1995. 43, 318-323. [ Links ]
14. Galloway, B.; Weston, L. A. Weed Technol. 1996. 10, 341-346. [ Links ]
15. Tejeda, S. O.; Rodríguez, G. T.; Escalante, E. A. Revista Mexicana de la Ciencia de la Maleza. 2001, 1, 31-40. [ Links ]
16. Liu, D. L.; Christians, N. E.; Garbutt, J. T. J. Plant Growth Regul. 1994, 13, 221-226. [ Links ]
17. Liu, D. L.; Christians, N. E. J. Plant Growth Regul. 1994, 13, 227-230. [ Links ]
18. Vaughn, S. F.; Berhow, M. A. J. Chem. Ecol. 1998, 24, 1117-1126. [ Links ]
19. Harborne, J. B. Phytochemical Methods, Chapman and Hall, London, 1984, 37-55. [ Links ]
20. Tüzen, M.; Özdemir, M. Turk J. Chem. 2003, 27, 49-54. [ Links ]
21. Duke, S. O., in: The Chemistry of Allelopathy, Biochemical Interactions Among Plants. Thompson, A. C., Ed., American Chemical Society, Washington, D. C., 1985, 113-131. [ Links ]
22. Putnam, A. R., in: Weed Physiology, Vol. I, Duke, S. O., Ed., CRC Press, USA, 1985, 131-155. [ Links ]
23. Guenzi, W. D.; McCalla, T. M. Agron. J. 1966, 58, 303-304. [ Links ]
24. Battle, J. P.; Whittington, W. J. J. Agr. Sci. 1969, 73, 337-346. [ Links ]
25. Del Moral, R.; Muller, C. H. Amer. Midl. Natur. 1970, 83, 254-282. [ Links ]
26. Rasmussen, J. A.; Einhellig, F. A. Plant Science Letters 1979, 14, 69-74. [ Links ]
27. Bradow, J. M.; Connick, W. J. J. Chem. Ecol. 1988, 14, 1633-1648. [ Links ]
28. Bradow, J. M.; Connick, W. J. J. Chem. Ecol. 1988, 14, 1617-1631. [ Links ]
29. De Feo, V.; De Simone, F.; Senatore, F. Phytochemistry 2002. 61, 573-578. [ Links ]
30. Reigosa, M. J.; Souto, X. C.; González, L. J. Plant Growth Regul. 1999, 28, 83-88. [ Links ]
31. García, E. Modificaciones al Sistema de Clasificación Climática de Köppen, Offset Larios, Universidad Nacional Autónoma de México, México, 1988, pp 137. [ Links ]
32. Swain, T; Hillis, W. E. J. Sci. Food Agric. 1959, 10, 63-68. [ Links ]
33. Larqué, S. A.; Rodríguez, G. T. Fisiología Vegetal Experimental, Trillas, México, 1993, 71-73. [ Links ]














