Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.1 Ciudad de México ene./mar. 2004
Comunicación técnica
Desarrollo de un sistema sensor para la cuantificación de glucosa en jugos de frutas
Adriana Noemí Ángeles Cañas, Ma. del Pilar Cañizares Macías*
Departamento de Química Analítica, Facultad de Química, Universidad Nacional Autónoma de México, Ciudad Universitaria 04510, México D.F., México. Tel: 56-22-37-88, fax: 56-22-37-23. E-mail: pilarm@servidor.unam.mx
Recibido el 11 de noviembre del 2003.
Aceptado el 17 de marzo del 2004.
Resumen
En este trabajo se propone un sistema sensor para la determinación de glucosa en jugos de fruta utilizando un reactor enzimático empacado con la enzima glucosa oxidasa inmovilizada. La determinación se basa en una serie de reacciones que ocurren en diferentes zonas de la configuración secuencialmente: 1) oxidación de la glucosa, por medio de la enzima glucosa oxidasa inmovilizada, para formar H2O2, 2) reacción del H2O2 con el ion yoduro para formar yodo y, 3) formación del ion triyoduro que se mide a 353 nm. El intervalo lineal encontrado fue 0.038 -6.66 mM, el límite de detección 0.014 mM y la precisión 1.4 %. El método se aplicó a jugos de fruta donde el pretratamiento fue una dilución 1:100 y la adición de KIO3 para eliminar la interferencia de ácido ascórbico.
Palabras claves: Sistema sensor; glucosa; glucosa oxidasa inmovilizada; jugos de fruta.
Abstract
A sensor system for the determination of glucose in fruit juices using an enzymatic reactor packed with the immobilized glucose oxidase enzyme is proposed. The determination is based in a series of reactions, which area carried out sequentially in different places of the manifold: 1) oxidation of the glucose, by means of immobilized glucose oxidase, to form H2O2, 2) reaction between H2O2 and the iodide ion to form iodine and 3) development of the triiodide which is measured at 353 nm. The lineal range was 0.038-6.66 mM, detection limit 0.014 mM and the precision 1.4 %. The method was applied to fruit juices where the pretreatment of the samples was a 1:100 dilution and the addition of KIO3 to eliminate the ascorbic acid interference.
Keywords: Sensor system; glucose; immobilized glucose oxidase; fruit juices.
Introducción
En la actualidad la tendencia de la Química Analítica va encaminada al desarrollo de sistemas que permitan análisis rápidos y económicos pero sin disminuir la precisión. Para lograr estos objetivos los métodos continuos son una magnífica opción ya que permite miniaturizar y automatizar muchos de los análisis que actualmente se llevan a cabo en la industria alimentaria. Entre estos métodos se encuentra el Análisis por Inyección en Flujo (FIA). Los sistemas analíticos de flujo continuo también se les conoce como sistemas sensores y se diferencian de los sensores en flujo en que en estos últimos las etapas de separación, reacción y detección ocurren en el mismo tiempo y espacio mientras que en los sistemas sensores se llevan a cabo en diferentes zonas pero son secuenciales [1]. Los sistemas sensores permiten que se puedan realizar determinaciones en continuo acoplando diferentes dispositivos a lo largo de la configuración tales como: cámaras de pervaporación [2], celdas de difusión [3,4] y de diálisis [5] reactores empacados con resinas que permitan la preconcentración de los analitos [6], cámaras especiales para la extracción líquido-líquido [7] o la incorporación de reactores enzimáticos donde la enzima se encuentra inmovilizada en diferentes soportes [8,9].
En los laboratorios de análisis de alimentos el método más común para cuantificar glucosa se basa en el poder reductor de ésta: utilizando el reactivo de Fehling la glucosa reduce el Cu(II) del tartrato cúprico en Cu(I) que se convierte a óxido cuproso insoluble al calentarse a ebullición con una disolución del azúcar reductor [10]. Esta metodología es poco precisa ya que se trata de una titulación donde el punto de equivalencia se observa con el precipitado formado y reaccionan todos los azúcares reductores.
Es así, que se han desarrollado metodologías más precisas que permiten determinar glucosa en alimentos pero donde la preparación de la muestra requiere de varias etapas: a) cromatografía de líquidos de alta eficiencia (HPLC) [11], b) detección por infrarrojo [12], c) fluorimetría [13] y d) determinación enzimática con detección colorimétrica [14,15]. Las ventajas de los métodos enzimáticos sobre los demás es la gran selectividad por la glucosa cuando se utiliza la enzima glucosa oxidasa, aunque se debe resaltar el aumento de costos en la determinación cuando el análisis se realiza con la enzima en disolución. Para bajar estos costos y poder reutilizar la enzima durante varios análisis se han desarrollado varios métodos de inmovilización (en vidrio de poro controlado y unión covalente con glutaraldehído, enlace iónico en resinas intercambiadoras como la carboximetil o enlace con metales para la formación de quelatos [16]. La enzima inmovilizada en un soporte sólido permite la fabricación de microcolumas que se pueden acoplar a sistemas de flujo continuo disminuyendo aun más los costos sin pérdida de la selectividad y de la precisión.
Considerando la especificidad que brindan las enzimas y las ventajas que presenta un sistema en continuo como es el Análisis por Inyección en Flujo, se han realizado trabajos adaptando a este sistema diferentes tipos de detectores y diferentes métodos de inmovilización de la enzima glucosa oxidasa [17]. Todos estos métodos han demostrado su magnífica precisión, cercana al 2 %, pero requieren de: reactivos más caros como la o-dianisidina y una segunda enzima como la peroxidasa [18], dispositivos especiales como biosensores [19], fibras ópticas [20] o cámaras de diálisis [21].
En este trabajo se propone un método rápido y preciso para determinar glucosa en jugos de fruta acoplando un reactor enzimático, empacado con la enzima glucosa oxidasa, al sistema sensor y donde, posterior a la reacción enzimática, solo es necesario el KI para la reacción de cuantificación.
Parte Experimental
Reactivos y disoluciones. Todos los reactivos utilizados para este trabajo fueron grado analítico. Se utilizó la enzima Glucosa Oxidasa, G.O., (EC 1.1.3.4; 6000 u/g sólido de Aspergillus níger) de Sigma y vidrio de poro controlado (CP 240-200, malla 120-200, diámetro de poro 242 Å, también de Sigma.
Para la inmovilización de la enzima en el vidrio de poro controlado (CPG) se prepararon las siguientes disoluciones:
a) Disolución silanizante: 5 mL de 3-aminopropilsilano (Aldrich 99 %) se disolvieron en 45 mL de una disolución amortiguadora de acetatos pH 5 y 0.05 M.
b) Disolución de glutaraldehido: se preparó tomando una alícuota de 25 mL de glutaraldehído grado II al 25 % (Sigma) y diluyendo con 50 mL de una disolución amortiguadora de fosfatos pH 8.5, 0.1 M.
Para preparar la disolución del portador se pesó 0.8306 g de yoduro de potasio (Baker) y 0.0125 g de molibdato de amonio (Sigma) disolviéndolos en 250 mL de una disolución amortiguadora de fosfatos pH 6 y 0.1 M. La disolución madre de glucosa (11.11 mM) se preparó disolviendo 0.2 g de D-glucosa (Baker) en 100 mL de agua destilada. De esta disolución de glucosa se prepararon los estándares para la curva patrón.
Instrumentos. Se utilizó una bomba peristáltica con cabezal de cuatro canales, Gilson Minipuls 3, una válvula de inyección, Rheodine, y tubos de teflón de 0.8 mm de d.i para armar el sistema sensor. Para la detección se utilizó un espectrofotómetro UV-VIS Cary 3, Varian. También se utilizó un potenciómetro para medir pH, Oakton, y una balanza analítica con precisión de ± 0.1 mg marca Ohaus.
Metodología
Fundamento de la reacción para determinar glucosa
La glucosa se oxida por medio de la enzima glucosa oxidasa para formar ácido glucónico y peróxido de hidrógeno. El peróxido de hidrógeno formado reacciona con el ion yoduro que forma yodo. El yoduro, que se encuentra en exceso, forma junto con el I2 el ion triyoduro cuya señal es proporcional a la concentración de peróxido de hidrógeno y que se mide espectrofotométricamente a 353 nm. La concentración de peróxido de hidrógeno corresponde a la concentración de glucosa presente en la muestra.
La secuencia de las reacciones es la siguiente:
1) Glucosa + O2 ⇌ ácido glucónico + H2O2
2) H2O2 + I- ⇌ I2
3) I2 + I- ⇌ I3.
Inmovilización de la enzima G.O. en CPG
La inmovilización de la enzima se realizó utilizando el método propuesto por Masoom y Townshend [22, 23]:
A) Limpieza del vidrio: Se pesaron 2.0002 g de CPG y se le adicionaron 50 mL de HNO3 al 5 %. Se calentó a ebullición por 30 min. Transcurrido este tiempo se filtró, se lavó y se secó a 95 °C.
B) Activación del vidrio: B.1. Se adicionó la disolución silanizante al CPG y se calentó a 90 °C con agitación constante durante 2 horas. Al terminar el tiempo se filtró, se lavó con agua destilada y se secó a 95 °C. B.2. Se tomó una alícuota de 15 mL de la disolución de glutaraldehido y se agregaron al vidrio silanizado. Se agitó esta mezcla durante una hora a temperatura ambiente. Finalmente se lavó con agua destilada y se filtró.
C) Inmovilización de la enzima: Se pesaron 0.5000 g de CPG preparado y se le adicionaron 6 mL de disolución amortiguadora de fosfatos (0.1 M, pH 7.0). Se mezclaron con 0.2494 g de la enzima G.O y se colocó en un baño de hielo con agitación eventual por dos días. Al final de este tiempo se lavó con el amortiguador de fosfatos y se almacenó a 4 °C en disolución amortiguadora de fosfatos 100 mM de pH 7.0.
Sistema sensor
En la figura 1 se muestra la configuración de flujo continuo para obtener el sistema sensor y determinar la glucosa. La muestra con la glucosa se inyecta por medio de la válvula VI dentro del portador. A lo largo del reactor enzimático, RE, se lleva a cabo la reacción enzimática y al mismo tiempo la oxidación del I- a I2 por el H2O2 que se formó de la reacción de la G.O. con glucosa. A lo largo del reactor r1 se termina de formar el ion I3- que se mide a 353 nm y cuya señal es proporcional a la concentración de glucosa en la muestra. El reactor enzimático se mantiene dentro de un baño de agua a 40 °C. Las reacciones y la detección ocurren en diferentes etapas y por lo tanto secuencialmente a lo largo del sistema.

La configuración de flujo continuo utilizada favorece la formación del ion I3- ya que la reacción enzimática ocurre al mismo tiempo que la del H2O2 con el I- que se encuentra en disolución. Además, el producto de esta reacción, I2, reacciona con el I- en exceso ocasionando que el equilibrio se desplace hacia la formación de productos en todas las reacciones que se llevan a cabo a lo largo del sistema. Así, es posible que la determinación de glucosa sea más sensible y en menor tiempo.
Resultados y discusión
Estudio de optimización
La optimización del sistema sensor abarcó el estudio de una serie de variables agrupadas en aquellas características del reactor enzimático y las químicas, físicas y propias del sistema dinámico. Para este estudio se utilizó una concentración de glucosa 4 mM.
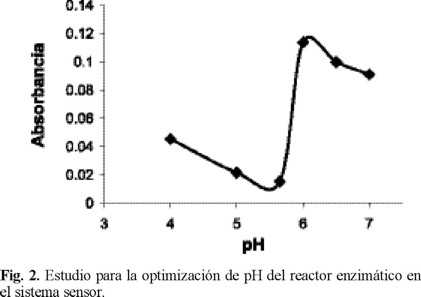
Optimización de las variables del reactor enzimático. La concentración y el pH del amortiguador en el portador tuvieron gran influencia tanto en la estabilidad de la enzima como en su actividad. Se estudiaron varias concentraciones de disolución amortiguadora de fosfatos de 0.01 a 0.3 M y diferente pH cuyos valores fueron entre 4.0 y 7.0. Por debajo de 0.1 M las señales analíticas eran más bajas que a concentraciones más altas, pero a concentraciones mayores de 0.1 M la señal obtenida no tenía cambios significativos por lo que se eligió esta concentración como óptima. Con respecto al pH, la figura 2 muestra los resultados obtenidos para cada valor estudiado. Se puede observar que a un pH de 6.0 la señal analítica es la más alta y por lo tanto el pH óptimo. A pH's menores y mayores la enzima tiene menor actividad.
La temperatura también es un factor muy importante en la actividad de la enzima G.O. El incremento en la temperatura tuvo un efecto favorable en la señal analítica, pero por encima de 40 °C la señal no aumentó y a 60 °C la señal se vio drásticamente disminuida quizás por la desnaturalización del biocatalizador. Por lo que se eligió 40 °C como óptima.
La longitud del reactor enzimático se seleccionó de acuerdo a la cantidad de enzima empacada. Se observó que con tan solo 17.3 mg de enzima inmovilizada las señales obtenidas eran igual que si se empacaba mayor cantidad de enzima. La longitud del reactor, elaborado con tubo de teflón, fue de 1cm con 2 mm de d.i. con lo que se disminuye la dispersión de las muestras.
Optimización de las variables, químicas, físicas y del sistema dinámico. Para la selección de la longitud de onda se corrió el espectro de absorción del ion triyoduro teniendo dos máximos de absorción a 286 y 353 nm. Aunque la señal a 286 nm es mucho mayor que a 353 nm se seleccionó esta última debido a que las muestras de jugos presentan interferencias a 286 nm. Como la señal obtenida a 353 nm era muy pequeña se decidió utilizar molibdato de amonio debido a que éste es un catalizador en la formación del triyoduro en presencia de H2O2. Se estudiaron varias concentraciones de molibdato de amonio (entre 0.001 y 0.05 %) en la disolución portadora. La señal analítica aumentaba conforme aumentaba la concentración de molibdato de amonio pero después de 0.005 % la señal obtenida se mantenía constante, por lo que se seleccionó este valor como óptimo. La sensibilidad de la determinación utilizando molibdato de amonio con una concentración de tan solo el 0.005 % aumentó 5 veces.
La concentración del KI en el portador se eligió para asegurar la reacción con el H2O2 y la formación del I3-. El H2O2, formado de la reacción enzimática, oxida al I- presente en el portador, y para formar el ion I3- es necesario un exceso de I-en la disolución. Para asegurar esto se eligió una concentración de 0.1 M de KI en el portador.
La longitud del reactor r1 se optimizó con la finalidad de aumentar el tiempo de reacción y favorecer la formación de I3-pero que la dispersión física fuera lo menor posible. Se realizó un estudio entre 100 y 400 cm, siendo el óptimo 200 cm. A longitudes mayores la señal analítica no aumentaba considerablemente y el tiempo de análisis era mucho más largo.
Para el volumen de inyección se estableció el del bucle de la válvula de inyección que fue de 100 µL ya que a volúmenes mayores se obtenían picos dobles.
Características del método
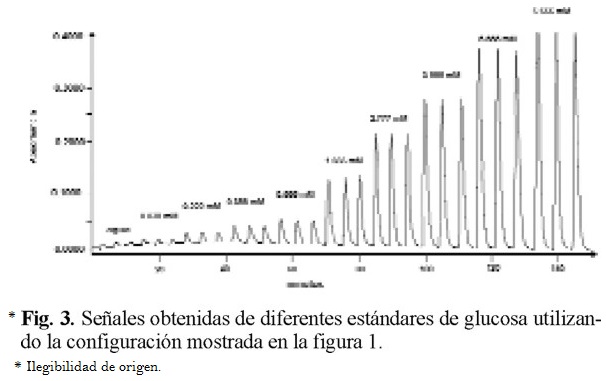
Una serie de disoluciones patrón cuyo intervalo de concentraciones se encontraba entre 0.02 a 10.0 mM se inyectaron por triplicado dentro del sistema sensor. La ecuación del intervalo lineal, entre 0.038 y 6.66 mM, fue Y = 0.0573X + 0.0065 (r = 0.9997), donde Y es la absorbancia y X es la concentración de glucosa en mM. Las señales obtenidas para cada estándar se muestran en la figura 3, donde cada pico corresponde a una concentración de glucosa inyectada. La precisión que proporciona el método se estudio utilizando 7 muestras de con una concentración 2.22 mM inyectadas por triplicado. Este parámetro expresado como por ciento de desviación estándar relativa fue de 1.4 %. El límite de detección fue de 0.014 mM y la frecuencia de muestreo de 14 determinaciones por hora.
Aplicación del método propuesto
El método se aplicó a la determinación de glucosa en jugos de fruta y bebidas refrescantes.
En este tipo de muestras existe una concentración apreciable de ácido ascórbico que se les añade como conservante o que por naturaleza ya tiene la muestra, como es el caso de los jugos. El ácido ascórbico es un interferente en este tipo de análisis ya que tiene un potencial de reducción muy pequeño por lo que reacciona con el H2O2 antes de que el I- provocando que la señal analítica disminuya. Para eliminar esta interferencia se utilizó KIO3 que es capaz de oxidar al ácido ascórbico al pH en la que ocurre la reacción enzimática (pH 6) produciendo yoduro que se encuentra en el portador. La concentración de KIO3 que se utilizó fue de 0.0283 M y se adicionó a las muestras diluidas 15 minutos antes de su análisis para asegurar que todo el ácido ascórbico había sido oxidado. Las muestras se diluyeron en la misma disolución amortiguadora de fosfatos pH 6 que se utiliza para el portador. La dilución fue 1:100.
Las muestras se inyectaron por triplicado y se calculó la media y la desviación estándar relativa para cada una de ellas. La concentración de glucosa se expresó en g/100 g de muestra. La recuperación, expresada como porcentaje, para dos concentraciones de glucosa (0.99 mM y 2.35 mM), se encontró en el intervalo entre 95.4 y 104.2 %, la cual acredita el excelente funcionamiento del reactor enzimático y del sistema sensor. En la Tabla 1 se muestran los resultados obtenidos.
Conclusiones
Se ha desarrollado un sistema sensor para determinar glucosa basado en la reacción simultánea de la enzima glucosa oxidasa con la glucosa y el KI con el producto de la reacción enzimática.
El método propuesto permite determinar glucosa en muestras complejas como los jugos sin que se necesite un pretratamiento de la muestra largo y laborioso, disminuyendo de este modo los errores. Otra gran ventaja de este método es que tampoco se requiere filtrar la muestra como ocurre en otros métodos de flujo continuo.
La acción enzimática dota al método con la característica de selectividad de las reacciones biocatalizadas además de que al estar inmovilizada la enzima es posible realizar varios análisis con el mismo reactor. El número de determinaciones que se realizaron con el mismo reactor fue de 120 determinaciones continuas sin pérdida de la actividad. Por otra parte, un mismo reactor enzimático, una vez optimizada todas las variables del método, se utilizó en los análisis posteriores por lo que se puede estimar una vida útil de por lo menos 4 meses.
El sistema sensor propuesto puede ser aplicado, en principio, a otro tipo de muestras donde se requiera analizar glucosa (muestras farmacéuticas, de alimentos y clínicas).
Referencias
1. Valcárcel, M.; Luque de Castro, M.D. Non.chromatograpic Continuous Separation Techniques, Royal Society of Chemistry, Oxford, 1991. [ Links ]
2. Cañizares Macías, M.P.; Luque de Castro, M.D. Talanta 1997, 357, 777. [ Links ]
3. Decnop Weever, L.G.; Kraak, J.C. Anal. Chim. Acta 1997, 337, 125. [ Links ]
4. António, O.S.S.; Rangel, Ildikó V. Tóth, Anal. Chim. Acta 2000, 416, 205. [ Links ]
5. Lenz, E.; Steve, T.; Craig, J. of Pharmac. and Biom. Anal., 2002, 27, 191. [ Links ]
6. Hali Shabani, A.; Dadfarnia, S.; Dehghan, K.; Talanta, 2003, 59, 719. [ Links ]
7. Alonso, A.; Almendral, M.J.; Báez, M.D.; Porras M.J.; López Lavín, F.; García de María, C. Anal. Chim. Acta 2000, 408, 129. [ Links ]
8. Becker, T. M.; Schmidt, M. L. Anal. Chim. Acta 2000, 421, 7. [ Links ]
9. Xie, B.; Danielsson, B. Anal. Lett., 1996, 29, 1921. [ Links ]
10. Official Methods of Analysis. A.O.A.C. 15a ed, 1990, 774. [ Links ]
11. Wei, Y.; Ding, M. J. Chromatogr. A., 2000, 904, 113. [ Links ]
12. Rambla, F.J.; Garrigues, S.; Guardia, M. Anal. Chim. Acta 1997, 344, 41. [ Links ]
13. Sierra, J.F.; Galvan, J.; Castillo, J. R. Anal. Chim. Acta 1998, 368, 97. [ Links ]
14. Boujtita, M.; Boitard, M. Biosensors and Bioelectronics, 1999, 14, 545. [ Links ]
15. Ukeda, H.; Fujita, Y. J. Agric. Food Chem. 1996, 44, 3858. [ Links ]
16. Kaplan, N. Methods in Enzymology. Immobilized Enzymes, Vol. 44, Klaus Mosbach, EEUU, 1976, 138-148. [ Links ]
17. Chang, S.; Holm, E. Anal Chem., 1995, 67, 12, 131R-150R. [ Links ]
18. Ukeda H.; Fujita Y. J. Agric. Food Chem. 1996, 44, 3858. [ Links ]
19. Ramanathan, K.; Jonsson, R.J.; Danielsson, B. Anal. Chim. Acta 2001, 427,1. [ Links ]
20. Dremel, B.; Schaffar, B. Anal. Chim. Acta 1989, 225, 293. [ Links ]
21. Centonze, D.; Zambonin, C. J. AOAC., 1997, 80, 4, 829. [ Links ]
22. Masoom M.; Townshend A. Anal. Chim. Acta 1984, 166, 111. [ Links ]
23. Masoom M.; Townshend A. Anal. Chim. Acta 1985, 171, 185. [ Links ]














