Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.1 Ciudad de México ene./mar. 2004
Investigación
Estudio comparativo de la reducción electrocatalítica de oxígeno sobre rutenio y su desempeño en una celda de combustible con membrana polimérica
Rosa de Guadalupe González-Huerta, Marco Antonio Leyva, Omar Solorza-Feria*
Departamento de Química, Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional. Av. IPN 2508, 07360 México D.F., México. Tel 5061 3715. E-mail: osolorza@mail.cinvestav.mx
Recibido el 20 de octubre del 2003.
Aceptado el 10 de febrero del 2004.
Resumen
Se presenta la obtención de rutenio de tamaño nanométrico por diferentes técnicas de preparación, para el estudio electrocatalítico de la reacción de reducción de oxígeno en medio ácido, utilizando la técnica de Electrodo de Disco Rotatorio (EDR). El comportamiento electroquímico de la reacción catódica fue superior con rutenio sintetizado de la pirólisis del Ru3(CO)12 en 1,6-hexanodiol, en comparación con rutenio electrodepositado y rutenio en polvo comercial (Strem malla 200). Se presenta también el desempeño del ensamble con la estructura membrana Nafion® 117-catalizadores (ánodo de Pt/cátodo de Rux), en una Celda de Combustible con Membrana de Intercambio Protónico (CCMIP), operando con hidrógeno y oxígeno.
Palabras clave: rutenio, reducción de oxígeno, celda de combustible MIP.
Abstract
Ruthenium in nanometer size, obtained by different technique of preparation and used as electrocatalyst for molecular oxygen reduction reaction in acidic medium was evaluated with a rotating disk electrode, RDE. It was found that the electrochemical behavior for the cathodic reaction of ruthenium synthesized by the pyrolysis of Ru3(CO)12 in 1,6-hexanediol gave a better catalytic activity in relation with electrodeposited and ruthenium (Strem-200 mesh) powder presentation. The performance of the structure membrane and electrode assembly, Nafion® 117-catalysts (anode of Pt/cathode of Ru) in a single Polymer Electrolyte Membrane Fuel Cell (PEMFC) operating with hydrogen and oxygen, is also presented.
Key words: ruthenium, oxygen reduction, PEM fuel cells.
Introducción
Con el incremento de la población mundial surgen más necesidades energéticas y se requiere de una búsqueda de alternativas para identificar y desarrollar tecnologías limpias en la generación y almacenamiento de la energía. Las celdas de combustible son dispositivos que convierten en forma directa la energía química de los reactantes (un combustible y un oxidante) en energía eléctrica. Muchas de las características operacionales de los sistemas de celdas de combustible son superiores a los de generación de potencia tradicional [1-6]. Entre los diferentes tipos de celdas de combustible, las celdas de combustible con membrana polimérica de intercambio protónico son las más desarrolladas para el autotransporte y en aplicaciones portátiles, debido principalmente a su alta densidad de potencia y a su relativa baja temperatura de operación. Una celda unitaria básica en una celda de combustible con membrana de intercambio protónico consiste de un Ensamble Membrana-Electrocatalizador (EME), que resulta ser el componente principal donde el hidrógeno y el oxígeno reaccionan electroquímicamente para generar una potencia eléctrica. El EME se encuentra localizado entre un par de colectores bipolares por donde fluyen los gases y que en su conjunto forman una monocelda de combustible. El EME consiste de una estructura de cinco capas en cuyo centro se encuentra una membrana de intercambio protónico que actúa como electrolito, que separa la estructura de los electrodos ánodo y cátodo, y que previene que los gases se mezclen. Cada electrodo consiste de un sustrato difusor de gases con una capa de electrocatalizador localizado entre la membrana y el sustrato. El electrocatalizador puede ser depositado, ya sea en los difusores de gases o en la membrana polimérica. El ácido perfluorosulfónico es la membrana más comúnmente utilizada para la preparación del EME. Una revisión reciente sobre este tema aparece en la referencia [7]. Los electrocatalizadores más activos utilizados hasta ahora son nanopartículas metálicas del grupo del platino y sus aleaciones [8-10], donde se genera la potencia eléctrica por las reacciones de oxidación del hidrógeno en el ánodo y la reducción del oxígeno en el cátodo. La reacción global en una celda de combustible con membrana de intercambio protónico esta controlada por la reacción catódica, por ser ésta cercana a cinco órdenes de magnitud más lenta que la reacción anódica, entre otras razones. La electrocatálisis de la reacción de reducción de oxígeno es de interés práctico y teórico. Los electrodos con materiales nanométricos han mostrado un alto desempeño para la reducción de oxígeno y esta alta actividad depende no solo del tamaño de las partículas, sino de la naturaleza del soporte y de los métodos de preparación. La síntesis y caracterización de nuevos materiales con alta y selectiva actividad catalítica para la reducción de oxígeno, han merecido un trabajo extensivo en las últimas décadas [11], debido a los elevados costos de los materiales con base en platino.
En este trabajo se presenta la síntesis y caracterización de rutenio de tamaño nanométrico, preparado por la pirólisis de Ru3(CO)12 en 1,6-hexanodiol (teb~220 °C a 585 mmHg) bajo condiciones de reflujo durante 2 h. Se presenta el estudio electroquímico con el fin de determinar la actividad catalítica de este material en 0.5 M H2SO4 y se compara con el rutenio en polvo comercial y el electrodepositado de un baño de cloruros a potencial constante. Se presenta además, el desempeño de este electrocatalizador utilizado como cátodo en una monocelda de combustible con membrana polimérica.
2. Parte Experimental
Preparación y caracterización de nanopartículas de rutenio
En estudios preliminares reportados por nuestro grupo de investigación [12-14], hemos demostrado que usando diferentes disolventes apróticos bajo condiciones de reflujo, se presenta la descarboxilación de compuestos organometálicos, formando compuestos de tamaño nanométrico. La síntesis de nanopartículas de rutenio se realizó descarboxilando el Ru3(CO)12 (Strem) en un matraz bola de vidrio (Pyrex®) conteniendo 100 ml de 1,6-hexanodiol (teb ~220 °C a 585 mmHg) bajo reflujo durante 2h. Este tiempo fue suficiente para descarboxilar el cúmulo de rutenio. El polvo formado fue recuperado por separación con acetato de etilo y agua purificada. El polvo fue finalmente lavado con éter dietílico con el fin de eliminar componentes orgánicos remanentes y mantenido para su secado en un desecador al vacío a temperatura ambiente hasta su utilización.
La morfología y el tamaño de las partículas se determinaron con un microscopio electrónico de transmisión (JEOL 2010), operando a 200 keV y una resolución puntual de 2.3 Å. El espectro de difracción de rayos X fue medido con una radiación de Cu-Kα de un difractómetro Siemens (D5000), cubriendo los ángulos 2θ de Bragg en un intervalo de 10° a 80°. El tamaño de las partículas fue estimado del ancho del pico de reflexión utilizando la ecuación Scherer [15].
Los estudios electroquímicos se realizaron en una celda típica de tres electrodos conteniendo un electrodo de trabajo en forma circular de carbón vítreo (área geométrica = 0.07 cm2), encapsulado en un cilindro de Nylamid con contacto en acero inoxidable. El diseño y arreglo de la celda ha sido utilizado para estudios electrocatalíticos con modificaciones superficiales de electrodos [16]. Se utilizó un electrodo de referencia de Hg/Hg2SO4, 0.5M H2SO4 (E=0.67 V/ENH), y un electrodo auxiliar de malla de platino con una superficie geométrica superior a 10 cm2. Los potenciales son reportados con respecto al electrodo normal de hidrógeno, ENH. Los estudios electroquímicos con electrodos de disco rotatorio, EDR, se realizaron con un rotor Pine con control para diferentes velocidades de rotación, conectado a un Potenciostato/ Galvanostato (EG&G PAR mod 273A). Como electrolito se utilizó una solución de 0.5 M H2SO4 ( Merck, p.a.), preparada con agua bidestilada. Previo a los experimentos electroquímicos la solución electrolítica fue desoxigenada con nitrógeno para la activación del electrodo de trabajo y posteriormente, saturada con oxígeno durante 20 min. Durante las mediciones experimentales corriente-potencial, se mantuvo un flujo de oxígeno sobre la solución.
El electrodepósito de rutenio en forma de película delgada se realizó con control potenciostático en una solución acuosa conteniendo 10-2 M RuCl3 en 0.5M H2SO4 siguiendo el procedimiento descrito en la literatura [17]. Previo a la electrodeposición, la solución fue desoxigenada con nitrógeno durante 30 min y posteriormente el electrodo de carbón vitreo de 0.07 cm2 de área, fue polarizado a un potencial de -0.780V vs ECS durante 1 min., girando el electrodo a una velocidad de rotación de 500 rpm. La carga correspondiente a este depósito fue de 46.75 mC, correspondiendo a un espesor de 19 µm.
El polvo de rutenio metálico utilizado fue marca Stream malla 200 con una pureza del 99.95%, sin tratamiento previo se coloco sobre el electrodo de trabajo, soportado en una red polimérica de Nafion® igual que el rutenio nanométrico.
La preparación del ensamble conteniendo membrana y electrocatalizadores se realizó utilizando como ánodo una tinta preparada con 2.5 mg de platino (E-Tek), mezclada con 1 mg de carbón en polvo (Vulcan XC-72, Cabot) en una solución al 5% de etanol en Nafion® líquida. Esta suspensión fue aplicada en una de las caras de la membrana Nafion® 117 (Du Pont) y en un difusor de papel carbón (ElectroChem, Inc). En la otra cara de la membrana que actuó como cátodo se depositó una suspensión homogénea conteniendo 2.5 mg del rutenio nanométrico sintetizado, mezclado con 3 mg de carbón y la solución de Nafion® líquida. De igual manera se aplicó la misma suspensión a otro difusor de papel carbón. Los difusores de los gases fueron ensamblados a una membrana Nafion® 117 a una presión de 100 kg cm-2 a una temperatura de 130 °C durante 1.5 min. El área activa total del ensamble fue de 10 cm2. El ensamble fue caracterizado en un sistema de ensayos de celdas de combustible (ElectroChem), utilizando un flujo de hidrógeno de 200 cm3/min y un flujo de oxígeno de 400 cm3/min, a diferentes temperaturas y a una presión de 30 psia para el hidrógeno y el oxígeno.
3. Resultados y discusión
En la figura 1 se muestra la imagen en transmisión, TEM, de los polvos de rutenio sintetizados de la pirólisis del Ru3(CO)12 colocados sobre una película de carbón amorfo soportada en una rejillas de cobre. En esta imagen se muestran las partículas que se encuentran bien distribuidas con tamaños de 5 a 7 nm. Compuestos de WxRuySez sintetizados en m-xileno y o-diclorobenceno [14], de los correspondientes carbonilos de metales de transición, han mostrado ser materiales amorfos con tamaños de 2 nm, aproximadamente. La ventaja de utilizar 1,6-hexanodiol como disolvente es porque se obtienen también partículas nanométricas, pero en un tiempo 10 veces menor a lo reportado con m-xileno y o-diclorobenceno, logrando un ahorro de energía considerable. El espectro de difracción de rayos X de los polvos de rutenio obtenido de la pirólisis en 1,6-hexanodiol se muestra en la figura 2. En esta figura se pueden observar tres picos, uno amplio en el intervalo de 15 a 30 grados, otro amplio en el intervalo de 35 a 50 grados y un tercer pico centrado en 2θ = 69°. El primer pico se atribuye a remanentes de estados amorfos de carbonilos de rutenio polinucleados [12] y el segundo centrado en 2θ = 44° (tablas JCPDS06-0663), a las partículas de rutenio nanométricas cristalinas. Del ancho medio del pico se determinó que las partículas eran de 5 nm aproximadamente, usando la ecuación de Scherer. Este resultado es consistente con lo determinado en el espectro de transmisión electrónica. Los materiales electrocatalizadores con base en platino utilizados en las celdas de combustible, son menores a 5 nm, por lo que se podría considerar que la técnica de preparación de materiales nanométricos vía pirólisis en medio aprótico es atractivo como un método de preparación de materiales de tamaño nanométrico.


Estudio de la reacción de reducción de oxígeno con electrodo de disco rotatorio
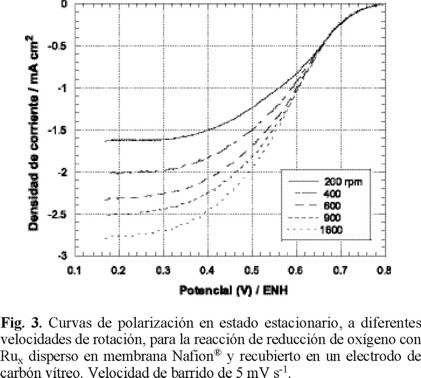
La figura 3 muestra curvas de densidad de corriente-potencial para la reacción de reducción de oxígeno, obtenidas en 0.5M H2SO4, a la temperatura de 25 °C con un electrodo de disco rotatorio, EDR, conteniendo partículas de rutenio dispersas en carbón y soportadas en una red polimérica de Nafion®. En reacciones electroquímicas la transferencia de electrones y el transporte de masa son dos procesos consecutivos y uno de los dos se comporta como la etapa determinante, dependiendo de su lentitud relativa. En las curvas de polarización en estado estacionario de la figura 3, se pueden apreciar tres zonas, una a bajos sobrepotenciales entre 0.80 y 0.64 V/ENH, donde la transferencia de electrones es lenta en relación al transporte de masa y ésta etapa lenta es la determinante del proceso global. Una segunda zona, a altos sobrepotenciales, entre 0.30 y 0.18 V/ENH, se observa una variación de la densidad de corriente de saturación o límite con la velocidad de rotación. En esta zona la transferencia de electrones es la etapa más rápida y el proceso está controlado por el transporte del oxígeno vía difusión a la superficie del electrodo. Un proceso con control mixto se observa entre 0.30 y 0.64V/ENH. Si denotamos como ik la densidad de corriente controlada por la transferencia de carga, iL la densidad de corriente controlada por la transferencia de masa a través del electrolito e if la densidad de corriente debida al transporte de masa a través de la película de Nafion®, entonces la densidad de corriente total estará expresada por la relación cinética de primer orden [18,19]:
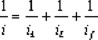
siendo esta ecuación expresada también como:
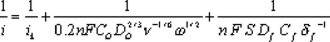
donde 0.2 es una constate utilizada cuando la velocidad de rotación está en rpm, es el número de electrones involucrados en la reducción de oxígeno, y son la concentración y el coeficiente de difusión del oxígeno en el medio reaccionante, y el coeficiente de difusión y la concentración de oxígeno el la película polimérica, la viscosidad cinemática del mismo medio y el espesor de la película. En películas delgadas, el último término de la ec. (2) no influye en las contribuciones cinéticas, tal como ha sido reportado en la reacción de reducción de oxígeno con rutenio de tamaño nanométrico, obtenido de la pirólisis del Ru3(CO)12 al aire, a la temperatura de 190°C [20]. La determinación de los parámetros cinéticos se lleva a cabo, realizando las correcciones a la corriente total por la aportación de la transferencia de masa. En la figura 4 se muestra el comportamiento corregido de densidad de corriente cinética-potencial, obtenida de los datos de las curvas de la figura 3 y utilizando las ecuaciones (1) y (2) para la obtención de la corriente cinética promedio. Un comportamiento semilogarítmico es observado entre 0.72 y 0.59V /ENH, denominado como comportamiento de Tafel, y el cual se comporta según la ecuación [21]
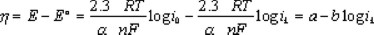
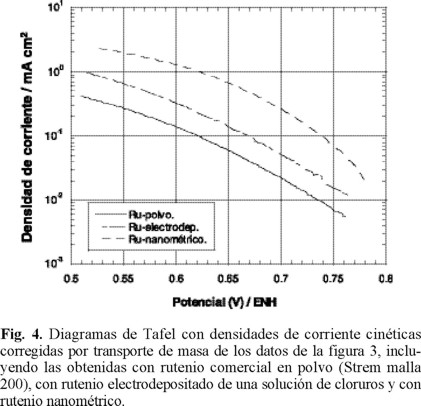
siendo η el sobrepotencial, α el coeficiente de transferencia de carga, la densidad de corriente de intercambio, la agrupación de términos constantes y la pendiente de Tafel. En la misma figura 4 se muestran el comportamiento cinético obtenido bajo las mismas condiciones con electrodos preparados con rutenio en polvo comercial (Strem malla 200) y electrodepositado de una solución de RuCl3. Los parámetros cinéticos deducidos de las pendientes de Tafel de la figura 4 se reportan en la Tabla 1. Los resultados de esta tabla muestran potenciales a circuito abierto, pendientes de Tafel y coeficientes de transferencia de carga semejantes entre las diferentes muestras. Sin embargo, la densidad de corriente de intercambio es mayor para el rutenio nanoparticulado, situación generalizada para materiales de tamaño nanométrico. La pendiente de Tafel proporciona información de la cinética de la reacción y una pendiente de -0.110 V/dec, corresponde a una cinética con la transferencia del primer electrón del electrocatalizador a la molécula de oxígeno adsorbido en la superficie del electrodo, correspondiendo ésta a la reacción:
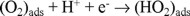

siendo ésta la etapa determinante de la velocidad de reacción. La pendiente de Tafel reportada por Adzik y col. [22], con rutenio metálico es de -0.450V/dec, siendo este muy elevado, sin existir justificación cinética alguna. El electrocatalizador con mejores perspectivas a ser utilizado en una celda de combustible será aquel con un potencial más cercano al potencial de equilibrio (1.226 V a 25 ºC), a una densidad de corriente establecida. A la densidad de corriente de 0.1 mA cm-2 el rutenio de tamaño nanométrico presenta un potencial más cercano al potencial de equilibrio para obtener la misma velocidad de reacción que con las otras presentaciones, mostrando que este material de tamaño nanométrico podría ser considerado como el más atractivo de los tres a ser utilizado como cátodo en una celda de combustible. Estudios cinéticos realizados con el fin de determinar el mecanismo de reacción para la reducción de oxígeno en medio ácido, utilizando rutenio como centro activo [12,14,23], han puesto de manifiesto que los materiales sintetizados del proceso de descarboxilación en diferentes disolventes, presentan una transferencia multielectrónica (n = 4e-), favoreciendo la reacción global: O2 + 4H+ + 4e- → 2H2O.
Desempeño de la celda de combustible
La figura 5 muestra el desempeño de una monocelda de combustible con el Ensamble Membrana-Electrocatalizador, EME, preparado con platino nanoparticulado como ánodo, rutenio nanopartículado como cátodo, funcionando con hidrógeno puro como combustible y oxígeno puro como agente oxidante. Las condiciones ideales para el funcionamiento de esta celda sería que operara a baja temperatura, presión atmosférica, alimentada con hidrógeno y aire seco. Sin embargo, existe una dependencia del comportamiento cinético con la temperatura y la presión de los gases. Las respuestas de densidad de corriente versus el potencial de la celda de la figura 5, fueron obtenidas a diferentes temperaturas, humedeciendo previamente los gases a una temperatura 5 °C mayor a la requerida en la celda experimental. En todos los experimentos a diferentes temperaturas, el potencial a circuito abierto observado en la celda fue cercano a 0.90 V. Se puede observar que la actividad catalítica de la celda se incrementa con la temperatura, atribuible al incremento de la cinética de transferencia de carga a nivel interfacial con la temperatura.
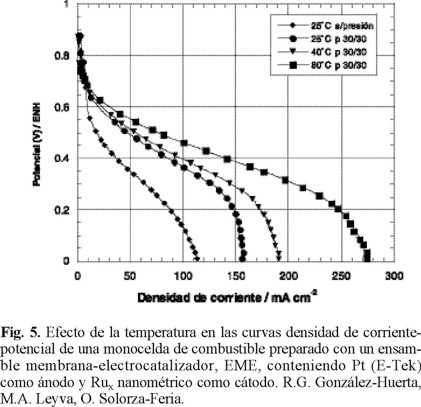
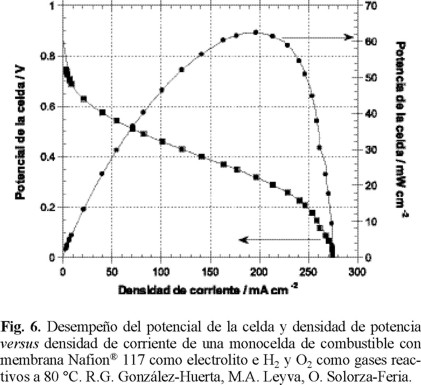
En la figura 6, se observa que a 80 °C, la curva de desempeño de la celda es baja, tomando en cuenta que se obtienen 0.06W/cm2 a 0.20 A/cm2 y 0.32 V. Se han reportado altos desempeños de celdas de combustible con membrana polimérica que utilizan platino como electrocatalizadores, operando en condiciones semejantes. Los valores de potencia reportados recientemente con cargas de electrocatalizadores de platino de 0.12 mg/cm2, son cercanos a 0.70 W/cm2 con densidades de corriente de 1.5 A/cm2 [24]. El bajo desempeño logrado con cátodos de rutenio nanoparticulado se atribuye a la metodología seguida en la obtención de estos resultados preliminares como son la preparación y aplicación de la tinta que ocasiona una alta caída óhmica en el ensamble membrana-electrocatalizadores y a la inundación de la celda con el agua formada de la reacción global. Sin embargo, los trabajos en curso están permitiendo evaluar el efecto de la carga de electrocatalizadores, la uniformidad de la suspensión en la preparación de las tintas, las presiones de sinterizado en el ensamble y las condiciones óptimas de desempeño de la monocelda de combustible con membrana polimérica.
Conclusiones
Se ha presentado un estudio comparativo del comportamiento electroquímico del rutenio obtenido por diferentes técnicas y su actividad catalítica en medio ácido. La técnica de pirólisis del Ru3(CO)12 en 1,6-hexanodiol (teb ~220 °C a 585 mmHg) bajo reflujo durante 2h, ha conducido a la preparación de partículas de rutenio de tamaño nanométrico. Estas partículas soportadas en carbón y mezcladas con Nafion® líquido, presentan una aceptable actividad catalítica para la reacción de reducción de oxígeno en 0.5M H2SO4. Sin embargo, los resultados obtenidos en una monoceldas de combustible, con ensambles preparados utilizando platino como ánodos y las partículas de rutenio como cátodo, presentan un bajo desempeño con una potencia de 0.06 W/cm2 a 80 °C, operando con hidrógeno puro y oxígeno puro.
Agradecimientos
Los autores agradecen el apoyo financiero otorgado por el CONACYT al Proyecto 41093. R.G. González-Huerta agradece la beca doctoral otorgada por el CONACYT.
Referencias
1. Vielstich, W. in: Handbook of Fuel Cells: Fundamentals Technology and Applications, Vol. 1, Vielstich, W.; Lamm, A.; Gasteiger, H. A., Eds, Wiley, West Sussex, 2003, 26-30. [ Links ]
2. Williams, M. C. in: Fuel Cell Handbook, 5th edition, U.S. Department of Energy, Washington, 2000, 1-37. [ Links ]
3. Larminie, J.; Dicks, A., in: Fuel Cell Systems Explained. Wiley, Weinheim, 2000. [ Links ]
4. Bockris, J. O'M.; Reddy, A. K., N. in: Modern Electrochemistry, Vol. 2B, 2nd edition, Kluwer-Plenum, New York, 2000, 1789-1851. [ Links ]
5. Gottesfeld, S.; Zawodzinski, T. A.; in: Adv. Electrochem. Sci. Engineering, Vol. 5, Alkire, R. C.; Gerischer, H.; Kolb, D. M.; Tobias, C. W., Eds., Wiley- VCH, Weinheim, 1997, 195-301. [ Links ]
6. Perry, M. L.; Fuller, T. F. J. Electrochem. Soc. 2002, 149, S59-S67. [ Links ]
7. Mehta, V.; Cooper, J. S. J. Power Source, 2003, 114, 32-53. [ Links ]
8. Markovic, N. M.; Ross, P. N.; in: Interfacial Electrochemistry: Theory, Experiment and Applications, Wieckowsky, A., Ed., Marcel Dekker, New York, 1999, 821-841. [ Links ]
9. Ralph, T. R.; Hogarth, M. P. Platinum Metals Rev. 2002, 46, 3-14. [ Links ]
10. Toda, T.; Igarashi, H.; Uchida, H.; Watanabe, M. J. Electrochem. Soc. 1999, 146, 3750-3756. [ Links ]
11. Lefèvre, M.; Dodelet, J.-P. Electrochimica Acta 2003, 48, 2749-2760. [ Links ]
12. González-Cruz, R.; Solorza-Feria, O. J. Sol. St. Electrochem. 2003, 7, 289-295. [ Links ]
13. Rivera-Noriega, R.; Castillo-Hernández, N.; Soto-Guzmán, A.; Solorza-Feria, O. Int. J. Hydrogen Energy, 2002, 27, 457-460. [ Links ]
14. Ramírez-Raya, S.D.; Solorza-Feria, O.; Ordoñez-Regil, E.; Benaissa, M.; Fernández-Valverde, S. M. NanoStructured Mat., 1998, 10, 1337-1346. [ Links ]
15. Cullity B.D. in: Elements of X-ray Diffraction, Addison-Wesley, 2nd. Edition, Reading, 1978, 102. [ Links ]
16. Solorza-Feria, O.; Citalán-Cigarroa, S.; Rivera-Noriega, R.; Fernández-Valverde, S.M. Electrochem. Comm. 1999, 1, 585-589. [ Links ]
17. Burke, L.D.; Mulcahy, J.K.; J. Electroanal. Chem. 1976, 73, 207-218. [ Links ]
18. Schmidt, T.J.; Gasteiger, H.A.; Stab, G.D.; Urban, P.M.; Kolb, D.M.; Behm, R.J. J. Electrochem. Soc. 1998, 145, 2354-2358. [ Links ]
19. Gojkovic, S.Lj.; Zecevic, S.K.; Savinell, R.F. J. Electrochem. Soc. 1998, 145, 3713-3720. [ Links ]
20. Solorza-Feria, O.; Durón, S. Int. J. Hydrogen Energy 2002, 27, 451-455. [ Links ]
21. Bard, A.; Faulkner, L.R. in: Electrochemical Methods: Fundamentals and Applications, 2nd Ed., Wiley, New York, 2001. [ Links ]
22. Anastasijevic, N.A.; Dimitrijevich, Z.M.; Adzic, R.R. Electrochim. Acta 1986, 31, 1125-1130. [ Links ]
23. Alonso-Vante, N.; Tributsch, H.; Solorza-Feria, O. Electrochim. Acta 1995, 40, 567-576. [ Links ]
24. Qi, Z.; Kaufman, A. J. Power Sources 2003, 113, 37-43. [ Links ]














