Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 no.3 Ciudad de México jul./sep. 2003
Investigación
Preparación de hidrogeles anfifílicos sensibles a diferentes valores de pH utilizando monómeros ácidos con espaciadores hidrofóbicos
Eduardo Rogel-Hernández,1 Angel Licea-Claveríe,2* José Manuel Cornejo-Bravo1 y Karl-Friedrich Arndt3
1 Facultad de Ciencias Químicas e Ingeniería, Universidad Autónoma de Baja California, Calzada Tecnológico 14418, Mesa de Otay, 22300 Tijuana, B.C., México.
2 Centro de Graduados e Investigación, Instituto Tecnológico de Tijuana, A.P. 1166, 22000, Tijuana, B.C., México. Tel/Fax: (664)-623-3772. E-mail: aliceac@tectijuana.mx
3 Institute of Physical Chemistry and Electrochemistry, Dresden University of Technology, D-01062 Dresden, Germany.
Recibido el 26 de junio del 2003
Aceptado el 25 de septiembre del 2003
Resumen
En este trabajo se reporta la síntesis de hidrogeles anfifílicos, derivados del ácido metacrílico con espaciadores hidrofóbicos tipo alifático de diferente longitud (1, 3, 5, 9 y 10 metilenos). Los hidrogeles obtenidos mostraron un pH crítico de contracción-hinchamiento en función del espaciador alifático: a mayor longitud del espaciador alifático mayor pH crítico. El pH crítico coincide con el cambio de pKa por efecto del espaciador alifático cuando el número de metilenos va de 1 a 5. Sin embargo, cuando el espaciador contiene 9 y 10 metilenos el pH crítico está por arriba del cambio de pKa por efecto del espaciador. Interacciones hidrofóbicas adicionales pueden ser responsables de este comportamiento.
Palabras clave: Hidrogeles, polímeros sensibles, metacrilatos, pH-sensibles, anfifílicos.
Abstract
In this work the synthesis of amphiphilic hydrogels is reported, based on methacrylic acid derivatives with hydrophobic spacers of aliphatic type (1, 3, 5, 9 and 10 methylene units). The prepared hydrogels show critical pH values for deswelling-swelling transition in accordance with the aliphatic spacer: the longer the aliphatic spacer the higher the critical pH. The critical pH corresponds well with the pKa shifts expected as effect from the aliphatic spacer when the number of methylene units goes from 1 to 5. However, when the number of methylene units is 9 and 10, the observed critical pH is higher than that expected from the aliphatic spacer influence. Additional hydrophobic interactions could be responsible for the observed behavior.
Keywords: Hydrogels, sensitive polymers, methacrylates, pH-sensitive, amphiphilic.
Introducción
Un gel es una forma de materia entre un sólido y un líquido. Consiste de polímeros entrecruzados formando una red tridimensional y ésta red se encuentra sumergida en un líquido [1]. Estos materiales se denominan geles porque el más conocido de ellos es la gelatina para postres. El líquido impide que la red polimérica se colapse, mientras que la red impide que el líquido fluya libremente. En el caso de que el líquido parte del gel sea agua entonces se denomina a éste material: hidrogel. Algunos ejemplos de geles naturales son el humor vítreo del interior del ojo, la córnea, y el líquido sinovial de las coyunturas óseas. La historia de los hidrogeles sintéticos se remonta a fines de los años cincuentas cuando Wichterle y Lim [2] reportaron la preparación de un gel de metacrilato de 2-hidroxietilo (HEMA), el primer material para lentes de contacto blandos. La biocompatibilidad de éste mismo material fue probada posteriormente durante su uso clínico como material para implantes [3]. Actualmente las aplicaciones de los hidrogeles sintéticos incluyen además: materiales superabsorbentes para pañales y toallas femeninas, materiales para separación en química analítica (columnas de permeación en gel y electroforesis), materiales intermediarios para la preparación de elásticos, adhesivos y membranas y materiales para la liberación controlada de fármacos y biocidas.
La formación de un gel partiendo de un polímero entrecruzado seco y un líquido, es un fenómeno físico-químico que puede describirse de la siguiente manera (Fig. 1): El líquido al ponerse en contacto con el polímero entrecruzado (sólido) intentará disolverlo siempre y cuando sean químicamente compatibles. Para ello el líquido solvatará a las macromoléculas del polímero intentando separarlas unas de otras. Macroscópicamente esto provocará el hinchamiento progresivo de la red polimérica (gel). Este proceso de hinchamiento tiene un límite ya que el polímero forma una sola red tridimensional unida por enlaces covalentes que no puede destruirse por un proceso sencillo de solvatación. Termodinámicamente hablando el cambio de energía libre del sistema durante el proceso se describe como una combinación de energía libre de mezclado (proceso de disolución) y la energía libre elástica (impide el rompimiento de la red polimérica).


En el estado de hinchamiento al equilibrio ΔGtot = 0 y por lo tanto ambos términos de energía libre se encuentran equilibrados. Dependiendo de la descripción específica de cada término (teoría y sus limitaciones) se obtienen distintas ecuaciones, siendo una de las más conocidas la de Flory-Rehner [4]:

Siendo φB, la fracción volumen del polímero en el gel, VA, el volumen molar del líquido, χ, el parámetro Flory-Huggins de interacción líquido-polímero, ν, la densidad de entrecruzamiento, A, el factor de microestructura, B, el factor de volumen y η, el factor de memoria (grado de dilución en la preparación de la red polimérica). Habiendo una relación directa entre grado de hinchamiento (Q) y la fracción volumen φB:

Siendo VH, el volumen del gel en el equilibrio (red polimérica hinchada) y Vo, el volumen de la red polimérica seca. Los parámetros más importantes que determinan el grado de hinchamiento al equilibrio de un gel son la densidad del entrecruzamiento de la red polimérica (ν) y el parámetro Flory-Huggins de interacción líquido-polímero (χ).
En el caso de los hidrogeles en la mayoría de los casos contienen grupos funcionales ionizables. A estos geles se les llama también geles polielectrolíticos. La presencia de grupos ionizables en las redes poliméricas introduce nuevos factores que afectan su grado de hinchamiento en soluciones acuosas. De acuerdo a Peppas [5] existen al menos 3 contribuciones al cambio de energía libre de Gibbs en un gel polielectrolítico:

En términos de potencial químico se obtiene:

siendo µ1o, el potencial químico del líquido puro y µ1, el potencial químico del líquido en el gel. Al alcanzar el equilibrio de hinchamiento se obtiene:

siendo (Δ µ1*)ion, el cambio de potencial químico del líquido en la solución externa al gel por efecto de los iones. De tal manera que la diferencia (Δ µ1*)ion - (Δ µ1)ion representa la contribución de la presencia de grupos ionizables en el gel sobre su grado de hinchamiento. En el modelo de Peppas [5], cuando la concentración de iones en la solución externa al gel es comparable o mayor que la concentración de iones en la red polimérica, tenemos que:

Siendo i, el grado de ionización de los grupos funcionales en la red polimérica, v', el volumen específico del polímero y I, la fuerza iónica de la solución hinchante. Ya que el grado de ionización de un grupo funcional es función del pH del medio, entonces queda claro que el grado de hinchamiento total para un gel polielectrolítico depende tanto de los parámetros generales como ν y χ así como del pH del medio hinchante y de la fuerza iónica de la solución (I), que a su vez es función de la concentración de sales en el medio hinchante. Por la descripción anterior queda claro que los geles son materiales que van a "responder" a cambios del medio ambiente que los rodea modificando su volumen (grado de hinchamiento). Esto ha provocado que se llamen a estos materiales geles actuantes, inteligentes o sensibles y han sido sujetos de muchos trabajos de investigación. Se ha demostrado que según el diseño pueden ser sensibles a: la temperatura, el pH, el campo eléctrico, el tipo de solvente, la intensidad de la luz y su longitud de onda, la presión, la fuerza iónica, el tipo de iones e incluso a compuestos químicos específicos como la glucosa [6]. Sin embargo los tres tipos de contribuciones descritas para explicar el comportamiento de hinchamiento-contracción de geles polielectrolíticos no son suficientes para explicar el comportamiento de todos los hidrogeles. Específicamente, Tanaka [7] llamó la atención sobre la importancia de considerar interacciones hidrofóbicas y de enlaces puente de hidrógeno, para explicar mas cabalmente el comportamiento de los geles sensibles. Desgraciadamente este tipo de interacciones no han sido contempladas de manera explícita en las teorías que describen el comportamiento de este tipo de materiales.
La motivación de este trabajo es generar sistemas de hidrogeles anfifílicos, con contenido hidrofóbico controlado para estudiar el efecto hidrofóbico sobre el comportamiento de geles sensibles al pH. Esto se origina en reportes de Siegel [8] y de Khokhlov y colaboradores [9] que encontraron cambios en el pH crítico de contracción a hinchamiento aparentemente en función de contenido hidrofóbico en sus sistemas. Por otro lado en nuestros laboratorios encontramos [10], que el pH en que aparece el punto de turbidez de soluciones de polielectrolitos hidrofóbicos (metacrilatos de alquilo con grupos ácidos) varía en función del alquilo, lo que los hace candidatos para hidrogeles pH-sensibles. El comprender y cuantificar la influencia de fuerzas hidrofóbicas sobre el comportamiento pH-sensible de hidrogeles es muy relevante para la temática de suministro de fármacos en sitio-específico, ya que, el pH del cuerpo humano varía a lo largo del tracto gastrointestinal. En el estómago el intervalo de pH es de 1.0 a 3.5, en el intestino delgado el intervalo es de 4.5 a 6.5, en el intestino grueso es de 7.5 a 8.0 y por último en el colon el pH oscila entre 5.0 a 7.0 [11]. Por lo que se podría diseñar y preparar un hidrogel específico para el suministro de un fármaco en el sitio del tracto gastrointestinal deseado.
Resultados y Discusión
Preparación y caracterización de geles hidrofóbicos
La metodología propuesta para la obtención de los hidrogeles anfifílicos está descrita de manera esquemática en la Fig. 2 y consiste de dos etapas: La preparación de geles hidrofóbicos partiendo de monómeros con los espaciadores deseados y conteniendo el grupo ácido protegido con un metoxiéster y su posterior desprotección selectiva para generar hidrogeles anfifílicos como producto final. Los monómeros con espaciadores alifáticos y grupo ácido protegido fueron preparados de acuerdo a las rutas de síntesis descritas en un trabajo anterior [10]. Con estos monómeros y utilizando dimetacrilato de etilenglicol (EDGMA) como agente entrecruzante, se preparó en cada caso una solución en THF y se colocó junto con su iniciador de radicales libres entre dos placas de vidrio, previamente silanizadas (Fig. 3). Las reacciones de gelificación se llevaron a cabo tal y como se describe en la parte experimental. En los cinco casos se obtuvieron geles en forma de placas transparentes sin defectos visibles a simple vista y con una ligera coloración amarilla en el caso de los monómeros con 9 y 10 metilenos como grupo espaciador. Para la caracterización se utilizaron discos recortados de las placas de cada gel de 3.75 cm de diámetro en seco (ver parte experimental). Con ellos se estudió su comportamiento térmico en seco mediante calorimetría diferencial de barrido (DSC) y su grado de hinchamiento gravimétrico al equilibrio (Qm) en distintos solventes orgánicos de acuerdo a la siguiente fórmula simplificada:



Siendo mh, el peso del disco de gel hinchado al equilibrio (húmedo) y mo, el peso del gel seco. Los resultados de ambos estudios se encuentran reportados en la Tabla 1 y Fig. 4. Las temperaturas de transición vítrea (Tg) de los geles muestran que, como se esperaba, los que tienen en su estructura un espaciador con cadena alifática más larga tienen valores de Tg más bajos, mientras que los que tienen cadenas alifáticas más cortas como espaciador presentan valores más altos de Tg (Tabla 1). Esto es una consecuencia de la flexibilidad que les confieren a los geles las cadenas alifáticas espaciadoras. Sin embargo, no se observa una diferencia tan marcada entre el gel con n = 1 y el gel con n = 10 metilenos, como en el caso de los polímeros lineales análogos preparados por nosotros con anterioridad [10], ya que Tg (geles) = 12.6 K contra ΔTg (lineal) = 96 K. Esto debe ser consecuencia de que la estructura tridimensional de la red hace a los geles, en general, materiales más rígidos.


Los estudios de hinchamiento se hicieron en tolueno, THF y 1,4-dioxano a temperatura ambiente. El tolueno fue seleccionado por su baja polaridad (ε = 2.4) y su potencial afinidad con los grupos hidrofóbicos. El THF es mas polar (ε = 7.5) sin ser muy alta su polaridad y el 1,4-Dioxano aunque su polaridad es baja (ε = 2.2) por los oxígenos presentes en su estructura, es capaz de tener interacciones específicas con los geles sintetizados ya que éstos contienen grupos éster. En la Fig. 4 se muestra el comportamiento de hinchamiento mostrado por los geles preparados con grupos ácidos protegidos. En el caso del tolueno, podemos ver que al aumentar la longitud de la cadena hidrofóbica es mayor el hinchamiento, ya que las interacciones disolvente-polímero se favorecen en ese solvente básicamente hidrofóbico y por lo tanto afín. Sin embargo, en el caso del THF que es mas polar, se observa que a partir del gel con n = 5 metilenos como espaciador, el hinchamiento casi se mantiene constante; esto nos podría indicar que el parámetro de solubilidad de los geles (δ), que es una medida de las fuerzas de atracción entre moléculas de cada material, no varía mucho a partir de esta cantidad de metilenos. El parámetro de solubilidad para nuestros polímeros debe ser cercano al del 1,4-dioxano (20.5 MPa1/2) [12], ya que en ese disolvente todos los geles presentaron su grado de hinchamiento máximo (Fig. 4). Esto es indicativo de una mayor afinidad de nuestros geles hidrofóbicos por ese solvente.
En conclusión, los geles hidrofóbicos preparados aumentan su flexibilidad y su hidrofobicidad al aumentar el número de metilenos en su cadena alifática utilizada como espaciador. Por otro lado muestran mayor afinidad por solventes no-polares que contienen oxígeno, presumiblemente debido a los dos grupos éster presentes en su unidad repetitiva estructural.
Preparación y caracterización de hidrogeles anfifílicos
Los geles hidrofóbicos fueron sometidos a una reacción de saponificación selectiva, semejante a la utilizada para preparar polielectrolitos hidrofóbicos análogos como está descrito en [10] (Fig. 2); solamente se disminuyó el tiempo de reacción de 24 h a 18 h, ya que se observó que un calentamiento demasiado prolongado afectaba la integridad de los discos de geles llegando a fracturarlos. Los geles obtenidos son anfifílicos pues tienen segmentos en su estructura que son hidrofóbicos (cadenas alifáticas espaciadoras) y por otro lado partes hidrofílicas (grupos ácidos convertidos a carboxilatos de litio). El cambio de propiedades de los geles pudo ser observado desde la misma reacción de desprotección, ya que su cambio de polaridad se reflejó en una contracción macroscópica de los mismos en el medio de reacción. Las condiciones severas de reacción (altas temperaturas y agitación) además del fenómeno de contracción de los discos de geles trajo como consecuencia el daño físico de algunos de los discos, además de que algunos de ellos se colorearon como consecuencia de la reacción. Por lo anterior fue importante el realizar ésta reacción de manera cuidadosa y seleccionar adecuadamente los discos no dañados para los subsecuentes experimentos de caracterización de los mismos.
La determinación de los valores de Tg's por DSC (Tabla 1, columnas 4 y 5), nos arrojó en la mayoría de los casos dos valores de Tg. Posiblemente la Tg (1) que se observa a menores temperaturas se deba a una parte del gel donde la reacción de desprotección no fue efectiva, ya que si comparamos esos valores de Tg contra los de los geles con grupos ácidos protegidos (Tabla 1, columna 2) se observa que son muy semejantes. El valor de la Tg (2) que se observa a mayor temperatura debe corresponder a la parte del gel desprotegida, ya que generalmente los valores de Tg de polímeros en forma de sal de carboxilatos son mucho mayores que los de polímeros con grupos éster metílico. Esto se puede corroborar fácilmente al comparar las Tg´s reportadas para poli(metacrilato de metilo) (378 K) y para poli(metacrilato de sodio)(583 K) [13]. Esto nos indica que las reacciones de desprotección selectiva de los grupos ácidos en los geles no se llevó de manera completa. Aún así, se cumplió el objetivo de obtener hidrogeles anfifílicos con una metodología simple.
Comportamiento de los geles anfifílicos en función del pH
La parte fundamental de este trabajo es el estudio de las propiedades pH-sensibles de los hidrogeles preparados. Para ello se llevaron a cabo estudios de hinchamiento al equilibrio en soluciones amortiguadoras con un pH específico y ajustando la fuerza iónica en cada caso a 0.15 M. La Figura 5 muestra el comportamiento de los diferentes geles anfifílicos en función del pH del medio. Todos los geles anfífilicos preparados muestran una transición de contracción-hinchamiento a diferentes valores de pH del medio en que se encuentran (pH crítico). Además se puede ver una clara dependencia del pH crítico de la longitud del espaciador alifático del gel: a mayor longitud del espaciador alifático, mayor pH crítico. Recordemos que el pH del medio tiene una influencia directa sobre el grado de ionización de los grupos ácidos presentes en los geles. Lo que implica la dependencia con la longitud del espaciador alifático es que se requiere cada vez un mayor grado de ionización de los grupos ácidos para lograr la transición de contracción a hinchamiento. Esto se explica porque para hincharse en un medio acuoso, los geles anfifílicos, deben vencer las interacciones hidrofóbicas de sus cadenas alifáticas y permitir la solvatación con agua. A mayor hidrofobicidad del gel, mayor fuerza de repulsión electrostática necesaria (grupos carboxilatos libres como resultado de la ionización) para permitir el hinchamiento. Aun así, la hidrofobicidad que se incrementa en función de la longitud del espaciador alifático, como vimos en la sección anterior, provoca que el grado de hinchamiento máximo, aún cuando la ionización de los grupos funcionales sea 100 %, sea menor para los geles con 9 y 10 metilenos como espaciador que para los geles que tienen menor grupo de metilenos. Otra consecuencia importante de que nuestros geles cuenten con espaciadores alifáticos de diferente longitud de cadena es que, aunque todos tienen grupos funcionales ácidos, su hinchamiento se lleva a cabo, para los que tienen 1, 3 y 5 metilenos, en medios ligeramente ácidos, mientras que los que tienen 9 y 10 metilenos como espaciador, lo hagan en medios ligeramente básicos. Khokhlov y colaboradores [9] postularon que los corrimientos del pH crítico de contracción-hinchamiento de hidrogeles con grupos ácidos y cierto contenido hidrofóbico pueden tener dos orígenes:

1. La disminución de la constante de disociación de los ácidos por efecto de la vecindad con grupos hidrofóbicos (corrimiento del pKa).
2. La formación de microdominios hidrofóbicos dentro del gel en el estado contraído que actúan como puntos de entrecruzamiento adicionales oponiéndose al hinchamiento en medio acuoso.
Para dilucidar cual de éstos dos mecanismos pudieran estar contribuyendo al comportamiento observado en los geles anfifílicos preparados por nosotros, tomamos estudios potenciométricos realizados en soluciones de polímeros anfifílicos similares no entrecruzados [10]. Ya que la metodología de preparación de esos polímeros lineales fue la misma utilizada para los geles anfifílicos (desprotección selectiva) bajo las mismas condiciones de reacción y siendo la única diferencia la presencia del entrecruzamiento, que además es moderado (2 % de entrecruzante), consideramos que la influencia de los espaciadores alifáticos sobre la constante de acidez (pKa) en los polímeros lineales debe ser muy semejante a la influencia sobre el pKa en los geles. En la Tabla 2 comparamos los valores obtenidos de los estudios potenciométricos reportados con anterioridad [10] en los polímeros lineales contra los valores de pH crítico encontrados en los geles en este trabajo.
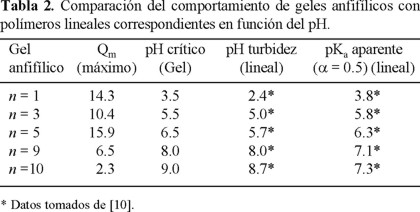
Podemos observar que en el caso de los geles con 1, 3 y 5 metilenos hay una muy buena coincidencia entre el pKa de los polímeros lineales con el pH crítico mostrado por los geles. Esto nos indica que la constante de acidez baja (el pKa aumenta) como efecto del microambiente hidrofóbico proporcionado por los espaciadores alifáticos. Esto trae como consecuencia que el grado de ionización necesario para la transición de contraído a hinchado aumente (aumento de pH crítico). Sin embargo, para el caso de los geles anfifílicos con 9 y 10 metilenos como espaciador, observamos en la tabla que si bien los valores de pKa siguen aumentando, este aumento no corresponde con el aumento del pH crítico, el cual es mayor. Estos resultados sugieren que, cuando tenemos cadenas alifáticas mas largas como espaciadores, no solo se produce una disminución de la constante de acidez por el microambiente (corrimiento del pKa a valores mayores), sino que esas cadenas alifáticas pueden formar microdominios con interacciones hidrofóbicas fuertes. Estas interacciones hidrofóbicas actúan como fuerzas adicionales que se oponen al hinchamiento en medio acuoso. La consecuencia es que se requiera un grado de ionización de los grupos ácidos, bastante mayores al 50 % para contrarestar estas fuerzas hidrofóbicas adicionales. Por otro lado podemos constatar en la misma tabla 2 que el pH crítico corresponde mejor con el pH del punto de turbidez de los polímeros lineales que con su constante de acidez. Esto se puede deber al hecho de que un punto de turbidez implica que los polímeros pasan de un sistema de una sola fase (solución) a un sistema de dos fases (solución y polímero precipitado). El fenómeno de precipitación normalmente está precedido del colapso de las cadenas poliméricas y su posterior agregación para formar las dos fases. Hay por lo tanto una mejor analogía entre el colapso de una cadena polimérica en solución con la contracción de una red polimérica hinchada que la relación entre constante de acidez y pH crítico utilizada en las teorías para describir el fenómeno de geles pH-sensibles.
Conclusiones
En el presente trabajo se prepararon una serie de hidrogeles anfifílicos partiendo de derivados del ácido metacrílico con espaciadores alifáticos. La metodología de síntesis si bien nos llevó a los materiales deseados, puede ser mejorada. Ya que observamos que en la última etapa de desprotección selectiva, se presentaron problemas físicos en algunos de los geles preparados y no se logró la desprotección completa de los grupos funcionales.
Los efectos de los espaciadores alifáticos sobre los geles preparados son múltiples y muy relevantes:
a) En el caso de los geles con grupos ácidos metoxiprotegidos, al aumentar la longitud del espaciador aumenta la flexibilidad del material (disminuye su Tg) y aumenta su hidrofobicidad (grado de hinchamiento en solventes no polares).
b) En el caso de los geles con grupos carboxilato de litio, al aumentar la longitud del espaciador también aumenta la flexibilidad (disminuye su Tg) aunque de manera general son materiales mas rígidos. Su grado de hinchamiento en medio acuoso depende grandemente del pH del medio, tal y como se esperaba. Todos estos geles anfifílicos mostraron ser materiales pH-sensibles con transiciones de contracción-hinchamiento (pH crítico) que aumenta al aumentar la longitud del espaciador alifático. El aumento del pH crítico con la longitud del espaciador alifático se explica para el caso que n = 1, 3 y 5 metilenos, en función del cambio de la constante de acidez de los grupos ácidos por efecto del microambiente hidrofóbico generado por los espaciadores. Para el caso de n = 9 y 10 metilenos como espaciador el aumento del pH crítico no se debe únicamente al efecto de corrimiento del pKa de los grupos ácidos, sino que los espaciadores alifáticos largos forman posiblemente microdominios hidrofóbicos que actúan como puntos de entrecruzamiento adicionales que se oponen al hinchamiento en medio acuoso.
En resumen, se demostró que es fundamental el considerar las interacciones hidrofóbicas dentro de las teorías que tratan de describir el comportamiento de geles pH-sensibles. También se demostró que partiendo de una estructura química básica (ácido metacrílico) introduciendo espaciadores alifáticos, se puede lograr obtener geles pH-sensibles con pH críticos que varían desde 3.5 hasta 9.0. Con ello tenemos en teoría materiales para el suministro pH-sensible de fármacos para todas las distintas regiones del tracto gastrointestinal. Actualmente estamos tratando de mejorar la metodología de preparación y haciendo experimentos preliminares con fármacos modelo para reportar en un futuro su aplicación en esa área.
Parte experimental
Preparación de geles hidrofóbicos
Cada gel se preparó a partir de cada uno de los monómeros siguientes con grupos ácidos protegidos: 2-metacriloiloxietanoato de metilo (n = 1), 4-metacriloiloxibutanoato de metilo (n = 3), 6-metacriloiloxihexanoato de metilo (n = 5), 10-metacriloiloxidecanoato de metilo (n = 9) y 11-metacriloiloxiundecanoato de metilo (n = 10). Estos se prepararon en forma de hojas delgadas mediante polimerización en disolución vía radicales libres. Esta reacción se llevó a cabo entre dos placas de vidrio silanizado (10 × 10 cm), utilizando un espaciador de hule de silicona (2.0 mm de diámetro) insertado entre las dos placas de vidrio para proveer un espesor uniforme del gel. Las placas de vidrio se ensamblaron y fueron sostenidas con pinzas de metal (Fig. 3). Como agente entrecruzante se utilizó dimetacrilato de etilenglicol (EGDMA) al 2 % molar el cual fue purificado haciéndolo pasar por una microcolumna de cromatografía empacada con removedor de hidroquinona y de parametoxifenol (Aldrich). Como ejemplo detallado de la preparación de éstos geles se describe la preparación del gel del monómero con n = 1: En un matraz de fondo redondo de 15 mL se preparó una disolución de 2.0 g (12.66 mmol) de 2-metacriloiloxietanoato de metilo (n = 1), 48.72 µL (0.26 mmol) de EGDMA y 0.021 g (0.13 mmol, 1 % mol) de 2,2´-azobisisobutironitrilo (AIBN) en 3.0 mL de tetrahidrofurano (THF). La disolución se desgasificó con ciclos de vacío, en un baño de hielo seco acetona, seguidos de suministro de argón a temperatura ambiente (5 veces). Finalmente el matraz se cargó con argón. La disolución se introdujo con una jeringa de vidrio de 10 mL en el molde y éste se colocó en posición vertical en una estufa a 60 °C por 24 h. Después de la polimerización, el molde se removió de la estufa. La hoja de gel fue separada de las placas de vidrio y se dejó evaporar el disolvente por 24 h a temperatura ambiente. El espesor final de la hoja fue de 1.0 mm. Posteriormente se cortó en pequeños discos (3.75 mm de diámetro), con un horadador de tapones de hule, estando el gel seco. Los discos del gel se lavaron con THF por 72 h (cada 4 h se cambió el THF). Luego los discos se secaron a temperatura ambiente por 48 h y finalmente a presión reducida a temperatura ambiente por 24 h.
Preparación de geles anfifílicos
Los geles hidrofóbicos preparados, conteniendo grupos ácidos metoxiprotegidos fueron sometidos a una reacción de saponificación selectiva del metoxiéster de manera análoga a los polímeros lineales reportados con anterioridad [10]. A continuación se describe como ejemplo la saponificación del gel con n = 3 metilenos: En un matraz de 3 bocas provisto de refrigerante, termómetro, entrada de gas inerte y manta de calentamiento, se colocaron 2.5 g (18.5 mmol) de LiI anhidro en 30 mL de piridina anhidra. Esta mezcla se puso a reflujo hasta la disolución completa del LiI. Posteriormente se agregaron 0.6 g (3.1 mmol) del gel con n = 3 (en discos), previamente hinchados en piridina anhidra, y se le agregaron 0.3g (3.8 mmol) de acetato de sodio anhidro. Se continuó el reflujo hasta que se observó la contracción del gel (tiempo aproximado 18 h). Se separó el disolvente de los geles desprotegidos y se lavaron con THF (24 h) y posteriormente con mezclas de THF/agua: 75/25, 50/50, 25/75 y 0/100, de manera secuencial. El tiempo de lavado para cada una de las mezclas fue de 24 h. Después se contrajeron los geles con mezclas de agua/THF: 100/0, 75/25, 50/50, 25/75, 0/100, de manera secuencial. El tiempo de contracción en cada mezcla fue de 24 h. Finalmente se secaron al ambiente por 48 h y luego a presión reducida por 24 h.
Caracterización térmica de los geles
Los geles preparados, tanto los hidrofóbicos como los anfifílicos, fueron estudiados en cuanto a su comportamiento térmico en seco, mediante calorimetría diferencial de barrido (DSC) utilizando un equipo de TA-Instruments modelo MDSC-2920. Para ello, los discos de geles fueron cortados en pequeños pedazos para colocar un promedio de 20 mg de muestra en los portamuestras apropiados. Se siguió el método de modulación de temperatura con 0.5 K cada 60 s y una velocidad de calentamiento de 2 K por minuto. La temperatura de transición vitria reportada (Tg) se tomó de la señal de calor reversible a la media altura del escalón. En algunos casos se varió la modulación hasta 0.75 K cada 60 s para visualizar mas claramente la transición vitria en los sistemas que presentaron dos transiciones.
Hinchamiento al equilibrio de geles hidrofóbicos
A cada uno de los geles se les determinó el grado de hinchamiento al equilibrio en 1,4 dioxano, THF y tolueno. Para ello se colocó un disco del gel, previamente pesado, en un frasco con el disolvente correspondiente y se dejó por 48 h. Posteriormente se sacó el disco del gel, se le secó el exceso de líquido de su superficie con papel filtro y se pesó en una balanza analítica Ohaus Analytical Standard. Este procedimiento se repitió hasta que se obtuvo un valor de peso de gel hinchado constante.
Hinchamiento al equilibrio de geles anfifílicos en función del pH
Cada uno de los geles anfifílicos preparados fueron hinchados utilizando disoluciones amortiguadoras, preparadas en base a fosfatos y con fuerza iónica ajustada a 0.15 M, a diferentes valores de pH entre 2.0 y 12.0. El procedimiento para calcular el hinchamiento en el equilibrio a cada pH fué el siguiente: En once viales, cada uno debidamente rotulado y pesado, se colocó un disco del gel seco correspondiente, se pesó y se le agregaron 15 mL de disolución amortiguadora (por ejemplo la de pH de 2.0). A las 24 h se le cambió la disolución amortiguadora y se dejó otras 24 h en reposo. Terminado este tiempo, se extrajo la disolución amortiguadora y al disco hinchado se le secó el exceso de líquido con papel filtro y se pesó en una balanza analítica Ohaus Analytical Standard. La evaluación se hizo en tres discos por cada tipo de gel. El promedio de las tres evaluaciones dio el valor del grado de hinchamiento promedio del gel a cada pH. Este proceso general se repitió para cada disolución amortiguadora, a los siguientes pH's: 2.0, 3.2, 4.6, 5.2, 6.1, 7.1, 8.1, 8.5, 8.8, 10.9 y 12.0.
Agradecimientos
Se agradece el apoyo financiero para la realización de este proyecto de parte del CONACyT (28022-U) y del COSNET (834.98-P).
Referencias
1. Tanaka, T. Sci. Am. 1981, 244, 124-128. [ Links ]
2. Wichterle, O.; Lím, D. Nature 1960, 185, 117-118. [ Links ]
3. Voldrich, Z.; Tománek, Z.; Vacík, J.; Kopecek, J. J. Biomed. Mater. Res. 1975, 9, 675-685. [ Links ]
4. Arndt, K.F.; Müller, G. Polymer-Charakterisierung, Carl Hanser Verlag, München-Wien, 1996, 304-313. [ Links ]
5. Brannon-Peppas,L.; Peppas, N.A. Chem. Eng. Sci. 1991, 46,715-722. [ Links ]
6. Gehrke, S.H. Adv. Polym. Sci. 1993, 110, 81-144. [ Links ]
7. Shibayama, M.; Tanaka, T. Adv. Polym. Sci. 1993, 109, 1-62. [ Links ]
8. Siegel, R.A. Adv. Polym. Sci. 1993, 109, 233-267. [ Links ]
9. Philippova, O.E.; Hourdet D.; Audebert, R.; Khokhlov, A.R.; Macromol. 1997, 30, 8278-8285. [ Links ]
10. Rogel-Hernández, E., Licea-Claveríe, A., Cornejo-Bravo, J.M., Arndt, K.F. Desig. Monom. Polym. 2001, 4, 343-356. [ Links ]
11. Ghandehari, H.; Kopeckova, P.; Kopecek, J. Biomat. 1997, 18, 861-872. [ Links ]
12. Brandrup, J.; Immergut, E.H.; Grulke E.A. Polymer Handbook, Fourth Edition, Wiley-Interscience, New York-Toronto, 1999, VII675-VII711. [ Links ]
13. Brandrup, J.; Immergut, E.H.; Grulke E.A. Polymer Handbook, Fourth Edition, Wiley-Interscience, New York-Toronto, 1999, VI203-VI205. [ Links ]














