Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 no.3 Ciudad de México jul./sep. 2003
Investigación
Preparación y caracterización de una arcilla porosa de estructura heterogénea (PCH)
Tzayhrí Gallardo,1* Sofía Arellano,1 Pavel Torres,1 Socorro López1 y Guillermo Osorio2
1 Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (ENCB-IPN). Departamento de Biofísica. Plan de Ayala y Carpio s/n, Col. Sto. Tomás. México 11340. D.F. tgallard@encb.ipn.mx.
2 Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional. Departamento de Ingeniería Bioquímica. Plan de Ayala y Carpio s/n, Col. Sto. Tomás. México 11340, D.F.
Recibido el 30 de junio del 2003
Aceptado el 24 de septiembre del 2003
Resumen
Se preparó una Arcilla Porosa de Estructura Heterogénea (PCH- Porous Clay Heterostructure) a partir de una arcilla natural mexicana. Este material se preparó con la combinación de procedimientos de síntesis de arcillas pilareadas PILCs (intercambio iónico) y de materiales mesoporosos MCM (plantilla de cristal líquido). El análisis por RX de la PCH, mostró un incremento en el espacio interlaminar de la PCH (13.7 Å) con respecto al de la arcilla original (3.1Å). Las isotermas de adsorción de nitrógeno de la PCH mostraron un aumento de la superficie específica de 43 m2 / g a 305.5 m2 / g, con diámetro promedio de poro de 37.2 Å y una naturaleza principalmente microporosa.
Palabras clave: Arcilla Porosa de Estructura Heterogénea, PCH, arcilla mesoporosa.
Abstract
A Porous Clay Heteroestructure (PCH) was prepared with a natural Mexican clay. The preparation method was a combination of those of PILCs (ion exchange) and mesoporous clay materials MCM (liquid crystal template). X-ray diffraction analysis of the PCH prepared, showed an increase of the interlayer distance (13.7 Å) with respect to that of the original clay (3.1Å). Nitrogen adsorption isotherms of the PCH showed an increase of the specific surface area of the material from 43 m2 / g to 305.5 m2 / g with an average pore diameter of 37.2 Å and a mainly microporous nature.
Keywords: Porous Clay Heterostructure, PCH. mesoporous clay.
Introducción
Dentro de las ciencias aplicadas al control de la contaminación ambiental, el proceso de la adsorción tiene gran aplicación, por lo que en años recientes se han incrementado los trabajos referentes al desarrollo, síntesis y caracterización de nuevos adsorbentes inorgánicos que posean elevada superficie específica y con poros con tamaño y forma bien definidos [1-3].
Dentro de la nueva generación de adsorbentes preparados a partir de materiales arcillosos se encuentran las Arcillas Porosas de Estructura Heterogénea (PCH), las cuales presentan una superficie específica, rigidez y diámetro de poro mayores que los de los materiales precursores [4-6]. Los materiales que dan origen a las PCHs son las arcillas modificadas conocidas como Arcillas Pilarizadas (PILCS) [7-9] y los Materiales Mesoporosos (MCM) [10-13]. Ambos progenitores han demostrado tener cualidades adsorbentes y/o de intercambio iónico [14-20] por lo que es de esperarse que las PCHs también las presenten.
La preparación de una PCH combina los procedimientos de síntesis de PILCS y MCM, denominado de "plantilla de cristal líquido", el cual consiste en términos generales, en la obtención de un sistema disperso de micelas de un surfactante de alquilamonio y de una arcilla natural. Las micelas se introducen en la región interlaminar de la arcilla mediante un proceso de intercambio iónico. Posteriormente, al añadir una fuente de sílice o de alúmina, éstos aniones se polimerizan alrededor de las estructuras micelares catiónicas intercaladas y finalmente, mediante una calcinación de los productos, se elimina la materia orgánica, obteniéndose un producto rígido y poroso, cuya estructura es una combinación de micro y mesoporos con una gran superficie específica [4, 21].
Lo expuesto anteriormente manifiesta el gran potencial de aplicación de estos nuevos materiales arcillosos, por lo que el propósito del presente trabajo fue el preparar y caracterizar una arcilla porosa de estructura heterogénea (PCH) a partir de una arcilla natural mexicana.
Materiales y Métodos
Arcilla original. La arcilla natural utilizada en este trabajo fue una bentonita suministrada por Arcillas Industriales Durango, S.A., la cual se tamizó a través de una malla No. 65 (diámetro 0.210 mm) sin ninguna modificación previa.
Arcilla Porosa de Estructura Heterogénea (PCH). Se estableció una metodología basada en la patente [4]. Se utilizó como surfactante el hexadeciltrimetil amonio (HDTA) el cual se mezcló con la arcilla natural en una relación tal que los miliequivalentes del HDTA duplicara la capacidad de intercambio catiónico de la arcilla natural; dicha mezcla se agitó continuamente por 24 h. Se adicionó silicato de sodio como fuente de silicio en una proporción molar de arcilla / silicato de 1/15, agitándose nuevamente la mezcla durante 24 h a una temperatura de 70 °C. El producto se filtró y se lavó con agua desionizada hasta prueba negativa de cloruros; el material obtenido se secó a temperatura ambiente y se tomó una muestra denominada P1. Posteriormente, la arcilla se calcinó a 500 °C durante 5 h hasta la eliminación completa del surfactante, obteniéndose así el producto denominado Arcilla Porosa de Estructura heterogénea, PCH.
Caracterización de la arcilla natural, la muestra P1 y la PCH. La arcilla natural y la PCH se analizaron mediante métodos químicos, utilizando la técnica de fusión con carbonato de sodio y potasio [22]. Los componentes fueron identificados por espectroscopia de absorción atómica (EAA) y por gravimetría. La capacidad de intercambio catiónico (CIC) de las tres muestras, se determinó por el método de acetato de amonio, el cual consiste en la lixiviación total de los cationes intercambiables mediante una solución de acetato de amonio concentrada. La muestra saturada por iones amonio es nuevamente lixiviada con una solución de KCl, cuatificándolo por destilación Kjeldhal [23]. Los espectros infrarrojos de las muestras arcillosas se obtuvieron por el método de la pastilla de bromuro de potasio en un espectrofotómetro Perkin-Elmer 1600 en la región de 4000-600 cm−1. Los termogramas TG y DTG se obtuvieron en el intervalo de 25 a 900 °C con un Termoanalizador Dupont 2000 a una velocidad de 10° / min. Los análisis de difracción de rayos X (XRD) de la arcilla natural y la PCH se obtuvieron con un difractómetro Siemens D-500 con filtro de níquel y con radiación CuKα Los valores de la primera reflexión d(001) se determinaron mediante la ecuación de Bragg y restando de éstos el espesor de las láminas de silicato (9.5 Å) [24] se calcularon las distancias interlaminares (Δd) correspondientes. Las superficies específicas y el diámetro de poro promedio de las tres muestras se determinaron de las isotermas de adsorción-desorción de N2 obtenidas en un equipo Multifunctional Catalyst Characterization System RMX-100 a una temperatura de −196 °C.
Resultados y discusión
La composición química de la arcilla natural y la PCH se muestra en la Tabla 1. A partir de estos resultados se derivaron las fórmulas estructurales de cada una de ellas (Tabla 2) con base a la unidad de celda O20(OH)4. En el cálculo de la formula estructural de la PCH se consideró que las láminas del aluminosilicato de la arcilla natural no se alteraron al preparar la PCH manteniendo el contenido de silicio constante (69.0 %), mientras que el exceso de óxido de silicio (73.2-69.0 = 4.2 %) presente en la PCH se consideró en el espacio interlaminar de la PCH. Comparando los resultados del análisis químico de las dos arcillas, se puede notar la mayor concentración de SiO2 (73.2 %) de la PCH que en la arcilla natural (69.0 %), este aumento solo pudo deberse a la adición de la fuente de silicio al preparar la PCH, el cual se incorporó en el espacio interlaminar de la arcilla natural al cubrir las micelas del surfactante, las cuales previamente desplazaron los cationes intercambiables de la arcilla natural. Lo anterior se ve reflejado, tanto en los resultados de la composición de las dos arcillas en donde el porcentaje de óxidos de calcio, sodio y potasio de la arcilla natural se ve disminuido en la composición química de la PCH, así como en las formulas estructurales de ambas arcillas.


Los resultados de la CIC de la arcilla natural, la muestra P1 y la PCH, se reportan en la Tabla 3. De acuerdo con Weaver y Pollard [25], la CIC de las esmectitas se encuentra en el intervalo de 70-130 meq/100g, por lo que el valor obtenido para la arcilla natural sugiere que ésta puede pertenecer a este grupo. Los resultados correspondientes a la P1 y PCH muestran una CIC residual de 21 y 20 meq/100g respectivamente, lo que indica que un 73 % de los cationes intercambiables de la arcilla natural fueron desplazados por las micelas del surfactante al preparar la PCH.

Los espectros IR de las muestras están en la Fig. 1. El espectro infrarrojo de la arcilla natural presenta el perfil característico de las esmectitas-montmorilonitas [26]. Se observa un pico intenso localizado en 3628 cm−1, que corresponde a la vibración de estiramiento de grupos −OH individuales. En tanto que las vibraciones de los grupos −OH hidratados corresponden a los picos situados en 3444 cm−1 (estiramiento) y en 1635 cm−1 (flexión). Además la banda ancha de vibración de estiramiento del enlace Si-O aparece centrada a 1050 cm−1 y el pico agudo próximo que se observa a 794 cm−1, corresponde a vibraciones de flexión de grupos OH enlazados a Al3+ y Mg2+.

El espectro de la muestra P1 fue similar al de la arcilla natural, sólo que presentó cinco picos adicionales, 3022 cm−1 (C-H estiramiento), 2922 cm−1 (-CH2- estiramiento asimétrico), 2850 cm−1 (-CH2- estiramiento simétrico), 1469 cm−1 (CH2- flexión asimétrica), y 722 cm−1 ((-CH2-)n balanceo n > 4), estos picos revelan la presencia del surfactante agregado a la arcilla natural antes de ser calcinada.
Para la PCH el espectro mostró los mismos picos que el espectro de la arcilla original y ningún pico atribuible al surfactante. Esto significa que el surfactante fue completamente eliminado como consecuencia del proceso de calcinación durante la preparación.
La curva termogravimétrica de la arcilla natural (Fig. 2) mostró el perfil típico de las esmectitas [27]. Se observó una pérdida de peso inicial en el intervalo de 25 a 150 °C, que corresponde a la eliminación de agua adsorbida entre las láminas de silicato. Posteriormente se presentó una meseta (150-500 °C), en la que la pequeña pérdida de peso está relacionada con la remoción de los grupos hidroxilo de los extremos de las láminas de la arcilla, los cuales son más fácilmente removidos que los hidroxilos asociados con la estructura interna de las láminas. Finalmente se apreció otra pérdida de peso en el intervalo de 500 a 750 °C, que corresponde a la deshidroxilación total de la estructura arcillosa [27].

En la gráfica del análisis termogravimétrico diferencial TGD correspondiente a la arcilla natural (Fig. 3), se observa un pico a 110 °C (8.2 % de pérdida de peso), que corresponde a la pérdida de agua inicial y otro pico a 670 °C (3.8 % de pérdida de peso), que corresponde a la pérdida de los OH internos de la estructura arcillosa y por lo tanto refleja el comienzo de la destrucción de dicha estructura. Posteriormente, no se observa cambio significativo de peso, debido a que las reacciones de transformación de fases durante la destrucción completa de la estructura no involucran ganancia o pérdida de peso [27].

En la Fig. 2 también se presentan los termogramas TG de las muestras P1 y PCH. La muestra P1 presenta una pérdida menor de peso con respecto a la arcilla natural, en el intervalo de 0 a 150 °C, lo que puede atribuirse al carácter hidrofóbico de ésta muestra debido a la presencia del surfactante incorporado. Para la PCH, se observa una pérdida menor de peso en todo el intervalo de temperatura estudiado con respecto a la arcilla original. Esto fue confirmado en el análisis TGD, que se muestra en la Fig. 3, en el que no se observa el pico característico asociado con la pérdida de agua adsorbida.
A temperaturas mayores de 150 °C, el termograma TG de la muestra P1 (Fig. 2) presentó una pérdida de peso mucho mayor que la de la arcilla original, lo que puede atribuirse a la eliminación del surfactante intercalado ya que en la gráfica TGD correspondiente (Fig. 3), se observan dos picos localizados a 190 °C (18.4 % de pérdida de peso) y a 250 °C (12.1 % de pérdida de peso), los cuales están relacionados con las diferentes etapas de descomposición de este tipo de surfactante [28].
En la misma figura 3, la muestra P1, presenta finalmente una leve disminución de dP/dT alrededor de 750 °C (3.6 % de pérdida de peso), atribuido a la deshidroxilación completa de la estructura, aunque debido a la última etapa de eliminación del surfactante, no presentó buena resolución por el traslapamiento de las correspondientes pérdidas de peso.
En el análisis TGD de la PCH (Fig. 3) no aparece el pico típico de la pérdida de agua adsorbida (0 a 150 °C) lo que puede deberse a un cierto carácter hidrofóbico desarrollado por la muestra, debido a la probable formación de grupos siloxano [28]. En la Fig. 3, también se observan dos picos, a 650 °C (6.2 % de pérdida de peso) y a 830 °C (2.2 % de pérdida de peso), que corresponden a la destrucción total de la estructura.
La Fig. 4 muestra el perfil XRD de la arcilla natural, el cual es típico de las esmectitas-montmorilonitas con pequeñas cantidades de impurezas. En la Fig. 5 se presenta la primera reflexión d(001) de los difractogramas XRD de la arcilla natural y la PCH y en la Tabla 4 los valores de la distancia basal d(001) e interlaminar Δd correspondientes. El difractograma de la PCH (Fig. 5) presenta un desplazamiento de la señal de la primera reflexión hacia valores menores de 2θ (5.1°) con respecto aquel de la arcilla natural (7.0°), dando distancias interlaminares de 13.7 Å y 3.1 Å, respectivamente. Estos valores representan una expansión de la distancia interlaminar de la arcilla natural debido a la intercalación de las moléculas del surfactante y polimerización de la fuente de silicio.

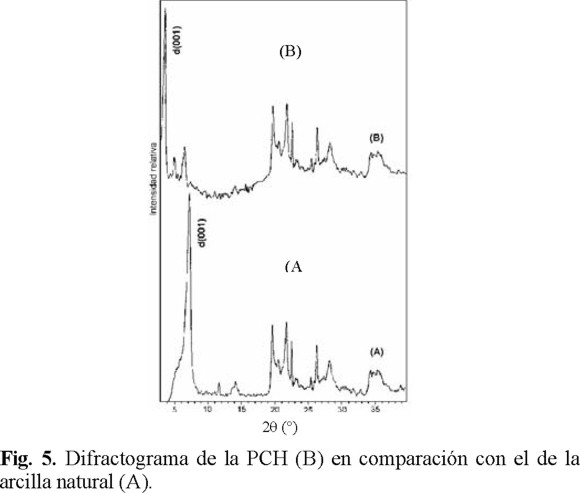

En el difractograma de la PCH se observan también dos picos adicionales con respecto al de la arcilla natural, situados a 5 y 6.5 °, respectivamente. Estos picos pueden representar la formación de otras estructuras, ya que en los materiales MCM aparece una serie de tres picos situados en la misma región, atribuidos a la formación de una estructura hexagonal [5].
La Fig. 6 muestra las isotermas de adsorción-desorción de N2 de las tres muestras arcillosas. En la Tabla 5 se presentan los resultados de superficie específica (calculados por el método BET), así como el diámetro de poro promedio obtenido por el método de desorción de BJH [29].


El tipo de las isotermas de las tres muestras (Fig. 6) es similar, en donde se observa que a una presión de 0.4, se inicia la formación de un lazo de histéresis. De acuerdo a la clasificación de Brunauer [30] y a la reciente extensión de esta clasificación en las subdivisiones I, II y IV [1] estas isotermas pueden ser clasificadas de Tipo IIb. Esta figura muestra una mayor capacidad de la PCH de adsorber N2 que la P1 y la arcilla natural.
La superficie específica de la arcilla natural (43.6 m2 / g) (Tabla 5), se encontró dentro del intervalo reportado para las esmectitas (30 a 100 m2 / g,) [24], lo cual sugiere en concordancia con los resultados de difracción de rayos X, que la arcilla pertenece a este grupo. En cuanto al diámetro de poro promedio, la arcilla natural tuvo un valor de 17.4 Å, dentro del intervalo de los materiales microporosos de acuerdo a la clasificación de Dubinin [31]: microporos < 20 Å; mesoporos 20-500 Å; macroporos >500 Å.
Por otra parte, la superficie específica de la PCH de 305.5 m2 / g (Tabla 5) representa un aumento del 700 % con respecto aquella de la arcilla natural (43.6 m2 / g). Este incremento de superficie específica muy probablemente se debió a la expansión de la región interlaminar de la arcilla natural y a la superficie de los pilares intercalados de silicato, provocado esto por la intercalación previa de las micelas del surfactante en el proceso de preparación de la PCH. El diámetro de poro promedio de la PCH preparada fue de 37.2 Å, que según la clasificación de Dubinin [31] corresponde a un material mesoporoso. Sin embargo, este diámetro de poro es solo ligeramente superior a 20 Å que es el límite para microporos, lo cual indica que si bien hay mesoporos en la PCH, existe una gran contribución de microporos, lo cual se refleja en su isoterma tipo IIb de la Fig. 6.
La superficie específica de la muestra P1 fue de 10.6 m2 / g y un diámetro de poro promedio de 14.3 Å, lo cual es menor a la correspondiente de la arcilla natural, lo que puede atribuirse a la presencia del surfactante en el espacio interlaminar de la arcilla natural bloqueando el acceso del N2 y su adsorción en la superficie interna de la arcilla, lo cual también se ve reflejado en la disminución del diámetro de poro promedio de la muestra P1.
Conclusión
El procedimiento propuesto en el presente trabajo demostró ser efectivo en la preparación de una Arcilla Porosa de Estructura Heterogénea (PCH) con un carácter parcialmente mesoporoso (diámetro de poro promedio 37.2 Å) y con una gran superficie específica (305.5 m2/g), mayor en un 700 % que la obtenida por la arcilla natural (43.6 m2 / g) que le dio origen, lo que le proporciona gran atractivo como adsorbente, con posibilidades para su aplicación al tratamiento de efluentes.
Referencias
1. Roquerol, F.; Roquerol, J.; Sing, K. Adsorption by Powders and Porous Solids. Academic Press, 1999. [ Links ]
2. Yang, R. Gas Separations by Adsorption Processes. Imperial College Press, 1999. [ Links ]
3. Chi,T. Adsorption Calculations and Modeling. Butterworth-Heinemann. 1994. [ Links ]
4. Pinnavaia, T. J.; Galarneau, A. H.; Barandowalla, A. F. USA Patent 5,726,113, 1998. [ Links ]
5. Inagaki, S.; Fukushima, Y.; Kuroda, K. J. Chem. Soc. Chem. Commun. 1993, 680-682. [ Links ]
6. Galarneau, A. H.; Barodawalla, A.; Pinnavaia, T. J. Nature 1995, 374, 529-531. [ Links ]
7. Vaughan, D. E. W.; Lussier, R. J.; Magee, J. S. USA Patent 4,176,090, 1979. [ Links ]
8. Gallardo, V. T. A Study on Pillared Clays. PhD Thesis. University of Salford, UK., 1990. [ Links ]
9. Arellano, S.; Gallardo, T.; López, S.; Osorio, G. Rev. Soc. Méx. 2002, 46, 120-124. [ Links ]
10. Beck, J. S.; Vartuli, C.; Roth, W. J.; Leonowicz, M. E.; Kresge, C. T.; Schmitt, K. D.; Chu, C. T.; Olson, D. H.; Sheppard, E. W.; Mc Cullen, S. B.; Higgins, J. B.; Schlenker, J. L. J. Am. Chem. Soc. 1992, 114, 10834-10843. [ Links ]
11. Feng, X.; Fryxel, G. E.; Wang, L. K.; Kim, A. Y.; Liu, J.; Kemmer, K. M. Science 1997, 276, 923-926. [ Links ]
12. Zhao, X. S.; Lu, G. Q.; Millar, G. J. Ind. Eng. Chem. Res. 1996, 35, 2075-2090. [ Links ]
13. Yang, H.; Coombs, N.; Ozin, G. A. Nature. 1997, 386 692-695. [ Links ]
14. Gallardo, V.T.; Dyer, A., in: Recent Developments in Ion Exchange. Williams, P.A.; Hudson, M.J., Ed., Elsevier Applied Science, London, 1990, 75-84. [ Links ]
15. Dyer, A.; Gallardo, V.T.; Roberts, C. W., in: Zeolites: Facts, Figures, Future. 49ª, Jacobsand, P.A., Van Santen, R. A., Ed., Elsevier Applied Science, London, 1989, 389-398. [ Links ]
16. Gallardo, V. T.; Arellano, C. S.; Osorio, R. G.; López, C. S. An. Esc. Nac. Cienc. Biol. 2000, 46, 41-52. [ Links ]
17. Zhao, X. S.; Lu, G. Q.; Hu, X. Chem. Commun. 1999, 1391-1392. [ Links ]
18. Cooper, C.; Burch, R. Wat. Res. 1999, 33, 3689-3694. [ Links ]
19. Rathousky, J.; Zukal, A.; Franke, O.; Schulz-Ekloff, G. J. Chem. Soc. Faraday Trans. 1995, 91, 937-940. [ Links ]
20. Yun, J.H.; Duren, T.; Keil, F. J.; Seaton, N. A. Langmuir 2002, 18, 2693-2701. [ Links ]
21. Kresge, C. T.; Leonowicz, M. E.; Roth, W. J.; Vartuli, J. C.; Beck, J. S. Nature 1994, 359, 710-715. [ Links ]
22. Jeffery, P. G.; Hutchison, D. Chemical Methods of Rock Analysis. Pergamon Press, 1981. [ Links ]
23. Bain, D.C.; Smith, B. F. L., in: A Handbook in Determinative Methods in Clay Mineralogy. Wilson, M. J., Ed., Blackie and Sons Ltd. 1987, 248-250. [ Links ]
24. Nemecz, E. Clay Minerals. Akadémiai Kiadó. Budapest, 1981. [ Links ]
25. Weaver; C. E.; Pollard, L. D. The Chemistry of Clay Minerals. Developments in Sedimentology. Elsevier, 1973. [ Links ]
26. Srasra, E.; Bergaya, F.; Fripiat, J. J. Clay and Clay Minerals. 1994, 42, 237-241. [ Links ]
27. El-Akkad, N. S.; Flex, N.S.; Guindy, N. M.; El-Massry, S.; Nashed, S. Thermochimica Acta. 1982, 59, 9-17. [ Links ]
28. Zhao, X. S.; Lu, C. Q.; Millar, G. J.; Whittaker, A. K.; Zhu, H. Y. J. Phys. Chem. B. 1997, 101, 6525-6531. [ Links ]
29. Barret, E. P.; Joyner, L. H.; Halenda, P. H. J. Am. Chem. Soc. 1951, 73, 373-380. [ Links ]
30. Brunauer, S.; Deming, L. S.; Deming, W. E.; Teller, E. J. Amer. Chem. Soc. 1940, 62, 1723-1728. [ Links ]
31. Dubinin, M.M. Chem. Rev. 1960, 60, 235-238. [ Links ]














