Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 no.2 Ciudad de México abr./jun. 2003
Investigación
Estudio fitoquímico de Salvia uruapana†
René Manjarréz, Bernardo A. Frontana-Uribe y Jorge Cárdenas*
Instituto de Química, Universidad Nacional Autónoma de México, Circuito Exterior Ciudad Universitaria, Coyoacán 04510, México D.F. Tel. +52 (55) 5622-4413; Fax. +52 (55) 5616-2217. E-mail: rjcp@servidor.unam.mx
Recibido el 20 de junio del 2003.
Aceptado el 14 de julio del 2003.
En homenaje a los 50 años de vida académica del Dr. Alfonso Romo de Vivar.
Resumen
De las partes aéreas de Salvia uruapana se aislaron dos diterpenos, salviafaricina y tonalensina ambos previamente descritos en Salvia tonalensis, así como 7-O-luteolina diglucósido peracetilado. La mezcla de los ácidos oleanólico y ursólico se aisló de las fracciones de baja polaridad.
Palabras clave: Salvia uruapana; Labiatae; Diterpenos; neo-clerodano; 5-10-seco-neo-clerodano; flavona; triterpenos.
Abstract
From the aerial parts of Salvia uruapana were isolated two diterpenic compounds previously isolated from Salvia tonalensis: salvifaricin and tonalensin, as well as the peracetylated 7-O-luteolin diglucoside. The mixture of oleanolic and ursolic acids was also isolated from the low polarity fractions.
Keywords: Salvia uruapana; Labiatae; Diterpenos; neo-clerodane; 5-10-seco-neo-clerodane; flavone; triterpenoids.
Introducción
El género Salvia, miembro de la familia Labiatae, consta de aproximadamente 900 especies en el mundo. En México existen más de 300 salvias que se encuentran predominantemente en bosques de pinos-abeto y encino por encima de los 1000 m de altura, lo que hace de México uno de los países con mayor diversidad botánica en este género [1].
De los estudios fitoquímicos de especies americanas del género Salvia se han obtenido diterpenos con esqueleto de tipo clerodano, abietano y pimarano, además de los esqueletos modificados como riacofano y tilifolano, que se propone provienen de precursores clerodánicos. Se han obtenido otros compuestos como flavonoides, ácidos triterpénicos y β-sitosterol por mencionar algunos otros. Esta gran riqueza y diversidad fitoquímica, aunada a la abundancia de especies de este género en nuestro país, ha alentado la búsqueda de compuestos con propiedades biológicas interesantes en plantas de este género. Algunas especies vegetales pertenecientes a este género se han utilizado con fines medicinales por sus propiedades antitumorales, bactericidas, bacteriostáticas, carminativas, entre otras [2].
Continuando con estudios fitoquímicos realizados en plantas del género Salvia endémicas de México [3, 4], en este trabajo se presentan los resultados del estudio de Salvia uruapana (Fern.) Labiatae. Esta planta crece en la zona central de México, encontrándose abundantemente en los estados de Michoacán, Jalisco y Colima. Es una hierba con flor azul intenso, de talla moderada (40-60 cm) que crece en zonas altas (> 1300 msnm) y húmedas.
Discusión de resultados
El producto blanco cristalino mostró en el espectro de IR las señales características de un furano monosubstituido (1505 y 875 cm−1) y de una γ-lactona α,β-insaturada (1755, 1670 cm−1). Con la espectroscopia de RMN y experimentos bidimensionales RMN 1H-RMN 13C, se logró la determinación de la estructura 1 para este compuesto. Este ha sido reportado previamente de la partes aéreas de Salvia farinacea asignándole el nombre de salvifaricina [9]. Se observaron claramente las señales reportadas como típicas para este compuesto en el espectro de RMN 1H, como son las generadas por la sustitución β del anillo de furano, el sistema de metilo secundario entre C-8 y C-17, el sistema A-B del metileno de la γ-lactona α,β-insaturada y el protón cetálico de C-20. En el primer reporte de 1 se describe parcialmente la espectroscopía de RMN y es en un reporte reciente [5] donde se confirman las asignaciones y se completan los datos espectroscópicos faltantes, mismos que concuerdan correctamente con los obtenidos para el compuesto 1.

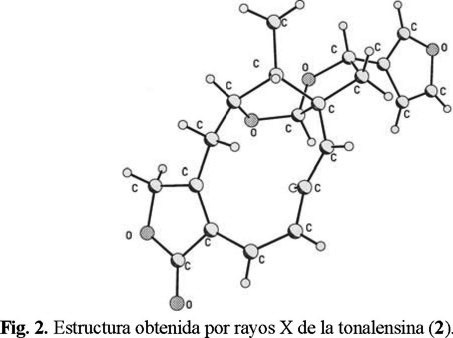
De las aguas madres de donde se obtuvo el producto anterior, se logró aislar por cristalización otro producto que mostró tener un espectro de RMN 1H y RMN 13C complicado. Al variar la temperatura, este último mostró cambios importantes por lo que se sospechó la presencia de confórmeros. Mediante el estudio de cristalografía de Rayos-X de un monocristal (Fig. 2), se logró obtener la estructura 2 para el compuesto aislado. Este producto ha sido reportado previamente del estudio fitoquímico de Salvia tonalensis y se denominó tonalensina [10]. Los datos reportados en el estudio cristalográfico y los obtenidos en este estudio concuerdan, así como las señales reportadas para los espectros de RMN 1H y RMN 13C [6].
La salvifaricina podría derivarse de la tonalensina vía la fusión de los anillos A y B mediante un reacción electrocíclica del compuesto 2 permitida térmicamente [7]. Con el fin de verificar esta hipótesis, la tonalensina se sometió a reflujo durante 48 h en diferentes disolventes monitoreando la reacción por ccf. En tolueno (p.eb. 110 °C) y 1,1,2,2-tetracloroetano (p.eb. 142 °C) no hubo reacción; en decalina (mezcla de isómeros p.eb. 183 °C) se observó descomposición del producto, pero ninguno de los productos observados en la placa correspondió a la salvifaricina. Esto demostró que el simple calentamiento del producto no induce la reacción y se requiere la presencia de otro tipo de catalizadores, tal vez del tipo enzimáticos, que se podrían encontrar en la planta.
La acetilación de la fracción de 20 % metanol en acetato de etilo permitió obtener un compuesto peracetilado. Este compuesto mostró claramente en RMN 1H el patrón de señales para dos sistemas aromáticos, uno de ellos tetrasubstituido y el otro trisubstituido, además del protón singulete característico de las flavonas. Diez grupos hidroxilo fueron identificados mediante las correspondientes señales de los acetatos (δ 1.99-2.40). Las glucosas fueron identificadas mediante las dos señales en RMN 13C de los carbonos CH2 base de oxígeno y los dos dobletes en RMN 1H típicos del protón anomérico del sistema disacárido. Los sistemas observados son característicos de la luteolina 7-O-diglucósido, compuesto frecuentemente encontrado en los productos naturales [8]. El compuesto mostró un pico molecular en 1030 uma que confirmó a la luteolina con un disacárido de dos glucosas.
S. uruapana pertenece a la sección Angulatae del subgénero Calosphace y S. tonalensina y pertenecen a la sección Polystachyae del mismo subgénero [1]. El hecho de haber encontrado los mismos productos reportados en dos secciones diferentes podría indicar una relación botánica muy cercana de ambas plantas.
Parte experimental
La Salvia uruapana (Fern.) fue obtenida por Bernardo A. Frontana Uribe y Dagoberto Alavés en el camino de Teretán hacia Zirimícuaro, Edo. de Michoacán, México en noviembre de 1999. El especimen fue identificado por la Biol. Irene Díaz del Instituto de Biología UNAM y se depositaron dos ejemplares en el herbario del mismo Instituto con el registro MEXU 967718 y 967719.
Los puntos de fusión no están corregidos y fueron determinados en un equipo Fisher-Johns. Los espectros de IR se obtuvieron con un espectrofotómetro Nicolet Magna 750. Las espectrometrías de masas de baja resolución se obtuvieron con la técnica de impacto electrónico a 70 eV en un equipo Jeol JMS-AX 505. Las espectrometrías de alto peso molecular se obtuvieron con la técnica FAB+ con un equipo Jeol JMS-SX 102A. Los experimentos de 1H RMN (300 MHz) y 13C RMN (75 MHz) se obtuvieron con un equipo Varian Unity 300 y con TMS como estándar interno empleando como disolvente deuterocloroformo. Las cromatografías de placa fina (CCF) se realizaron en hojas de aluminio precubiertas con sílica gel (Macherey-Nagel Alugram Sil G / UV254). Las cromatografías Flash se realizaron empleando sílica gel (Merck 60 0.030-0.075 mm) y las cromatografías al vacío empleando sílica gel para cromatografía en placa fina (Merck 60).
Extracción y aislamiento
2.98 kg de planta seca se sometieron a maceración con acetona, se evaporó el disolvente obteniendo 21.5 g de residuo acetónico. Se cromatografió en columna al vacío empacada con sílice en una proporción de 1 a 10 con respecto al peso del residuo obtenido. La elución se efectuó iniciando con hexano, y mezclas hexano-acetato de etilo de polaridad creciente, acetato de etilo y finalmente con mezclas acetato de etilo-metanol de polaridad creciente hasta un 20 % de metanol. La mezcla de los ácidos triterpénicos ursólico y oleanólicos se separó de las fracciones con polaridad 20-40 % de AcOEt. De la fracción obtenida con 50 % de AcOEt en hexano y por recristalización por par de disolventes con CH2Cl2 y éter (1:1), se purificó la salvifaricina (1). De las aguas madres de esta misma fracción y con recristalización por par de disolventes con CH2Cl2 y éter (1:1) se aisló la tonalensina (2). De la fracción obtenida con 25 % de hexano en AcOEt, mas los restos de la fracción anterior, se obtuvo la mezcla de los ácidos ursólico y oleanólico con un p.f. 225-228 °C. Finalmente, mediante la acetilación con anhídrido acético y piridina de la fracción de 20 % metanol en acetato de etilo, se obtuvo el derivado peracetilado de la luteolina 7-O-diglucósido (3).
Salvifaricina (1): p.f. 214-216 °C (lit. p.f. 214-215°C [9]), IR (CHCl3) νmax cm−1: 3050, 2964, 2943, 2904, 1755, 1670, 1579, 1505, 1465, 1238, 1164,1052, 1008, 980, 875. EM m/z (abundancia relativa) M+ 340 (100), 282 (22), 259 (26), 244 (23), 217 (44), 189 (22), 163 (100), 135 (72), 95 (97), 81 (61), 77 (25), 55 (26), 39 (16).
Tonalensina (2): p.f. 192-194 °C (lit. p.f. 191-193 °C [10]), IR (CHCl3) νmax cm−1: 1750, 1635, 1502, 1465, 1350, 1313, 1148, 1022, 946, 875. EM m/z (abundancia relativa) M+ 340 (73), 322 (13), 294 (42), 279 (22), 265 (24), 217 (59), 201 (54), 185 (50), 171 (45), 141 (42), 128 (54), 115 (53), 94 (100), 81 (78), 77 (53), 65 (33).
Luteolina 7-O-[β-D-Glucopiranosyl-D-Glucopiranósido] (3): p.f. 121-124 °C; IR (CHCl3) νmax cm−1: 3100, 2940, 2877, 1756, 1645, 1617, 1428, 1370, 1119, 1072, 1039. 1H RMN CDCl3 δ J (Hz): 6.58 (s, 1H, H-3), 6.71 (d, 1H, J = 2.6, H-6), 7.0 (d, 1H, J = 2.6, H-8), 7.77 (d, 1H, J = 2.2, H-2'), 7.36 (d, 1H, J = 8, H-5'), 7.71 (d, 1H, J = 8, 2.2, H-6'), 5.33-4.9 (m, 6H), 4.73 (d, 1H, J = 2), 4.33-3.66 (m, 7H), 2.43-1.99 (10s, 30H); 13C RMN CDCl3 δ 167.2 (C-2), 102.3 (C-3), 176.1 (C-4), 160.5 (C-5), 100.8 (C-6), 167.9 (C-7), 98.3 (C-8), 158.3 (C-9), 108.9 (C-10), 129.8 (C-1'), 121.5 (C-2'), 144.7 (C-3'), 150.6 (C-4'), 124.2 (C-5'), 124.5 (C-6'), 20.37 q, 20.57 q, 21.09 q, 29.17 q, 29.66 q, 61.5 t, 61.88 t, 68.01 d, 68.15 d, 71.05 d, 71.9 d, 72.0 d, 72.7 d, 74.05 d, 109.6 d, 112.6 d, 160.3 s, 169.3 s, 169.4 s, 169.6 s, 169.8 s, 170.3 s, 170.5 s. EM FAB+, m/z (abundancia relativa): [M++1] 1031 (28), 989 (12), 619 (2), 550 (2), 522 (2), 413 (5), 371 (31), 331 (42), 289 (12), 169 (86) 154 (55), 136 (55), 127 (28), 109 (109), 84 (19), 77 (18), 69 (19), 55 (23), 43 (100).
Agradecimientos
Los autores agradecen a las siguientes personas por su ayuda en la obtención de los datos espectroscópicos: Javier Pérez, Nieves Zavala, Alejandrina Acosta, Rocío Patiño y Alfredo Toscano; a Irene Díaz por la clasificación del especimen vegetal y a Carmen Márquez por su ayuda en la separación por cromatografía preparativa. Este trabajo fue parcialmente financiado con el proyecto CONACyT J34873-E.
Referencias
1. Epling, C. Repert. Spec. Nov. Regni Veg. 1939, 110, 1-383. [ Links ]
2. Esquivel, B.; Calderón, J.S.; Sánchez, A.A., Ramamoorthy, T.P.; Flores, E.A., Domínguez, R.M.; Rev. Latinoamer. Quím. 1996, 24, 44-64. [ Links ]
3. Rodríguez-Hahn, L.; Esquivel, B.; Cárdenas, J. En: Secondary metabolites from Mexican plants: Chemistry and Biological, Properties, Rodríguez-Hahn, L. Ed., Signpost, New Deli, India, 1996, p. 19. [ Links ]
4. Rodríguez-Hahn, L.; Esquivel, B.; Cárdenas, J. En: Phytochemistry of Medicinal Plants, Arnason, J.T. Ed. Plenum Press, New York EUA, 1995, Cap. 12, p. 311. [ Links ]
5. Rodríguez, B. Mag. Reson. Chem. 2001, 39, 150-154. [ Links ]
6. Ortega, A.; Maldonado, E.; Díaz, E.; Reynolds W. F. Spectrochim. Acta A 1998, 54, 659-670. [ Links ]
7. March, J. Advanced Organic Chemistry, 4a Ed. John Wiley and Sons, USA, 1992, p.1110. [ Links ]
8. Imperato,F.; Nazzaro, R. Phytochemistry 1996, 41, 337-338. [ Links ]
9. Rodríguez, B.; Pascual, C.; Savona G. Phytochemistry 1984, 23, 1193-194. [ Links ]
10. Toscano, R. A.; Maldonado, E.; Ortega, A. J. Chem. Crystal. 1996, 26, 239-242. [ Links ]
Notas
†Contribución No 1768 del Instituto de Química, UNAM.




![Synthesis and Properties of 2-diazo-1-[2-(thiophen-2-ylmethoxy)-phenyl]-ethanone. Intramolecular Cyclization Through a Carbenoid Intermediate](/img/es/prev.gif)









