Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 n.2 Ciudad de México Apr./Jun. 2003
Investigación
Cumarinas presentes en especies del género Casimiroa
Aída N. García-Argáez,1 Nadia M. González-Lugo,2 Carmen Márquez2 y Mariano Martínez-Vázquez2*
1 Departamento de Ecología y Recursos Naturales, Facultad de Ciencias, Universidad Nacional Autónoma de México, Circuito Exterior, Ciudad Universitaria, Coyoacán 04510, México D. F.
2 Instituto de Química, Universidad Nacional Autónoma de México, Circuito Exterior, Ciudad Universitaria, Coyoacán 04510, México D. F. Tel: +(52) 56224403; Fax: + (52) 56162203. E-mail: marvaz@servidor.unam.mx
Recibido el 21 de abril del 2003.
Aceptado el 13 de junio del 2003.
Dedicado al Dr. Alfonso Romo de Vivar.
Resumen
Los extractos orgánicos de hojas y semillas de Casimiroa pubescens, C. edulis y C. calderoniae se analizaron mediante cromatografía líquida de alta resolución; los resultados mostraron la presencia de las cumarinas felopterina (6), isopimpinelina (9), heraclenol (15) y heraclenina (16) en las tres especies estudiadas. En promedio la mayor concentración de este tipo de metabolitos se presentó en C. calderoniae. Estos resultados, además de los previamente reportados en la literatura indican la presencia de 16 cumarinas en el género. Aun cuando se ha postulado que las cumarinas aisladas del género Casimiroa tienen como precursor común a la umbeliferona, existe una clara diferencia entre las cumarinas sintetizadas por C. greggii y al resto de las especies estudiadas. Así la seselina y el O-geranilostenol, ambas provenientes de la umbeliferona prenilada en C-8, son sintetizadas por C. greggii, mientras que las furanocumarinas sintetizadas por las demás especies tienen como precursor a la umbeliferona prenilada en C-6. El presente trabajo constituye el primer estudio fitoquímico de C. pubescens y C. calderoniae.
Palabras clave: Casimiroa, cumarinas, Rutaceae, umbeliferona.
Abstract
Leaf and seeds extracts of Casimiroa pubescens, C. edulis and C. calderoniae were analyzed by HPLC. The results showed that coumarins phellopterin (6), isopimpinellin (9), heraclenol (15) and heraclenin (16) were present in all species studied. Of all species, C. calderoniae showed the highest concentration of this type of metabolites. These results, in addition to those previously reported, indicate that 16 different coumarins occur in the genus. Even though it has been proposed that the umbelliferone is a common precursor in the biogenesis of the Casimiroa coumarins, there is a clear difference between the coumarins synthesized by C. greggii and those present in the rest of the species. Thus, seselin and O-geranylosthenol, both synthesized from an umbelliferone prenylated at C-8, are present in C. greggii, while the coumarins present in the other species originate from umbelliferone prenylated at C-6.
This is the first study of C. pubescens and C. calderoniae.
Keywords: Casimiroa, coumarins, Rutaceae, umbelliferone.
Introducción
Las cumarinas son probablemente los metabolitos más comunes derivados de la ruta biosintética del shikimato-corismato (1). En miembros de la familia Rutaceae se han encontrado aproximadamente 200 cumarinas y las evidencias experimentales han demostrado que éstas se sintetizan por las mismas rutas biosintéticas observadas en otras familias de plantas, donde la umbeliferona se considera el intermediario común para la biosíntesis de cumarinas lineales y angulares (2).
El principal factor de diversificación estructural de las cumarinas en las Rutaceae es la amplia incorporación de unidades prenilo al núcleo cumarínico; en algunas especies de esta familia se ha demostrado que la prenilación ocurre cuando se ha formado la umbeliferona (1, 2). Las modificaciones secundarias sobre los grupos prenilo, usualmente iniciadas por epoxidación del doble enlace, contribuyen a esta diversificación estructural de manera importante. La transformación del doble enlace al diol respectivo en la cadena prenilada lateral, teniendo al epóxido como intermediario, ha sido demostrada con marcadores radioactivos (1).
Se ha postulado que las furano- y pirano-cumarinas se forman biogenéticamente cuando al núcleo cumarínico se adiciona un grupo prenilo y éste interacciona con un grupo ortofenólico, de tal modo que se generan diferentes estructuras con un anillo heterocíclico adicional. Con base a lo anterior se ha propuesto que una prenilación en la posición 6 de la umbeliferona da origen a las furanocumarinas lineales como el psoraleno, mientras que una prenilación en la posición 8 da origen a las furanocumarinas angulares como la angelicina (3).
Algunos autores argumentan que las pirano- y furano-cumarinas, tanto lineales como angulares, comparten caminos biosintéticos y solo se diferencian en la etapa final de ciclización; lo anterior se ha demostrado experimentalmente, utilizando marcadores radioactivos, en la elucidación de la transformación biogenética de la demetilsuberosina a psoraleno en Ruta graveolens (3).
En el presente trabajo se dan a conocer los resultados del análisis por cromatografía de líquidos de alta resolución, de las cumarinas presentes en extractos de hojas y semillas de Casimiroa pubescens, C. edulis y C. calderoniae. Adicionalmente se comparan los resultados obtenidos, con los diferentes tipos de cumarinas presentes en C. greggii.
Resultados y discusión
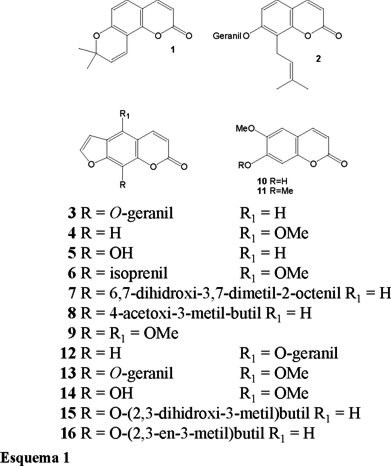
Los resultados del análisis cromatográfico indicaron la presencia de las cumarinas felopterina (6), isopimpinelina (9), heraclenol (15) y heraclenina (16), tanto en hojas como en semillas de las tres especies estudiadas (Tabla 1). La presencia de estos compuestos se comprobó mediante procedimientos de co-cromatografía. Sin embargo, no se detectó la presencia de la seselina (1), cumarina previamente aislada de C. greggii (5). El análisis de resultados para cada especie se presenta por separado.
C. pubescens. El extracto de las hojas de esta especie mostró a la heraclenina como la única y más abundante cumarina presente en los cinco individuos estudiados; la felopterina se detectó en cuatro individuos, mientras que la isopimpinelina se encontró en dos individuos y el heraclenol solamente en uno. La misma tendencia se observó en el análisis del extracto de semillas.
Estos resultados indicaron que en esta etapa de crecimiento de las plantas, y en este sitio de colecta, la especie acumula y/o sintetiza preferentemente heraclenina y felopterina (Fig. 1).

C. edulis. El estudio del extracto de las hojas de esta especie mostró una presencia abundante de las cuatro cumarinas de referencia (6, 9, 15 y 16). Por otra parte, en el extracto de las semillas, la presencia de las cuatro cumarinas fue escasa; la única cumarina presente en todos los individuos fue la felopterina mientras que el heraclenol solamente se detectó en un solo individuo (Fig. 1).
C. calderoniae. Los resultados del análisis de esta especie muestran un patrón similar al observado en C. pubescens, i.e. la presencia de 6, 9, 15 y 16, tanto en frecuencia como en concentración, es mayor en las hojas que en las semillas. Sin embargo son notables las altas concentraciones de heraclenina (20.9 mg / g) y de felopterina (23.8 mg / g) en el extracto de hojas (Fig. 1).
Estos resultados combinados con los reportados previamente, demuestran la presencia de 16 cumarinas en el género (Tabla 1) (2, 5-10).
La presencia de 10 y 11 en el género se puede considerar un hecho poco frecuente ya que solo la C. edulis sintetiza este tipo de cumarinas.
La distribución del resto de las cumarinas en el género indican claramente que difieren en el sitio de prenilación; en C-8 en C. greggii como en 1 y en C-6 en C. edulis, C. pubescens, C. pringlei y C. calderoniae, como en 3-9.
Conclusión
Los resultados de las tres especies estudiadas indican que la presencia de 6, 9, 15 y 16, pero no de 1, previamente aislada de C. greggii. No obstante existen diferencias notables en los resultados de los análisis de hojas, así en C. pubescens y C. calderoniae las cumarinas con mayor presencia fueron heraclenina (16) y felopterina (6). Sin embargo, la concentración de estas cumarinas fue del orden de cien veces más en C. calderoniae que en C. pubescens.
Hasta el momento, las cumarinas aisladas del género Casimiroa indican que tienen como precursor común a la umbeliferona, propuesta biogenética que es general a la familia Rutaceae (2). Sin embargo, tomando en cuenta nuestros resultados y lo reportado hasta el momento, existe una clara diferencia de la distribución entre las cumarinas sintetizadas por la C. greggii y las especies C. edulis, C. pringlei, C. pubescens y C. calderoniae.
Parte experimental
Se realizaron los análisis a cinco individuos de cada especie, recolectados en el mismo sitio y en etapa de fructificación. Las cumarinas 1, 6, 9, 15 y 16, utilizadas como metabolitos secundarios de referencia, se aislaron previamente de Decatropis bicolor (Rutaceae) (4).
Material biológico. Se colectaron cinco individuos de cada especie, y los ejemplares de herbario se depositaron en el Herbario de la Facultad de Ciencias de la Universidad Nacional de México, (FCME). Casimiroa edulis se colectó en el Mpio. de Comala, Colima, en julio de 2000 (Nos. de registro del herbario 84847, 84849-84852). C. pubescens se colectó en Ixmiquilpan, Hidalgo, en junio de 2000 (Nos. de registro 84835-84839), y C. calderoniae en la zona árida oaxaqueño-poblana, Oaxaca, en octubre de 2000, (Nos. de registro 84876-8480).
Cromatografía Líquida de Alta Resolución. La cromatografía líquida de alta resolución (CLAR) se efectuó en un cromatógrafo de líquidos Waters modelo Delta PREP 4000, equipado con detector UV modelo 486 que se mantuvo a una longitud de onda de 310 nm. Se utiliizó 1 mL / min de flujo del disolvente. Se utilizó MeOH / H2O 50/50 en gradiente hasta MeOH / H2O 90/10 en 20 min. Para el procesamiento de los datos se utilizó el software Millenium (Waters).
Estándares y curvas de calibración. Se utilizaron estándares de seselina (1), felopterina (6), isopimpinelina (9), heraclenol (15) y heraclenina (16), aislados previamente de Decatropis bicolor (4). De cada cumarina se prepararon disoluciones en acetato de etilo a concentraciones de 2.9, 2.6, 2.6, 2.7 y 3.6 mg / mL, respectivamente. Las soluciones estándar se utilizaron para preparar cinco diluciones de cada cumarina en el rango de 0.013 a 0.13 mg / mL. Las curvas de calibración se prepararon inyectando, por triplicado, las diferentes diluciones estándar. Los coeficientes de correlación (r2) para cada gráfica de cada cumarina se calcularon teniendo valores para r2 mayores a 0.997.
Obtención y análisis de los extractos hexánico y metanólico. Hojas o semillas secas y molidas de cada individuo se extrajeron tres veces con hexano, por maceración a temperatura ambiente durante 24 h. Los extractos se combinaron y después de evaporar el disolvente a presión reducida se obtuvo el extracto hexánico. Este procedimiento se repitió utilizando metanol para obtener el extracto metanólico correspondiente a cada muestra. De cada extracto se prepararon disoluciones de concentración conocida y se inyectaron en el cromatógrafo de líquidos. Con el fin de identificar la presencia de las cumarinas de referencia a las muestras analizadas se les adicionaron cantidades conocidas de las soluciones estándar. Para el procesamiento de los datos se empleó el software Millenium (Waters), que calcula la cantidad de cada componente presente en cada mililitro de disolución inyectada, tomando como base las curvas de calibración preparadas con los estándares. La cantidad de cada cumarina presente en el extracto hexánico se suma a la de la cumarina correspondiente presente en el extracto metanólico y de esta manera se obtiene el rendimiento de cada producto por gramo de planta seca.
Agradecimientos
Los autores agradecen el apoyo en el financiamiento parcial del CONACyT (proyecto No. 34992-N) y la Beca de PASPA, DGAPA para los estudios de doctorado de la M. en C. García-Argáez.
Referencias
1. Dewick, P.M. Nat. Prod. Rep. 1994, 11, 173-203. [ Links ]
2. Gray, A. I.; Waterman, P.G. Phytochem. 1978, 17, 845-864. [ Links ]
3. Murray, R.; Méndez, J.; Brown, S. The Natural Coumarins, John Wiley & Sons Ltd.; Norwich; 1982; 163-185. [ Links ]
4. García-Argáez, A. N.; Ramírez, A. T. O.; Parra, D. H.; Velázquez, G.; Martínez-Vázquez, M. Planta Medica 2000, 66, 279-281. [ Links ]
5. Meyer, B. N., Wall, M.E., Wani, M.C., Taylor, H.L. J. Nat. Prod. 1985, 48, 952-956. [ Links ]
6. Castellanos, S. V. Tesis FES Zaragoza, UNAM, México, 1998. 124 pp. [ Links ]
7. Rizvi, S. H.; Kapil, R.S.; Shoe, A. J. Nat. Prod. 1985, 48, 146. [ Links ]
8. Iriarte, J.; Kincl, F.A.; Rosenkranz, G.; Sondheimer, F. J. Chem. Soc. 1956, 4170-4173. [ Links ]
9. Kincl, F.; Romo, J.; Rosenkranz, G.; Sondheimer, F. J. Chem. Soc., 1956, 4163-4169. [ Links ]
10. Enríquez, R. G.; Romero, M. L.; Escobar, L. I.; Joseph-Nathan, P.; Reynolds, W. F. J. Chrom., 1984, 287, 209-214. [ Links ]














