Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 no.1 Ciudad de México ene./mar. 2003
Investigación
Transferencia de carga a través de la interfase de dos soluciones electrolíticas inmiscibles: fundamento y caso de estudio
Miguel Velázquez Manzanares
Universidad del Mar, Ciudad Universitaria s/n, Puerto Ángel, Distrito de Pochutla, Oaxaca, 70902, México. mmiguel@angel.umar.mx
Recibido el 7 de febrero del 2003.
Aceptado el 28 de marzo del 2003.
Resumen
En el presente trabajo se discute la transferencia de carga a través de dos soluciones electrolíticas inmiscibles (sistemas IDSEI). Inicialmente, se exponen los antecedentes y el fundamento de la extracción líquido-líquido mediante técnicas electroquímicas. Posteriormente, se discute la transferencia del catión orgánico tetrametilamonio (TMA+) a través de la interfase agua-1,2-dicloroetano, con el fin de caracterizar las celdas electroquímicas utilizadas en este tipo de sistemas. Finalmente y como caso de estudio, se analiza la transferencia del H+ facilitada por la amina 4-octilanilina a través de la interfase agua-1,2-dicloroetano. De esta manera, se muestra que el uso de la IDSEI puede ser una valiosa herramienta para explicar los mecanismos de transferencia de carga en sistemas hidrofóbicos.
Palabras clave: IDSEI, voltamperometría cíclica y transferencia de protones.
Abstract
In this work is discussed the charge transfer across the two immiscible electrolyte solutions (ITIES). It is considered the background of liquid-liquid extraction by electrochemical techniques. The electrochemical cell for liquid-liquid studies was tested using the tetrametylammonium cation (TMA+) transfer across water-1,2-dichloroethane interface in order to find the better response of the cell. Finally, a proton transfer facilitated by the amine 4-octylaniline across the water-1,2-diclhoroethane interface was studied. This experiments shown that the 4-octylaniline is able to facilitated proton transfer at the liquid-liquid interface. The present work shows the ITIES as a useful tool to explain the charge transfer mechanism across the hydrophobic environment.
Keywords: ITIES, cyclic voltammetry and proton transfer.
Introducción
Los primeros estudios de transferencia de especies cargadas a través de sistemas bifásicos se realizaron a principios del siglo pasado [1]. En tales experimentos, se observó la transferencia de un electrolito coloreado en un sistema agua-fenol-agua mediante la aplicación de un campo eléctrico. Este hecho marcó los inicios de los estudios de transferencia de cargas a través de dos solventes inmiscibles; sin embargo, no fue hasta la década de los 60 cuando este tipo de sistemas comenzó a investigarse con mucho más interés, debido a las posibles aplicaciones que pudieran tener en diversas áreas de la química y la biología.
Un sistema de dos soluciones electrolíticas inmiscibles como tal (IDSEI), se genera al tener electrolitos en un sistema bifásico y controlar la distribución de los iones a través de la interfase mediante la aplicación de un potencial eléctrico. La interfase que se forma entre el agua y el solvente orgánico debe estar bien definida. Por otro lado, el solvente orgánico debe presentar una constante dieléctrica adecuada, que le permita mantener los iones en solución. Hoy en día se han estudiado diversos solventes orgánicos en este tipo de sistemas, entre los cuales destacan el 1,2-dicloroetano, nitrobenceno, 2-heptanona y 2-octanona.
La electroquímica de dos soluciones electrolíticas inmiscibles surgió como tal después de los estudios realizados por Koryta y cols., (1977) [2], quienes postularon que la IDSEI se comporta como un electrodo sólido inmerso en una solución. Por tal motivo, propusieron que este tipo de sistemas fuese estudiado en forma similar a un sistema metal-solución, usando las técnicas de la electroquímica convencional (voltamperometría cíclica, etc).
Aplicaciones de la IDSEI
Una de las aplicaciones potenciales más interesantes de la IDSEI está en la recuperación selectiva de metales pesados [3, 4]. Al aplicar un potencial a través de la interfase, se manipula el equilibrio de reparto de los iones metálicos, lo cual permite concentrarlos en una de las fases y después recuperarlos para su tratamiento posterior. Por otro lado, se han realizado interesantes estudios de la transferencia de carga a través de las membranas biológicas [5]. Este evento resulta de gran importancia, dado que la producción de energía en las mitocondrias (organelos especializados) se presenta gracias a un gradiente electroquímico a través de la membrana [6]; sin embargo, su estudio in situ es complejo debido a las variables que controlan el transporte facilitado de iones. Así, un modelo como la IDSEI puede ayudar en el estudio y comprensión de la termodinámica de la transferencia de iones en sistemas biológicos, ya que las variables implicadas pueden controlarse de mejor manera. Otro ejemplo interesante es el uso de la IDSEI en la catálisis de transferencia selectiva [7-9]. Este fenómeno se estudia a partir de dos soluciones inmiscibles en contacto, donde dos pares redox se encuentran disueltas una en cada fase, de tal manera que permanecen en éstas y no se transfieran a la fase contigua. Ello permite polarizar la interfase hasta inducir una reacción de transferencia de electrones, generando una especie diferente en una de las fases sin la presencia de la otra especie que participó en la reacción. El proceso catalítico se lleva a cabo en la interfase, pero las especies involucradas permanecen en sus respectivas fases.
Estudios electroquímicos en interfases líquido-líquido
En la configuración de sistemas IDSEI destacan tres elementos fundamentales, de características muy particulares: a) la celda electroquímica, a) los electrolitos soporte y c) el potenciostato.
La celda electroquímica
El estudio de sistemas IDSEI requiere que el agua y el solvente orgánico estén en contacto en la celda, tal como en la electroquímica metal-solución. El diseño de la celda electroquímica obedece a un objetivo central: minimizar el efecto de la caída óhmica debido al uso del solvente orgánico, con el fin de aplicar adecuadamente las distintas técnicas electroquímicas. Asimismo, se recomienda el uso de celdas con volúmenes pequeños, ya que la mayoría de los solventes orgánicos utilizados son tóxicos para el ser humano.
Este tipo de celdas puede ser de cuatro o de dos electrodos. Una celda de cuatro electrodos está integrada por dos electrodos de referencia y dos contraelectrodos (Fig. 1). Los dos electrodos de referencia se conectan a través de dos capilares de Luggin: uno de ellos entra en la fase orgánica y el otro en la fase acuosa, quedando próximos entre sí. En el pequeño espacio que queda entre los dos capilares se forma la interfase, eliminándose así en gran medida la compensación de la caída óhmica. En cuanto a los contraelectrodos, éstos son de platino y generalmente están en forma de malla, sobre todo el que corresponde a la fase orgánica. Con esta configuración, se aplica el potencial entre los dos electrodos de referencia y la corriente que se mide pasa a través de los contraelectrodos, la cual equivale a la corriente que pasa a través de la interfase líquido-líquido.

En el diseño de la celda de dos electrodos se emplean dos mallas de Ag / AgCl con áreas superficiales grandes (7 cm2 aproximadamente, Fig. 2), para eliminar la caída óhmica [10, 11]. Uno de los aspectos más importantes a considerar en esta celda es el compartimento de la fase orgánica, la cual debe estar separada de la solución acuosa de referencia y su respectivo electrodo por medio de una pared de poro muy fino. La fase acuosa de la IDSEI se coloca en un compartimento por separado, junto con su electrodo; la interfase de estudio se formará entonces en la punta de este compartimento, en cuya parte superior existe una entrada para ajustar la intefase. Es importante destacar que el diámetro de la interfase de estudio tiene que ser mucho menor que el diámetro del disco de vidrio poroso, con el fin de que sea la interfase líquido-líquido quien limita el paso de corriente. Este diseño permite hacer estudios de espectroscopía de impedancia electroquímica, ya que la presencia de sólo dos electrodos minimiza la cantidad de interfases presentes que se pueden observar, ayudando a reducir la contribución de la impedancia de las interfases a la impedancia total.

Electrolitos soporte
Las sales que se emplean como electrolitos soporte en el estudio de sistemas IDSEI deben poseer una energía de transferencia de Gibbs mayor que el de la especie electroactiva, con el fin de obtener un potencial de ventana amplio que permita realizar los estudios de transferencia de carga. En otras palabras, el electrolito soporte no debe transferirse en el mismo potencial de transferencia que la especie iónica de interés. El Li2SO4, LiCl y el HCl son algunas de las especies generalmente usadas como electrolitos soporte en fase acuosa. Respecto a la fase orgánica, las posibilidades son limitadas; sin embargo, existen algunos electrolitos soporte que se emplean comúnmente y que pueden encontrarse directamente en el mercado o bien prepararse mediante una simple precipitación de sus sales correspondientes. Tal es el caso del tetrafenilborato de tetrabultilamonio (TBATPB) y el tetrakis (4-clorofenil)boratocloruro de tetrafenilarsonio (TPAsTPBCl).
Potenciostato
La función del potenciostato es controlar el potencial a través de la interfase, tanto en sistemas metal-solución como líquido-líquido. En el caso de la interfase líquido-líquido, se emplea un potenciostato con una configuración electrónica de 4-electrodos. El equipo puede construirse en el laboratorio o bien adquirirse en el mercado (si bien el diseño de estos últimos no obedece en particular a este tipo de estudios). La configuración electrónica de los potenciostatos usados en el estudio electroquímico de sistemas líquido-líquido ha sido objeto de numerosas discusiones y modificaciones [12, 13]. En la actualidad, los circuitos electrónicos del potenciostato de 3- y 4-electrodos están basados en amplificadores operacionales de alta impedancia y de mayor ganancia [14, 15].
Para controlar el potencial en IDSEI, la presencia de un segundo electrodo de referencia es esencial para medir con precisión la diferencia de potencial a través de la interfase. La configuración del potenciostato de 4-electrodos cuenta con cuatro entradas (dos para los contraelectrodos y dos de referencia) y su funcionamiento se basa en el mismo principio que el potenciostato de 3-electrodos; el circuito electrónico básico ha sido ya discutido [1, 16-19].
Teoría de la transferencia de iones a través de la IDSEI
El equilibrio de la transferencia de especies cargadas a través de la interfase de dos soluciones electrolíticas inmiscibles ha sido abordado por algunos autores [20]. Cuando una carga se transfiere, la corriente observada a través de diferentes técnicas electroquímicas corresponde a los procesos difusionales de la especie cargada a través de la interfase.
El equilibrio termodinámico para la especie i+ en un sistema IDSEI está dado por:

donde  y
y  son los potenciales electroquímicos de la especie i+ en la fase acuosa y orgánica, respectivamente. Si se separa el potencial electroquímico en su contribución química y eléctrica, se tiene:
son los potenciales electroquímicos de la especie i+ en la fase acuosa y orgánica, respectivamente. Si se separa el potencial electroquímico en su contribución química y eléctrica, se tiene:

donde  y
y 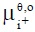 son los potenciales químicos estándar de la especie i en la fase acuosa y orgánica, respectivamente; ϕa y ϕo son los potenciales de Galvani en la fases acuosa y orgánica;
son los potenciales químicos estándar de la especie i en la fase acuosa y orgánica, respectivamente; ϕa y ϕo son los potenciales de Galvani en la fases acuosa y orgánica;  y
y  son las actividades de la especie i+ en la fases orgánica y acuosa; F es la constante de Faraday y z es la carga. La relación entre la energía estándar de Gibbs de transferencia iónica ( ΔGt ) y la diferencia del potencial estándar de Galvani (
son las actividades de la especie i+ en la fases orgánica y acuosa; F es la constante de Faraday y z es la carga. La relación entre la energía estándar de Gibbs de transferencia iónica ( ΔGt ) y la diferencia del potencial estándar de Galvani ( ) está dada por:
) está dada por:
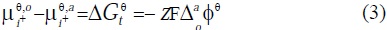
Substituyendo la ecuación (3) en la ecuación (2), es posible derivar la ecuación de Nernst:

donde  es la diferencia interfacial del potencial de Galvani. La ecuación (4) describe el equilibrio para una especie iónica a través de una interfase líquido-líquido, por lo que permite entender los procesos de partición de especies cargadas a través de dos soluciones electrolíticas inmiscibles. Así, cualquier cambio en la concentración de la especie i+ modificará el
es la diferencia interfacial del potencial de Galvani. La ecuación (4) describe el equilibrio para una especie iónica a través de una interfase líquido-líquido, por lo que permite entender los procesos de partición de especies cargadas a través de dos soluciones electrolíticas inmiscibles. Así, cualquier cambio en la concentración de la especie i+ modificará el  . Contrariamente, controlando el
. Contrariamente, controlando el  por medio de una fuente externa, el equilibrio de partición de la especie i+ también puede manipularse.
por medio de una fuente externa, el equilibrio de partición de la especie i+ también puede manipularse.
Las actividades pueden evaluarse siguiendo la ecuación de Debye-Hückel:

donde A y B son constantes y a es el tamaño del ion. El valor de αi se calcula a partir de la constante de asociación (Ka) para el electrolito:
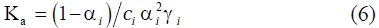
El tamaño del ion y la constante de asociación fueron tomados de Abraham y Danil de Amor (1976) [21].
A. Escala de potencial formal de Galvani
Una aproximación extra-termodinámica que se emplea para determinar la energía de Gibbs de transferencia para un solo ion (  ) es la de A. Parker, de gran aplicación en los estudios de IDSEI. En tal aproximación, se considera que los iones tetrafenilarsenato (TPAs+) y el tetrafenilborato (TPB−) tienen la misma energía estándar de solvatación en el mismo medio, por lo que se tiene la siguiente expresión:
) es la de A. Parker, de gran aplicación en los estudios de IDSEI. En tal aproximación, se considera que los iones tetrafenilarsenato (TPAs+) y el tetrafenilborato (TPB−) tienen la misma energía estándar de solvatación en el mismo medio, por lo que se tiene la siguiente expresión:

donde α y β son las dos fases en contacto. El valor de  para una sal puede calcularse a partir de distintas técnicas electroquímicas o de extracción, mientras que la determinación de
para una sal puede calcularse a partir de distintas técnicas electroquímicas o de extracción, mientras que la determinación de  para un solo ion en un par de solventes está basado en la escala de solubilidad del TPAsTPB [22].
para un solo ion en un par de solventes está basado en la escala de solubilidad del TPAsTPB [22].
B. Voltamperometría cíclica en IDSEI
La voltamperometría cíclica aplicada al estudio de IDSEI tiene una interpretación un tanto distinta respecto al estudio de procesos que se dan en la interfase metal-solución (M/S). Sin embargo, esta técnica es exactamente la misma que se utiliza para la interfase M/S. Los parámetros que se obtienen son los mismos; en el sistema IDSEI se estudia la trasferencia de iones en la interfase en lugar de la transferencia de electrones, como es el caso de la interfase M/S. Para una transferencia de iones en la interfase líquido-líquido, la ecuación que describe este fenómeno es la ecuación de Nernst (4), la cual ya fue discutida. La diferencia con la ecuación de Nernst para interfases M/S es la consideración de la concentración interfacial de las especies reducida y oxidada sobre la superficie metálica; para el caso líquido-líquido solo se consideran las actividades de las especies cargadas que se transfieren a través de la interfase. Al igual que en el sistema M/S, el coeficiente de difusión en líquido-líquido puede evaluarse a partir de los voltamperogramas correspondientes, donde se considera la difusión de las especies en las fase acuosa y orgánica. Para el caso M/S el coeficiente de difusión corresponde a la especie oxidada o reducida. Por lo tanto, para evaluar el coeficiente de difusión para líquido-líquido como para M/S se utiliza la misma ecuación, de Randles-Sevcik [16]:

donde ip es el pico de corriente (catódica o anódica), A es el área del electrodo y/o el área de contacto entre los dos solventes, n es la velocidad de polarización, co es la concentración de las especie responsables de los picos de corriente en los voltamperogramas y D es el coeficiente de difusión.
Para entender mejor el funcionamiento de este sistema observemos la Fig. 3, donde se presenta un voltamperograma para la interfase agua-1,2-dicloroetano. La línea punteada representa la señal del electrolito base, que corresponde al TPAsTPBCl a una concentración 10 mM en la fase orgánica (1,2-dicloroetano) y LiCl 0.1 M en la fase acuosa; la velocidad de polarización fue de 50 mV / s. En este experimento, el barrido de polarización se llevó a cabo en dirección anódica, con lo cual la fase acuosa se vuelve más positiva con respecto a la fase orgánica. De acuerdo con la interpretación de la señal, el TPBCl− se transfiere a la fase acuosa y el Li+ a la fase orgánica en los extremos de la ventana de potencial; al invertir la polarización, el TPBCl− y Li+ regresan a sus respectivas fases. Si la polarización es en dirección catódica, el catión TPAs+ se transfiere a la fase acuosa y el anión Cl− se transfiere a la fase orgánica. Por otro lado, la línea sólida representa la transferencia del catión tetrametilamonio (TMA+) adicionado a la fase acuosa en forma de cloruro, señal distinta a la del electrolito soporte. El pico de corriente positiva corresponde a la transferencia del ión TMA+ hacia la fase orgánica; cuando la dirección de la polarización se invierte, aparece entonces un pico de corriente negativa indicativa del retorno del TMA+ hacia la fase acuosa. La transferencia del TMA+ es un proceso reversible debido a que la separación entre el pico anódico y catódico es de 60 mV, la cual coincide con el valor predicho por la ecuación de Nernst para la transferencia de una carga (4). A partir de este voltamperograma se obtiene el potencial de media onda (Δoω ϕ1/2 = 0.115 V) y el coeficiente de difusión en fase acuosa (DTMA+ = 1.91 × 10−6 cm2 s−1), siguiendo la ecuación (8). La celda utilizada en este experimento tiene un área de estudio de 0.05 cm2 y se representa de la siguiente manera:


donde σ es la interfase en estudio, Ag / AgCl corresponde a los electrodos de referencia, con un potencial de unión liquida calculado de −0.277 V.
El potencial se convierte a la escala de potencial formal de Galvani de acuerdo a:

donde E es el potencial aplicado, E(Der) y E(Izp) son los electrodos de referencia.  es el potencial de Galvani para la unión líquida, de acuerdo a:
es el potencial de Galvani para la unión líquida, de acuerdo a:

donde  es el potencial estándar de Galvani, el cual se puede obtener a partir de experimentos de extracción.
es el potencial estándar de Galvani, el cual se puede obtener a partir de experimentos de extracción.
Caso de estudio: transferencia de H+ facilitada por la 4-octilanilina
La 4-octilanilina es una molécula estructuralmente grande con un anillo aromático y una cadena de ocho carbonos, de manera que presenta un grado de hidrofobicidad suficiente como para que la molécula permanezca en la fase orgánica y no se transfiera a la fase acuosa. De acuerdo a su estructura, su grupo ionizable -NH2 es susceptible de transferir una carga a través de la interfase agua-1,2-dicloroetano. En este caso, la fase acuosa se mantuvo como medio altamente ácido para favorecer la protonación de la amina. Antes de comenzar la polarización de la interfase, fue necesario alcanzar el equilibrio entre las dos fases. La celda de 2-electrodos utilizada en estos experimentos (con un área de estudio de 0.05 cm2), puede representarse de la siguiente manera:
Celda II

donde σ es la interfase de estudio, con un potencial de unión líquida para la celda de −0.324 V.
En la Fig. 4, línea punteada, se observa el comportamiento del electrolito soporte (TPAsTPBCl), donde la transferencia de carga se da sólo en los extremos del voltamperograma. En el extremo negativo se llevó a cabo la transferencia de los iones TPAs+ de la fase orgánica a la fase acuosa y como consiguiente el anión Cl− migró a la fase orgánica; por su parte, el TPBCl− se transfirió a potenciales positivos a la fase acuosa, así como los iones Li− y H+ se transfieren a la fase orgánica. La línea sólida del voltamperograma muestra la transferencia facilitada del H+ por la 4-octilanilina a través de la interfase, a diferentes velocidades de polarización. La corriente positiva es producto de la transferencia del H+ hacia la fase orgánica, mientras que la corriente negativa corresponde a la transferencia del H+ de la fase orgánica a la fase acuosa [23]. La función de la 4-octilanilina es la de disminuir, de manera indirecta, la energía de solvatación del H+, en la fase orgánica, haciendo que la corriente de transferencia se presente dentro del potencial de ventana establecido.

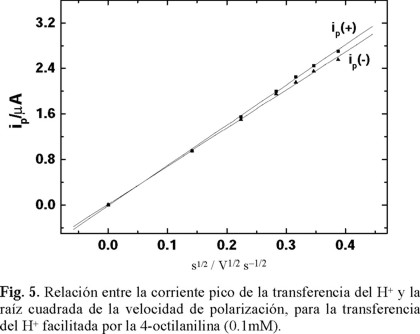
Por otro lado, este proceso de transferencia resultó ser un proceso reversible, ya que la separación entre los picos de corriente anódica y catódica en los voltamperogramas fue de 60 mV. Esto queda demostrado con las diferentes velocidades de polarización en las que se realizó el experimento. Lo anterior queda de manifiesto en la Fig. 5, donde se presenta la corriente pico anódica y catódica en función de la raíz cuadrada de la velocidad de polarización; ambas relaciones resultan ser lineales con pendientes bien definidas. Como la concentración del H+ es mayor que el de la 4-octilanilina, el proceso difusional es limitado por la 4-octilanilina. Así, las constantes de difusión obtenidas a partir de las pendientes son a) Da = 3.61 × 10−5, la cual corresponde a la difusión interfacial del H+, que se interna en la fase orgánica y es determinada por la presencia de la 4-octilanilina, y b) Do = 2.92 × 10−5 cm2 s−1, que es el coeficiente de difusión de salida del H+ de la fase orgánica para regresar a la fase acuosa. El coeficiente Da tiene un valor mayor que el coeficiente Do, debido a que en el segundo caso se considera el complejo 4-octilanilina-H+.
El comportamiento de la 4-octilanilina en función del pH se muestra en la Fig. 6. Como se puede observar, los picos de corriente se desplazan hacia potenciales menos positivos conforme disminuye el pH de la fase acuosa. Dado que la 4-octilanilina es una molécula predominantemente hidrofóbica y con una superficie molecular relativamente grande, puede considerarse que tiene una gran interacción con las moléculas del solvente orgánico y que en el intervalo de pH estudiado permanece en la fase orgánica. Para este estudio en función del pH, se utilizó la celda de 4-electrodos que se describe a continuación:

Celda III
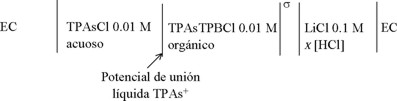
donde σ es la interfase en estudio y EC es el electrodo de Calomel saturado (dos en este caso).
Asumiendo que el tamaño molecular de la amina neutra y la amina protonada son prácticamente iguales, es posible considerar la siguiente igualdad (DoAH+)1/2 (coAH+) = (DoAH+)1/2 (coAH). De manera que el potencial de media onda está dado por [24]:
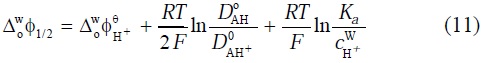
donde  es el potencial formal de la transferencia de H+, D°AH y D°AH son los coeficientes de difusión de la amina neutra y de la amina protonada en la fase orgánica, respectivamente, y Ka es la constante de protonación de la amina en la fase orgánica. La ecuación (11) predice una dependencia lineal de
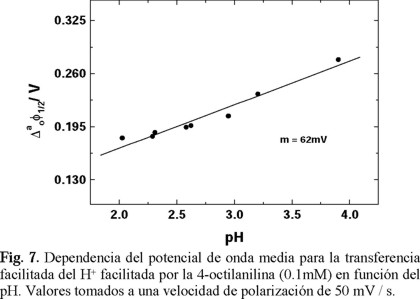
es el potencial formal de la transferencia de H+, D°AH y D°AH son los coeficientes de difusión de la amina neutra y de la amina protonada en la fase orgánica, respectivamente, y Ka es la constante de protonación de la amina en la fase orgánica. La ecuación (11) predice una dependencia lineal de  con respecto al pH, con una pendiente de 62 mV para la amina (Fig. 7). Este valor es cercano al valor teórico de 60 mV para la transferencia de una carga de acuerdo a la ecuación de Nernst. Lo anterior indica que en el intervalo de pH estudiado la 4-octilanilina permanece en la fase orgánica, de manera que la reacción entre el H+ y la 4-octilanilina es de tipo interfacial.
con respecto al pH, con una pendiente de 62 mV para la amina (Fig. 7). Este valor es cercano al valor teórico de 60 mV para la transferencia de una carga de acuerdo a la ecuación de Nernst. Lo anterior indica que en el intervalo de pH estudiado la 4-octilanilina permanece en la fase orgánica, de manera que la reacción entre el H+ y la 4-octilanilina es de tipo interfacial.
Conclusiones
Como pudo observarse a través de los resultados obtenidos, la IDSEI puede ser una herramienta útil en el estudio de los fenómenos de partición de iones de importancia biológica como el H+. Las aplicaciones de estos sistemas para resolver problemas particulares, tales como la extracción de metales, será factible cuando se comprendan bien los mecanismos de transferencia de especies iónicas en medios hidrófobos.
Respecto a la 4-octilanilina, se observó que esta amina es capaz de facilitar o favorecer el transporte de H+ a través de la interfase agua-1,2-dicloroetano, bajo las condiciones estudiadas. Dado que esta amina permanece en la fase orgánica en todo momento, a este proceso se le denomina "transferencia ++facilitada", donde la protonación de la amina se lleva a cabo en la interfase.
Agradecimientos
Se agradece al CONACyT por el apoyo financiero otorgado para realizar estudios de doctorado en la Universidad de Liverpool en Gran Bretaña, así como el financiamiento del proyecto de instalación (I35657-E) 2001.
Referencias
1. Koryta, J.; Vanysek P. Advances in Electrochemistry and Electrochemical Engineering, Vol 12, H. Gerischer and C. W. Tobias, Eds., John Wiley and Sons, New York, 1981, 113-170. [ Links ]
2. Koryta, J.; Vanysek, P.; Brezina, M. J. Electroanal, Chem. 1977, 77, 211-228. [ Links ]
3. Cheng, Y.; Schiffrin, D. J.; Guerriero P.; Vigato, P. A. Inorganic. Chem. 1994, 44, 765-769. [ Links ]
4. Schiffrin, D. J.; Chen,. Y.; Silva, A. F.; Vigato, P. A.; Tamburini, S.; Gilroy, D.; Bustero, I.; Mugica, J. C. Hydrometallurgy, 1994, 665-673. [ Links ]
5. Garby, L.; Larsen, P. Bioenergetics its Thermodynamics Foundations. Cambridge, 1995. [ Links ]
6. Mitchell, P. Chemistry in Britain, 1981, 17, 14-23. [ Links ]
7. Cheng, Y.; Schiffrin, D.J. J. Chem. Soc. Faraday Trans. 1994, 90, 2517-2523. [ Links ]
8. Cheng, Y.; Schiffrin, D.J. J. Chem. Soc. Faraday Trans. 1996, 92, 3865-3871. [ Links ]
9. Geblewicz, G.; Kontturi A. K.; Kontturi, K.; Schiffrin, D. J. J. Electroanal. Chem. 1987, 217, 261-269. [ Links ]
10. Kakutani, T.; Nishiwaki, Y.; Osakai, T.; Senda., M. Bull. Chem. Soc. Jpn. 1986, 59, 781-788. [ Links ]
11. Cheng, Y.; Cunnane, V. J.; Schiffrin, D. J.; Murtomaki, L.; Kontturi, K. J. Chem. Soc. Faraday Trans. 1991, 87, 107-114. [ Links ]
12. Watts, A.; Vandernoot, T. J. in: Liquid/Liquid Interfaces. Theory and Methods. Volkov A. G.; Deamer, D.W. Eds., CRC-Press, Boca Raton, New York. 1996, 77-102. [ Links ]
13. Kakutani, T.; Osakai T.; Senda, M. Bull. Chem. Soc. Jpn. 1983, 56, 991-996. [ Links ]
14. Starzak, M. E. The Physical Chemistry of Membranes. Academic Press, INC, London. 1984. [ Links ]
15. Bard, A. J; Faulkner, L. R, Electrochemical Methods: Fundamentals and Applications", John Wiley & Sons, New York, 1980. [ Links ]
16. Osakai, T.; Kakutani T.; Senda, M. Bull. Chem. Soc. Jpn. 1984, 57, 370-376. [ Links ]
17. Silva, F.; Moura, C. J. Electrochem. Soc. 1984, 177, 317-323. [ Links ]
18. VanderNoot, T.; Schiffrin, J. D.; Whiteside, R. S. J. Electroanal. Chem. 1990, 278 137-150. [ Links ]
19. Samec, Z.; Marecek, V.; Koryta, J.; Khalil, M. W. J. Electroanal. Chem. 1977, 83, 393-397. [ Links ]
20. Girault, H. H.; D. J. Schiffrin. Electrochemistry of liquid-liquid Interfaces: In Electroanal. Chem., Bard, A. J., Ed., Marcel Dekker, Inc., New York, 1989, 15, 1-141. [ Links ]
21. Abraham, M. H; Danil de Amor, A. F., J. Chem. Soc. Farday Trans. 1976, 72, 955-962. [ Links ]
22. Koryta, J.; Devorak, J. Principles of Electrochemistry, John Wiley and Sons 1987. [ Links ]
23. Velázquez-Manzanares, M., Tesis de doctor, The University of Liverpool, Liverpool 1999. [ Links ]
24. Homolka, D.; Marecek, V.; Samec, Z.; Base, K.; Wendt, H. J. Electroanal. Chem., 1984, 163, 159-170. [ Links ]














