Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 no.1 Ciudad de México ene./mar. 2003
Investigación
Compuestos perazufrados de platino(II) con ditioéteres y tiolatos fluorados. Estructuras cristalinas de [Pt(SC6F5)2(p-C6H4FSCH2CH2-p-SC6H4F)], [Pt(p-SC6HF4)2(o-C6H4FSCH2CH2-o-SC6H4F)] Y [Pt(p-SC6HF4)2(p-C6H4FSCH2CH2-p-SC6H4F)]
Jorge Bautista,1 Agusti Bertran,2 Sylvain Bernès,3 Ubaldo Duran2 y Hugo Torrens2*
1 Facultad de Farmacia, Universidad Autónoma del Estado de Morelos, Ciudad Universitaria, Av. Universidad 1001, Col. Chamilpa, 62210 Cuernavaca, Morelos, México.
2 División de Estudios de Posgrado, Facultad de Química, Universidad Nacional Autónoma de México, Ciudad Universitaria, 04510 México D.F., México. Tel / fax 56223724. E-mail: torrens@servidor.unam.mx
3 Centro de Química, Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla, Boulevard 14 Sur 6303, San Manuel, 72570 Puebla, Puebla, México.
A la memoria del Dr. Francisco Giral González, entrañable maestro y amigo.
Recibido el 12 de noviembre del 2002.
Aceptado el 14 de febrero del 2003.
Resumen
En este articulo se describen la síntesis y caracterización de los compuestos cis-[PtCl2(RfSCH2CH2SRf)], Rf = C6F5, p-SC6HF4, o-SC6H4F, m-SC6H4F, p-SC6H4F, m-SC6H4(CF3), y las reacciones de estos compuestos con (SC6F5)- y (p-SC6HF4)- que generan cis-[Pt(SC6F5)2(RfSCH2CH2SRf)] y cis-[Pt(p-SC6HF4) 2(RfSCH2CH2 SRf)], Rf = o-SC6H4F, m-SC6H4F, p-SC6H4F, m-SC6H4(CF3). Para estos compuestos, los datos de RMN de 19F obtenidos a diferentes temperaturas, muestran la presencia e interconversion de isómeros syn y anti, consistente con un cambio conformacional rápido del metalociclo y una inversión de configuración lenta en los átomos de azufre del ditioéter. Se describen también las estructuras cristalinas y moleculares de los compuestos [Pt(SC6F5)2(p-C6H4FSCH2CH2-p-SC6H4F)], [Pt(p-SC6HF4)2(o-C6H4FSCH2CH2-o-SC6H4F)] y [Pt(p-SC6HF4)2(p-C6H4FSCH2CH2-p-SC6H4F)], determinadas mediante difracción de rayos-X.
Palabras clave: Fluorotioles, fluorotioéteres, platino, TVRMN, rayos-X.
Abstract
This paper describes the synthesis and characterization of compounds cis-[PtCl2(RfSCH2CH2SRf)], Rf = C6F5, p-SC6HF4, o-SC6H4F, m-SC6H4F, p-SC6H4F, m-SC6H4(CF3), and the reactions of these compounds with (SC6F5)- and (p-SC6HF4)- yielding cis-[Pt(SC6F5)2(RfSCH2CH2SRf)] and cis-[Pt(p-SC6HF4) 2(RfSCH2CH2 SRf)], Rf = o-SC6H4F, m-SC6H4F, p-SC6H4F, m-SC6H4(CF3). Variable temperature 19F RMN of these complexes, show the presence and interconversion of syn and anti isomers, consistent with a fast flipping of the metalocycle ring and a slow inversion of configuration at the sulfur atoms of the dithioeter. The molecular and crystalline structures of compounds [Pt(SC6F5)2(p-C6H4FSCH2CH2-p-SC6H4F)], [Pt(p-SC6HF4)2(o-C6H4FSCH2CH2-o-SC6H4F)] and [Pt(p-SC6HF4)2(p-C6H4FSCH2CH2-p-SC6H4F)], solved by X-ray diffraction are also described.
Key words: Fluorothioles, fluorothioethers, platinum, VTNMR, X-ray.
Introducción
La química de coordinación de compuestos azufrados —tiolatos, tioéteres, etcétera— es un área en desarrollo desde hace décadas. Su interés nace de la importancia que este tipo de compuestos tiene en procesos catalíticos, de dehidrodesulfuración de petróleo, en sistemas biológicos, y en síntesis química, entre muchos otros. La química equivalente con ligantes fluorados [1,2], es mucho más joven, proporcionalmente menos conocida, pero no menos relevante, sobre todo considerando que los compuestos fluorados juegan cada día un papel más prominente en la farmacología moderna [3], el diseño de nuevos materiales [4] y la catálisis en el área de compuestos organofluorados [5].
Además de la relevancia apuntada arriba, nuestro interés en compuestos fluoroazufrados tiene dos componentes regionales: México es un importante productor mundial tanto de azufre como de fluorita [6], —materia prima para la obtención del flúor— y el esfuerzo apuntado a estos dos recursos naturales nos es intelectualmente grato.
Hidrógeno y flúor son dos especies isolobales, cuyo intercambio es la base de innumerables procesos químicos. Esta substitución tiene dos consecuencias generales. La primera es topológica, producto del cambio de dimensiones entre hidrógeno y flúor. La segunda es electrónica, derivada de la diferencia en el carácter electroatractor entre ambos átomos. Es posible generalizar, grosso modo, que una molécula perfluorada es estereoquímicamente semejante a su análoga normal y que, sin embargo, electrónicamente es totalmente distinta. La actividad química derivada de cambios morfológicos es apenas alterada mientras que la actividad dependiente de parámetros electrónicos puede llegar a ser opuesta.
Nuestro interés en la química de los metales de transición con ligantes fluoroazufrados tiene muchos años y uno de los temas que nos ocupa de modo recurrente es el de los centros metálicos unidos exclusivamente a átomos de azufre o perazufrados [7]. En este artículo, se describen la síntesis y caracterización de los compuestos cis-[PtCl2(RfSCH2CH2SRf)], Rf = C6F5 1, p-SC6HF4 2, o-SC6H4F 3, m-SC6H4F 4, p-SC6H4F 5, y m-SC6H4(CF3) 6, precursores de los compuestos perazufrados cis-[Pt(SC6F5)2(RfSCH2CH2SRf)] Rf = o-SC6H4F 7, m-SC6H4F 8, p-SC6H4F 9, m-SC6H4(CF3) 10 y cis-[Pt(p-SC6HF4)2(RfSCH2CH2SRf)] Rf = o-SC6H4F 11, m-SC6H4F 12, p-SC6H4F 13, m-SC6H4(CF3) 14, el estudio de RMN de 19F-{1H} a diferentes temperaturas y las estructuras cristalinas y moleculares de [Pt(SC6F5)2(p-C6H4FSCH2CH2-p-SC6H4F)] 9, [Pt(p-SC6HF4)2(o-C6H4FSCH2CH2-o-SC6H4F)] 11 y [Pt(p-SC6HF4)2(p-C6H4FSCH2CH2-p-SC6H4F)] 13, determinadas mediante difracción de rayos-X.
Resultados y discusión
Los compuestos con fórmula general [PtX2(RSCH2CH2SR)] pueden originar diferentes isómeros generados, como se muestra en la Fig. 1, por la posición relativa de los substituyentes del azufre entre sí -syn y anti- y/o respecto a la configuración del ciclo PtS2C2, isómeros A, B y C.

En disolución y a temperatura ambiente, los isómeros A, B y C son, en general, indistinguibles mediante RMN, porque el movimiento del anillo PtS2C2 es demasiado rápido para la escala de tiempo de esta espectroscopía. Existen algunos ejemplos con substituyentes R con gran demanda estérica, que permiten detectar estas distintas configuraciones de la cadena —SCR2CR2S— a muy bajas temperaturas [8] pero, normalmente, lo único que es posible estudiar, es el promedio dinámico de ambos estereoisómeros, representados por 1 y 2 en la Fig. 1.
Por otro lado, los isómeros syn y anti de la Fig. 1, también pueden interconvertirse mediante el proceso conocido como inversión de configuración [9] en los átomos de azufre. Esta inversión requiere energías entre 40 y 80 KJ mol−1 por lo que a temperatura ambiente ambos isómeros pueden, normalmente, determinarse de manera experimental mediante RMN [9, 10].
Para cada uno de los substituyentes utilizados en este trabajo, el sistema magnético que los define y las señales esperadas en sus respectivos espectros de RMN de 19F-{1H} son los siguientes: SC6F5, A2B2C, tres absorciones —orto, meta y para, con una proporción 2:2:1; p-SC6HF4, A2B2X, dos absorciones —orto y meta, con una proporción 1:1; o-SC6H4F y m-SC6H4F, ABCDX una absorción; p-SC6H4F, A2B2X, una absorción y m-SC6H4(CF3) ABCDX3, una absorción. SC6F5 y p-SC6HF4 son sistemas de segundo orden y experimentalmente se obtiene la multiplicidad esperada para cada señal. El resto de los grupos SRf, desacoplados de protón, generan espectros de primer orden. La Tabla 1 reúne los datos de RMN de 19F-{1H} para los compuestos 1 a 14.
Compuestos [PtCl2(RfSCH2CH2SRf)]
La reacción de los bisulfuros RfSCH2CH2SRf en los que Rf = C6F5, p-SC6HF4, o-SC6H4F, m-SC6H4F, p-SC6H4F, m-SC6H4(CF3), con disoluciones de K2[PtCl4] en mezclas acetona-agua, reacción (1), producen los compuestos del tipo cis-[PtCl2(RfSCH2CH2SRf)], 1 a 6, obtenidos como sólidos microcristalinos amarillos, estables al aire y solubles en acetona y diclorometano.

Todos los productos son diamagnéticos como se espera para compuestos de platino (II) con una geometría cuadrada plana.
Aunque en espectroscopia vibracional se anticipa la presencia de dos absorciones originadas en los enlaces Pt-Cl para una configuración cis, experimentalmente solo se observa una banda ancha sin definición, en el intervalo 330-310 cm−1, probablemente como resultado de la sobreposición de las absorciones esperadas para los isómeros syn y anti, junto con las correspondientes a los enlaces (Pt-S) que también se presentan, normalmente, en el intervalo 300-350 cm−1 [11]. Los espectros de IR son útiles en función de la caracterización de los compuestos, ya que muestran la presencia tanto de los ligantes como del fragmento PtCl2. Sin embargo, dada la anchura relativa de las bandas esta espectroscopia resulta insensible a cambios estructurales y por lo tanto solo se informa de las absorciones más relevantes, de los compuestos 1 a 14, para fines de identificación.
Los espectros de RMN son mucho más informativos sobre las estructuras adoptadas por estos compuestos en disolución. Los compuestos 1 a 6 muestran espectros de RMN consistentes con la presencia de isómeros syn y anti como se muestra en la Fig. 1.
La presencia de solo dos isómeros requiere que los cambios conformacionales del anillo metalado, sea rápido en la escala de tiempo de RMN, de otra manera, si los isómeros del anillo fuesen distinguibles, sería posible detectar tres diferentes isómeros.
Los isómeros syn y anti pueden interconvertirse por un proceso de inversión de configuración en los átomos de azufre. A temperatura ambiente, ambos isómeros se encuentran en equilibrio con distinta abundancia relativa como se muestra en la Tabla 1 para cada compuesto. Es importante señalar que la existencia de estos isómeros implica que la inversión de configuración no puede ser, únicamente, de manera simultánea en ambos átomos de azufre.
A partir exclusivamente de datos de RMN, no es posible asignar de manera definitiva al isómero específico (syn o anti) que genera un conjunto particular de señales. Se ha sugerido antes [8] que el isómero con alta abundancia relativa, corresponde con frecuencia al isómero anti, ya que esta geometría minimiza las interacciones estéricas entre substituyentes aromáticos. Aunque ésta es una argumentación razonable, esto no se refleja en los resultados sobre los compuestos estudiados en este trabajo que muestran grandes diferencias en las proporciones relativas (Intensidad isómero A / intensidad isómero B) que varían de 4.3 para el compuesto 2 a 1.5 para el compuesto 4, a pesar de que los requerimientos estéricos relativos son semejantes.
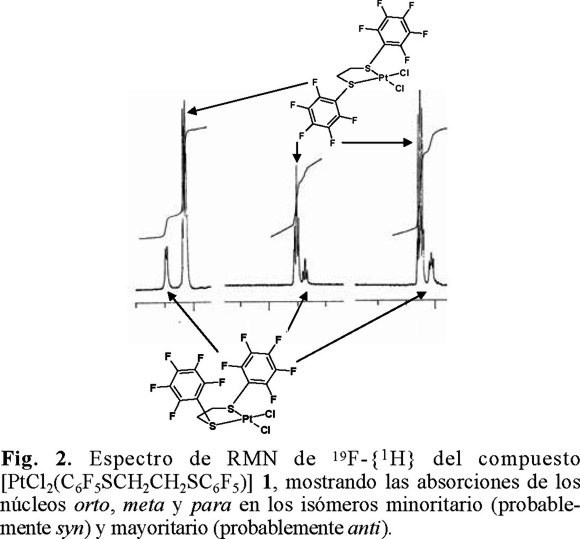
Como se muestra en la Fig. 2, el espectro de RMN de 19F-{1H} del compuesto [PtCl2(C6F5SCH2CH2SC6F5)] 1 muestra tres grupos de señales para los isómeros syn y anti —en un sistema magnético A2B2C— con intensidades relativas 1:3.6. Cada grupo tiene tres absorciones para los núcleos de flúor en posiciones orto, meta y para, respectivamente, con intensidades relativas de 2:2:1.
El espectro de RMN de 19F-{1H} del compuesto [PtCl2(p-C6HF4SCH2CH2-p-C6F5)] 2 muestra dos grupos de señales para los isómeros syn y anti —en un sistema magnético A2B2X— con intensidades relativas 1:4.3. Cada grupo tiene dos absorciones para los núcleos de flúor en posiciones orto y meta respectivamente, con intensidades relativas de 1:1. Los espectros de RMN de 1H correspondientes a la zona aromática, también son consistentes con esta asignación y muestran dos tripletes de tripletes de cuasi primer orden.
Los espectros de RMN de 19F-{1H} de los compuestos [PtCl2(C6H4FSCH2CH2SC6H4F)] 3 a 5, con el núcleo de flúor en las posiciones orto, meta y para, muestran una sola absorción de RMN para cada isómero en los que las proporciones relativas para cada isómero son 1:2.4 (compuesto 3), 1:1.5 (compuesto 4) y 1:1.9 (compuesto 5).
Finalmente, los espectros de RMN de 19F-{1H} para el compuesto [PtCl2(m-C6H4(CF3)SCH2CH2-m-SC6H4(CF3))] 6, muestra dos absorciones para δ(CF3), con intensidades relativas 1:1.8 para los isómeros syn y anti. No se detectan acoplamientos entre protones y núcleos de flúor que, en este caso se encuentran separados por 4 enlaces.
Reacciones de 1 y 2 con Pb(SC6F5)2 y Pb(p-SC6HF4)2
Las reacciones de los compuestos [PtCl2(C6F5SCH2 CH2 SC6F5)] 1 y [PtCl2(p-C6HF4SCH2CH2-p-SC6HF4)] 2 con Pb(SC6F5)2 y Pb(p-SC6HF4)2 en acetona y a temperatura ambiente, Fig. 3, evolucionan hasta la formación del polímero [Pt(SC6F5)2]n, informado por Beck et al. [12] o el polímero correspondiente [Pt(p-SC6HF4)2]n, con la liberación de los ligantes disulfuro respectivos.

El seguimiento de esta evolución, mediante RMN de 19F-{1H} contra tiempo, sugiere la formación de los compuestos [Pt(SC6F5)2(C6F5SCH2CH2SC6F5)] y [Pt(SC6F5)2(p-C6HF4SCH2CH2-p-SC6HF4)] que rápidamente se descomponen en el polímero [Pt(SC6F5)2]n y los ligantes respectivos. Por su parte, con el tetrafluorobenceno esta reacción es considerablemente más lenta y es posible detectar la formación de los compuestos [Pt(SC6HF4)2(C6F5SCH2CH2SC6F5)] y [Pt(SC6HF4)2(p-C6HF4SCH2CH2-p-SC6HF4)] que dan lugar a los dímeros [(p-C6HF4S)2Pt(µ-SC6HF4)2Pt (C6F5SCH2CH2 SC6F5)] y [(p-C6HF4S)2Pt(µ-SC6HF4)2(p-C6HF4SCH2CH2-p-SC6HF4)] probablemente mediante un mecanismo como el que se sugiere en la Fig. 3. Diversos compuestos bimetálicos puenteados por grupos tiolatos, similares a estos, han sido informados previamente por nuestro grupo [13].
Finalmente, estos productos bimetálicos generan el polímero [Pt(SC6HF4)2]n con la liberación de los ligantes disulfuro respectivos.
Las especies descritas antes solo existen de manera transiente en disolución y todo intento por obtener muestras sólidas, aun evaporando el disolvente a bajas temperaturas, por ejemplo, conduce exclusivamente al aislamiento de los polímeros y los ligantes respectivos.
Compuestos [Pt(SRf)2(RfSCH2CH2SRf)]
Los compuestos del tipo [Pt(SRf)2(RfSCH2CH2SRf)], 7 a 14, se obtuvieron como sólidos microcristalinos amarillos, estables al aire y solubles en acetona y diclorometano, a partir de la reacción de metátesis de los compuestos clorados [PtCl2(C6F5SCH2CH2SC6F5)] 1 y [PtCl2(p-C6HF4SCH2CH2-p-SC6HF4)] 2 con la sal de plomo Pb(SRf)2 (Rf = o-C6H4F, m-C6H4F, p-C6H4F y m-C6H4(CF3)) adecuada, de acuerdo a la siguiente reacción (2).

Los productos perazufrados son diamagnéticos como se espera para compuestos de platino(II) con una geometría cuadrada plana. Los espectros de infrarrojo de los compuestos 7 a 14, muestran las bandas características de los ligantes disulfuro y de los fluorobencentiolatos respectivos.
Los espectros de RMN de 19F-{1H} de los compuestos 7 a 14, Tabla 1, son consistentes, en todos los casos, con el análisis de los sistemas magnéticos esperados.
Resonancia magnética nuclear a diferentes temperaturas
Los compuestos 7 a 14 se estudiaron mediante RMN de 19F-{1H} a diferentes temperaturas entre ca. 20 °C y 40 °C en disoluciones en acetona (temp. eb. = 55 °C) y entre 20 °C 100 °C en disoluciones en dimetilsulfóxido (temp. eb. = 54 °C / 5mm).
En todos los casos, las dos señales que se observan a temperatura ambiente, correspondientes a los isómeros syn y anti, se acercan, ensanchan y, eventualmente, coalescen en una señal única al elevar la temperatura. Se ha tomado como la temperatura de coalescencia a aquella en la que la señal tiene anchura máxima y curva continua.
La temperatura de coalescencia depende del metal, del substituyente en los átomos de azufre y de la naturaleza de los ligantes trans a los átomos de azufre que invierten su configuración. Por ejemplo, en los compuestos de Pt(II) [PtX2(CH3 SCH2CH2SCH3)], análogos a los estudiados en este trabajo, las temperaturas de coalescencia son: 100 °C para X = Cl, 93 °C para X = Br y 87 °C para X = I [14]; mientras que en los compuestos [PtCl2(RSCH2CH2SR)], las temperaturas de coalescencia son: 100 °C para R = Me, 80 °C para R = Et, 95 °C para R = nPr, 92 °C para R = nBu [14] y 130 °C para R = CF3 [8].
Por lo tanto, la temperatura de coalescencia disminuye en el mismo sentido en que aumenta la influencia trans del ligante aniónico (I− > Br− > Cl− ) ya que el efecto de estas substituciones resultan en el debilitamiento del enlace S-Pt reduciendo la energía necesaria para la inversión de configuración en el azufre. Por otro lado, la temperatura de coalescencia aumenta con la electronegatividad del substituyente en los átomos de azufre probablemente porque se desfavorecen los intermediarios (sp2 + p) y ϖ, Fig. 4, considerados en los dos mecanismos de inversión de configuración normalmente aceptados.

En acuerdo con estas tendencias, nosotros encontramos que en el intervalo de 20 °C a 110 °C, las señales de los isómeros syn y anti de los compuestos [PtCl2(C6F5 SCH2 CH2SC6F5)] 1 y [PtCl2(p-C6HF4SCH2CH2-p-SC6HF4)] 2 prácticamente no varían por lo que las temperaturas de coalescencia para estos compuestos son muy superiores a los 110 °C. Desafortunadamente, estos compuestos descomponen rápidamente a altas temperaturas. Por su parte, los compuestos 3 a 6 en los que se ha disminuido la electronegatividad grupal del substituyente en los átomos de azufre, pero en los que ésta electronegatividad es probablemente semejante entre los cuatro ligantes, muestran temperaturas de coalescencia similares, entre 70 y 90 °C, como se especifica en la Tabla 2.

En contraste, la substitución de los ligantes cloruro por los bencentiolatos (SC6F5)− y (p-SC6HF4)− reduce las temperaturas de coalescencia en casi 70 °C. Dado el intervalo en que se presentan las temperaturas de coalescencia para estos compuestos, estas fueron determinadas tanto en acetona como en dimetilsulfóxido deuterados. No existe ninguna diferencia significativa entre las temperaturas de coalescencia determinadas en cada uno de estos disolventes y por lo tanto, el mecanismo de inversión de configuración es probablemente un mecanismo no disociativo e independiente del disolvente.
Estructuras moleculares
La obtención de cristales únicos de los compuestos [Pt(SC6F5)2(p-C6H4FSCH2CH2-p-SC6H4F)] 9, [Pt(p-SC6HF4)2(o-C6H4FSCH2CH2-o-SC6H4F)] 11 y [Pt(p-SC6HF4)2(p-C6H4FSCH2CH2-p-SC6H4F)] 13, permitió realizar los estudios de difracción de rayos X correspondientes. Para facilitar la comparación de los parámetros cristalográficos de estos compuestos, la Fig. 5 muestra la numeración utilizada en la Tabla 3 que reúne las principales distancias y ángulos de las moléculas 9, 11 y 13. Los diagramas tipo ORTEP para cada una de estas moléculas se muestran en las Figs. 6, 7 y 8.




Las tres moléculas presentan a los átomos centrales de platino unidos a dos átomos de azufre de los ligantes aniónicos con distancias, en el caso del complejo 9, Pt-S1, 2.3133 (19) y Pt-S2, 2.3170(17) Å, prácticamente iguales y a dos átomos de azufre de cada ligante quelato con distancias, también en el caso de 9, Pt-S3, 2.3014(17) y Pt-S4, 2.2982(16) Å, de nuevo similares aunque ligeramente menores a las anteriores. Los ángulos en este núcleo central y la posición del átomo de platino en el plano formado por los cuatro átomos de azufre, forman, prácticamente un cuadrado perfecto.
También en los tres casos, los substituyentes Rf de los átomos de azufre se encuentran alternados en relación al plano S4 en una configuración anti indicando que probablemente esta distribución espacial es la menos conflictiva en términos estéricos y correspondería con la estructura asignada, por RMN de 19F-{1H}, al isómero predominante en disolución. Esto contrasta con las estructuras cristalinas de los compuestos [PtCl2(CF3SCH(CH3)CH2SCF3)] [15], [PtCl2(CH3SCH (CF3) CH(CF3)SCH3)] [16], [Pt(SC6F5)2(CH3SCH (CF3)CH(CF3) SCH3)] [17] y [PtCl2(CH3SCF2CH2SCH3)] [18] en que, con substituyentes en el azufre considerablemente menores, estos se encuentran mutuamente syn.
Los ángulos C-S-Pt (106.2 °, promedio) muestran que las geometrías alrededor de los átomos de azufre son piramidales y muy cercanos a la estructura tetraédrica (109.5 °) y por lo tanto cada átomo de azufre puede considerarse con una hibridación formal sp3.
Una característica notable de estas estructuras, es el hecho de que el arreglo molecular parece estar estabilizado o, al menos influenciado, por interacciones intermoleculares, involucrando átomos de F. Por otra parte, se verifica claramente el concepto de semejanza desde el punto de vista estereoquímico, descrito en la introducción. Así, los complejos 9 y 13, a pesar de tener ligantes tiolatos de formulas distintas, cristalizan con parámetros de red muy parecidos y con el mismo grupo espacial (Tabla 4). En el caso de 11, con un ditioéter sustituido en la posición orto, aparece un cambio de simetría cristalina, sin cambios importantes en la geometría molecular, con respecto a 9 y 13.
Parte experimental
Todas las operaciones experimentales se llevaron a cabo bajo atmósferas de dinitrógeno libre de oxígeno utilizando líneas dobles de vacío / dinitrógeno con técnicas y aparatos Schlenk. Los disolventes se secaron y degasificaron utilizando técnicas publicadas previamente [19].
Los ligantes disulfuro RfSCH2CH2SRf (Rf = C6F5, p-SC6HF4, o-SC6H4F, m-SC6H4F, p-SC6H4F, m-SC6H4(CF3)) [20], los tiolatos de plomo Pb(SRf)2 (Rf = C6F5, p-SC6HF4, o-SC6H4F, m-SC6H4F, p-SC6H4F, m-SC6H4(CF3)) [21] y [PtCl2(C6F5SCH2CH2SC6F5)] [8, 22] se prepararon de acuerdo con los métodos publicados en la literatura.
Los nuevos compuestos se caracterizaron mediante espectroscopía vibracional IR, determinada en el intervalo 4000-300 cm−1 con un espectrómetro Perkin-Elmer 1330 con estación de datos 1300, en pastillas de CsI.
Los análisis elementales fueron determinados por Galbraith Labs. Inc., E.U.
Los espectros de RMN de 1H y de 19F-{1H} se registraron utilizando espectrómetros Varian 360 y/o Varian NT360 operando a 360 MHz y 282.23 MHz respectivamente por Spectral Data Services Inc (Illinois, E.U.) a partir de disoluciones de acetona-D6 o (CD3)2SO, los desplazamientos químicos son relativos a TMS δ = 0 (1H) y a CCl3F δ = 0 (19F), positivos a bajo campo. Para el control de la temperatura en la cámara se uso una unidad estándar que fue verificada periódicamente con un termocople para asegurar que la temperatura se mantuviera dentro del intervalo de 1 ±°C.
Los espectros FAB se obtuvieron en un espectrómetro de masas JEOL SX102 operando con un voltaje de aceleración de 10 kV. Las muestras fueron desorbidas de una matriz de alcohol nitrobencílico usando átomos de Xenón de 3 keV. Las mediciones de masa en FAB se llevaron a cabo con una resolución de 3000 usando barridos de campo magnético y la matriz de iones como material de referencia, o con barridos del campo eléctrico con el pico de la muestra flanqueada por dos (polietilenglicol o ioduro de cesio) iones de referencia.
Para cada uno de los tipos de compuestos descritos en este trabajo, [PtCl2(RfSCH2CH2SRf)], [Pt(SC6F5)2 (RfSCH2 CH2SRf)] y [Pt(p-SC6HF4)2(RfSCH2CH2SRf)] a continuación se ejemplifica un procedimiento detallado de su síntesis.
Sintesis de cis-[PtCl2(p-C6HF4SCH2CH2-p-SC6HF4)] 2
0.08 g (0.19 mmol) de potasio tetracloroplatinato(II) K2[PtCl4], se disolvieron en una mezcla de agua (5 cm3) y acetona (5 cm3). El disulfuro p-C6F4HSCH2CH2-p-SC6F4H, (0.075 g, 0.19 mmol) disuelto en acetona (20 cm3) se añadió gota a gota a la disolución de la sal metálica. El color de la disolución cambia lentamente de rojo a amarillo con precipitación de microcristales y después de 24 h a temperatura ambiente el acetona se evaporó en la línea de vacío. El precipitado amarillo del cis-[PtCl2(p-C6HF4SCH2CH2-p-SC6HF4)] 2 (0.10 g, 0.16mmol,) se filtró y lavó con agua fría y el sólido se seco al vacío, a temperatura ambiente, por 4 h. Los datos físicos y espectroscópicos mas relevantes para cada uno de los compuestos obtenidos son: 1, microcristales amarillos, rend. 86 %, pf 243-245 °C, IR (past. CsI) 1520, 1490-1480, 1095, 970, 865, 330-320 cm−1, FAB+ m/z: 692[M]+, Anal. C 24.1 %, H 0.6 %, S 9.22 %, calcd para C14H4Cl2F10S2Pt, C 24.29 %, H 0.58 %, S 9.26 %. 2, microcristales amarillos, rend 76 %, pf 236-237 °C, IR (past. CsI) 1490, 1230, 1180, 1130, 920, 850, 330-320 cm−1, FAB+ m/z: 656[M]+, Anal. C 25.5 %, H 1.02 %, S 9.58 %, calcd para C14H6Cl2F8S2Pt, C 25.62 %, H 0.92 %, S 9.77 %. 3, microcristales amarillos, rend 81 %, pf > 290 °C, IR (past. CsI) 1470, 1260, 840, 760, 330-310 cm−1, FAB+ m/z: 548[M]+. Anal. C 30.4 %, H 1.9 %, S 11.49 %, calcd para C14H12Cl2F2S2Pt, C 30.67 %, H 2.2 %, S 11.69 %. 4, microcristales amarillos, rend 77 %, pf 233-234 °C, IR (past. CsI) 1590-1580, 1470, 1220, 870, 780, 680, 330-310 cm−1, FAB+ m/z: 548[M]+, Anal. C 29.4 %, H 2.1 %, S 11.5 %, calcd para C14H12Cl2F2S2Pt, C 30.67 %, H 2.2 %, S 11.69 %. 5, microcristales amarillos, rend 84 %, pf 280-282 °C, IR (past. CsI) 1590, 1490, 1240, 1220, 1155, 830, 330-310 cm−1, FAB+ m/z: 548[M]+, Anal. C 30.2 %, H 1.9 %, S 11.74 %, calcd para C14H12Cl2F2S2Pt, C 30.67 %, H 2.2 %, S 11.69 %. 6, microcristales amarillos, rend 88 %, pf > 290 °C, IR (past. CsI) 1480, 1435, 1420, 1240, 1170, 910, 890, 850, 710, 360, 320-300 cm−1, FAB+ m/z: 648[M]+. Anal. C 29.2 %, H 1.74 %, S 9.87 %, calcd para C16H12Cl2F6S2Pt, C 29.64 %, H 1.87 %, S 9.89 %.
Sintesis de cis-[Pt(SC6F5)2(p-C6H4FSCH2 CH2-p-SC6H4F)] 9
[PtCl2(p-C6H4FSCH2CH2-p-SC6H4F)] (0.082g, 1.5 mmol) y Pb(SC6F5)2 (0.091 g, 1.5 mmol), se disolvieron en acetona (5 cm3). El color de la disolución cambia entre tonos de amarillo con precipitación de PbCl2 y después de 24 h a temperatura ambiente se filtra la sal de plomo y la disolución de acetona se lleva a sequedad para obtener el complejo cis-[Pt(SC6F5)2(p-C6H4FSCH2CH2-p-SC6H4F)] 7 (0.11 g, 1.2 mmol). Los datos físicos y espectroscópicos más relevantes para cada uno de los compuestos obtenidos son: 7, microcristales amarillos, rend. 86 %, pf > 290 °C, IR (past. CsI) 1507, 1478, 1086, 974, 858, 760 cm−1, FAB+ m/z: 875[M]+, Anal. C 35.7 %, H 1.8 %, S 13.7 %, calcd para C26H12F12S4Pt, 35.66 %, H 1.38 %, S 14.64 %. 8, microcristales amarillos, rend 76 %, pf > 290 °C, IR (past. CsI) 1520, 1480, 1210, 871, 771, 682 cm−1, FAB+ m/z: 875[M]+, Anal. C 35.5 %, H 1.2 %, S 14.3 %, calcd para C26H12F12S4Pt, C 35.66 %, H 1.38 %, S 14.64 % 9, micro-cristales amarillos, rend 81 %, pf > 290 oC, IR (past. CsI) 1510, 1480, 1240, 1088, 974, 858, 834 cm−1, FAB+ m/z: 875[M]+, Anal. C 36.43 %, H 1.48 %, S 15.07 %, calcd para C26H12F12S4Pt, 35.66 %, H 1.38 %, S 14.64 %. 10, micro-cristales amarillos, rend 77 %, pf > 290 °C, IR (past. CsI) 1508, 1480, 1326, 1130, 1084, 976, 856 cm−1, FAB+ m/z: 975[M]+, Anal. C 34.4 %, H 1.2 %, S 13.3 %, calcd para C28H12F16S4Pt, C 34.47 %, H 1.24 %, S 13.14 %.
Sintesis de cis-[Pt(p-SC6HF4)2(p-C6H4FSCH2CH2-p-SC6H4F)] 13
[PtCl2(p-C6H4FSCH2CH2-p-SC6H4F)] (0.082 g, 1.5 mmol) y Pb(p-SC6HF4)2 (0.085 g, 1.5 mmol), se disolvieron en acetona (5 cm3). El color de la disolución cambia entre tonos de amarillo con precipitación de PbCl2 y después de 24 h a temperatura ambiente se filtra la sal de plomo y la disolución de acetona se lleva a sequedad para obtener el complejo cis-[Pt(p-SC6HF4)2(p-C6H4FSCH2CH2-p-SC6H4F)] 13 (0.102 g, 1.2 mmol). Los datos físicos y espectroscópicos más relevantes para cada uno de los compuestos obtenidos son: 11, micro-cristales amarillos, rend. 86 %, pf >290 °C, IR (past. CsI) 1628, 1591, 1486, 1470, 1224, 1169, 1123, 911, 887, 833, 766, 712, 633 cm−1, FAB+ m/z: 839[M]+, Anal. C 37.36 %, H 1.87 %, S 15.76 %, calcd para C26H14F10S4Pt, C 37.19 %, H 1.68 %, S 15.27 %. 12, microcristales amarillos, rend 76 %, pf > 290 °C, IR (past. CsI) 1624, 1592, 1480, 1428, 1220, 1168, 910, 886, 846, 782, 710, 678 cm−1, FAB+ m/z: 839[M]+, Anal. C 36.98 %, H 1.88 %, S 15.60 %, calcd para C26H14F10S4Pt, C 37.19 %, H 1.68 %, S 15.27 %. 13, microcristales amarillos, rend 81 %, pf > 290 °C, IR (past. CsI) 1626, 1586, 1482, 1430, 1226, 1172, 910, 886, 832, 712 cm−1, FAB+ m/z: 839[M]+, Anal. C 37.14 %, H 1.85 %, S 15.25 %, calcd para C26H14F10S4Pt, C 37.19 %, H 1.68 %, S 15.27 %. 14, microcristales amarillos, rend 77 %, pf > 290 °C, IR (past. CsI) 1726, 1626, 1595, 1483, 1416, 1322, 1271, 1168, 1126, 1070, 909, 795, 710, 694 cm−1, FAB+ m/z: 939[M]+, Anal. C 35.58 %, H 1.47 %, S 13.42 %, calcd para C28H14F14S4Pt, C 35.79 %, H 1.5 %, S 13.65 %.
Los datos cristalográficos de los compuestos 9, 11 y 13, se muestran en la Tabla 4. Las intensidades se midieron usando radiación de grafito monocromatizada Mo-Kα (λ = 0.71073 Å) con difractómetros Siemens P4 / PC [23], de la Unidad de Servicios de Apoyo a la Investigación, Facultad de Química, UNAM (13), de la Escuela Nacional de Ciencias Biológicas del IPN (11) y de la División de Estudios Superiores de la Facultad de Ciencias Químicas, U.A.N.L. (9). Los datos se midieron hasta una resolución correspondiente a 2ϑ = 60° para 11 y a 2ϑ = 50° para 9 y 13 y fueron corregidos por los efectos de absorción, indizando las caras del cristal (11) o bien de manera semiempírica, con base a la medición de barridos-ψ. Las estructuras fueron resueltas por métodos directos [24] y refinadas anisotrópicamente excepto para los átomos de hidrógeno (posiciones calculadas), sin restricciones ni constricciones sobre los parámetros geométricos. En los tres casos, las relaciones entre el número de parámetros refinados y el número de datos empleados fue mayor a 12. Se aplicaron esquemas de ponderación adecuados en los tres refinamientos. Los datos cristalográficos completos (archivos CIF) se depositaron en la CCDC, con claves 196583 (9), 196584 (11) y 196585 (13). Los datos de difracción están disponibles vía internet en http://www.ccdc.cam.ac.uk o vía el autor principal.
Agradecimientos
Agradecemos a DGAPA-UNAM el apoyo otorgado a través de proyecto IN116001.
Referencias
1. Torrens, H. Coord. Chem. Rev., 2000, 196, 331. [ Links ]
2. Redón, R.; Cramer, R.; Bernes, S.; Morales-Morales, D.; Torrens, H. Polyhedron., 2001, 20, 3119. [ Links ]
3. Spracklin, D.K.; Kharasch, E.D. Chem. Res. Toxicol.,1996, 9, 696. [ Links ]
4. Martin, E.; Torrens, H.; Tovilla, J. Rev. Soc. Quím. Méx., 2000, 44, 108. [ Links ]
5. Redón, R.; Torrens, H.; Wang, Z.; Morales-Morales, D. J. Organomet. Chem., 2002, 654, 16. [ Links ]
6. Informe Anual de Comercio Exterior, Banco de México, México 2001. [ Links ]
7. Cruz-Garritz, D.; Martin, E.; Mayoh, M.A.; Smith, A.J.; Torrens, H. Trans. Met. Chem. 1991, 16, 236. [ Links ]
8. Cross, R.J.; Rycroft, D.S.; Sharp, D.W.A.; Torrens, H. J. Chem. Soc., Dalton Trans. 1980, 2434. [ Links ]
9. Abel, E.W.; Bhargava, S.K.; Orrel, K.G. Prog. Inorg. Chem., 1984, 32, 1. [ Links ]
10. Shaver, A.; Morris, S.; Turrin, R.; Day V.M. Inorg. Chem. 1990, 29, 3622. [ Links ]
11. Adams, D.D.; Metal-Ligand and Related Vibrations, Edward Arnold, London, 1967. [ Links ]
12. Beck, W.; Tadros, S. Z. Anorg Allg. Chem. 1979, 375, 231. [ Links ] Beck, W.; Stetter, K.H.; Tadros, S.; Schwarzhans, K.E. Chem. Ber. 1967, 100, 3944. [ Links ]
13. Rivera, G.; Bernes, S.; Rodriguez de Barbarin, C.; Torrens, H. Inorg. Chem. 2001, 40, 5575. [ Links ]
14. Cross, R.J.; Dalgleish, I.G.; Smith, G. J.; Wardle, R. J. Chem. Soc., Dalton Trans. 1972, 992. [ Links ]
15. Cross, R.J.; Manojlovic-Muir, L.; Muir, K.W.; Rycroft, D.S.; Sharp, D.W.A.; Solomun, T.; Torrens, H. J. Chem. Soc., Chem. Comm. 1976, 291. [ Links ]
16. Hunter, W.N.; Muir, K.W.; Sharp, D.W.A. Acta Cryst. 1984, C40, 37. [ Links ]
17. Martin, E.; Toledo, B.; Torrens, H.; Lahoz, F.J.; Terreros, P. Polyhedron, 1998, 17, 4091. [ Links ]
18. Cano, O.; Leal, J.; Quintana, P.; Torrens, H. Inorg. Chim. Acta, 1984, 89, L9. [ Links ]
19. Riddick, J.A.; Bunger, W.B.; Sakaro, T.K. Organic Solvents: Physical Properties and Methods of Purification, 4a Ed., Techniques of Chemistry, Vol II, Wiley-Interscience, N.Y. 1970. [ Links ]
20. Bertran, A.; del Rio, F.; Torrens, H. Sulfur Lett., 1992, 15, 11. [ Links ]
21. a) Peach, M.E. Can. J. Chem. 1968, 46, 2699. [ Links ] B) Bertran, A.; Garcia, J.; Martin, E. P. Sosa, H. Torrens, Rev. Soc. Quím. Méx., 1993, 37, 185. [ Links ]
22. Ainscough, E.W.; Brodie, A.M.; Larsen, N.G.; Gin, A.; Weiner, M.A. Inorg. Chim. Acta, 1981, 53, L271. [ Links ]
23. Fait, J. XSCAnS Users Manual, Siemens Analytical X-Ray Instruments Inc., Madison, WI 1991. [ Links ]
24. G.M. Sheldrick, SHELX97 Users Manual, University of Göttingen, Göttingen, Germany, 1997. [ Links ]














