Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 no.4 Ciudad de México oct./dic. 2002
Investigación
Fosfato-ésteres cíclicos diastereoisoméricos: 5-bromo-4-fenil-2-fenoxi-2-oxo-1,3,2-dioxafosforinanos, precursores de radicales libres alquilo β-fosfatoxi y generadores de radicales catiónicos en medio no oxidativo
Fernando Sartillo-Piscil,* Rosa Luisa Meza-León y Leticia Quintero-Cortés*
Centro de Investigación de la Facultad de Ciencias Químicas, Blvd.. 14 Sur y Av. San Claudio. Col San Manuel. Benemérita Universidad Autónoma de Puebla, Puebla 72570. Tel: (22) 45-49-72; Fax: (22) 45-49-72. E-mail: fsarpis@siu.buap.mx, lquinter@siu.buap.mx
Recibido el 13 de septiembre del 2002.
Aceptado el 28 de noviembre del 2002.
Resumen
Se sintetizan dos nuevos fosfato-ésteres cíclicos de 6 miembros precursores de radicales libres alquilo β-fosfatoxi. Estos precursores se tratan en condiciones clásicas de generación de radicales libres (Método Tin) formándose radicales catiónicos en C4-C5 causando la ruptura del heterociclo. Uno de los precursores promueve una reacción de contracción y de recombinación del grupo fosfato, mientras que el otro sólo produce el compuesto normal de reducción.
Palabras clave: Fosfato-ésteres cíclicos, radicales libres, radicales catiónicos, reacción de contracción, reducción.
Abstract
Two novel six member ring cyclic phosphates were successfully obtained. Both compound showed to be suitable β-(phosphatoxy)alkyl radicals precursors (by Tin method). Such free radicals precursors did generate radical cations in non-oxidative conditions followed by C4-C5 bond cleavage of the heterocyclic ring. In one case both contraction reaction and scrambling phosphate group were observed. In other case only the normal reduction product was observed.
Key words: Cyclic phosphates, free radicals, radical cations, contraction reaction, reduction.
Introducción
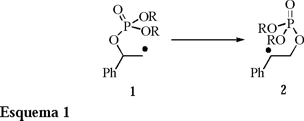
La química de radicales libres alquilo β-fosfatoxi inicia en 1993 con los trabajos reportados de manera independiente por los grupos de Crich [1] y Giese [2]. Estos trabajos describen una reacción de rearreglo del grupo fosfatoxi (1 → 2) (Esquema 1). Esta química se fundamenta en el rearreglo que sufren los radicales libres alquilo β-acetoxi previamente reportados por Suzur y Teissler 3.
A pesar de la aparente simplicidad de esta reacción, muchos investigadores interesados en la físico-química orgánica enfocan sus esfuerzos en la elucidación del mecanismo de esta reacción [4] y justifican su estudio en la semejanza que presentan estas especies con los radicales libres alquilo β-fosfatoxi, los cuales son intermediarios en la degradación de moléculas de ADN generadas en organismos vivos (Esquema 2) [5].
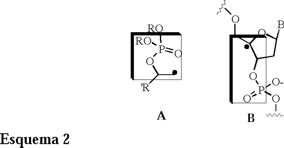
Es interesante mencionar que los resultados que se obtienen de los estudios de especies del tipo A en los laboratorios de síntesis orgánica son compatibles con los que se obtienen en estudios in vitro de las especies del tipo B [6].
Desde un punto de vista general se pueden considerar dos mecanismos de degradación aeróbica del ADN por medio de la acción inicial de fármacos como las Bleomicinas activadas con Fe+2 y de las Enidinas de procedencia natural [7]. El grupo de Stubbe [6] propone un primer mecanismo mediante un elegante estudio cinético e isotópico obteniendo los siguientes resultados (Esquema 3).
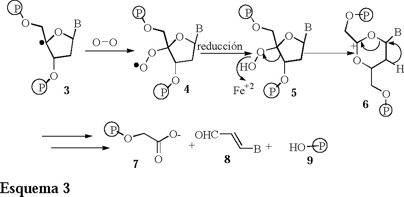
El radical C'4, 3 reacciona con oxígeno molecular para formar el radical peróxilo 4, éste se reduce al compuesto 5 que inmediatamente en presencia de Fe+2 promueve un rearreglo tipo Criegee para formar la especie 6, cuya alta inestabilidad genera los productos de degradación [7-9].
Por otro lado el grupo de Giese [8] propone una modificación a este mecanismo (Esquema 4).
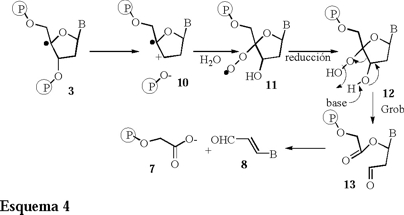
El paso clave corresponde a la formación de un radical catiónico 10 el cual se obtiene inmediatamente después de la generación del radical C'4, 3. Posteriormente la función radical y la función catión son atrapados por oxígeno molecular y agua, respectivamente, para formar al intermediario 11, el cual, por medio de un rearreglo tipo Grob y una posterior degradación produce los compuestos 7 y 8, de la misma forma como sucede en el mecanismo propuesto por Stubbe [6].
A pesar de que ambos mecanismos explican ampliamente el mecanismo de degradación del ADN, los dos involucran condiciones más fuertes que las que existen en un medio fisiológico, es decir, el rearreglo típico de Criegee se lleva a cabo en condiciones más ácidas y la fragmentación tipo Grob procede en condiciones más básicas de lo que el medio fisiológico permite.
A partir de los importantes resultados de Stubbe y Giese, diversos grupos de investigación dirigen sus esfuerzos a la síntesis y al estudio de compuestos modelo similares a los compuestos en cuestión, para contribuir a un mayor entendimiento de la degradación de ADN.
En el plano sintético, los radicales libres alquilo β-fosfatoxi como fuente de radicales catiónicos también representan un nuevo mundo de oportunidades para diseñar nuevas metodologías de síntesis. Su propiedad bidentada hace de estas especies excelentes sintones para la construcción de moléculas con relativa complejidad, en este sentido se sintetizan pirrolidinas [9], tetrahidrofuranos [10] y otros heterociclos [11].
Con base en estos atractivos antecedentes, nuestro grupo de investigación recientemente publica una reacción de contracción de 5-bromo-4-fenil-2-fenoxi-2-oxo-1,3,2-dioxafos-fepanos (fosfato-ésteres de 7 miembros 14 y 15) a 4-bencil-2-fenoxi-2-oxo-1,3,2-dioxafosforinanos (16 y 17) vía formación de radicales catiónicos en medios no oxidativos [12] (Fig. 1).
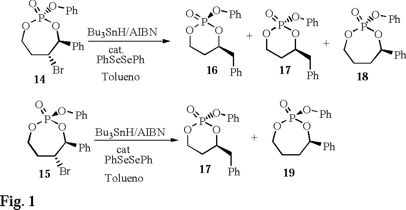
En este trabajo se determinan la cinética de reacción y la función de Arrhenius para ambos precursores (14 y 15), los valores muestran la existencia de dichas especies, especialmente los valores de Log A. También se realizan experimentos con muestras marcadas isotópicamente con O17 en el grupo fosforilo de 14 y 15 y los resultados sustentan más dicho mecanismo.
Motivados con los resultados de este trabajo, iniciamos el estudio de los radicales libres alquilo β-fosfatoxi de 6 miembros (5-bromo-4-fenil-2-fenoxi-2-oxo-1,3,2-dioxafosforinanos), esperando que fueran excelentes precursores de radicales libres alquilo β-fosfatoxi al igual que los fosfatos cíclicos de 7 miembros y probables generadores de radicales catiónicos en sistemas no oxidativos.
Resultados y discusión
Esta investigación parte con la síntesis de dos precursores diastereoisoméricos fosfato-ésteres 21 y 22. La adición de NBS al alcohol cinámico produce la bromohidrina eritro 20 con un 82 % de rendimiento. Después de su purificación por cromatográfica en columna empacada con gel de silice se trata con fenildiclorofosfato y trietil amina en CH2Cl2 durante 4 h. El crudo de reacción se analiza por RMN de protón y fósforo observando dos producto únicos en una relación 1:1 que corresponden a los compuestos 21 y 22 (Fig. 2).

La configuración relativa de los precursores 21 y 22 se determina por métodos estándares de RMN de 1H y 31 P. Afortunadamente los patrones de acoplamiento y los desplazamientos químicos de ambos compuestos son de primer orden, facilitando su estudio esteroquímico. En la Tabla 1 se muestran los parámetros más importantes.

Ha de 21 se encuentra desplazado 0.17 ppm a campo bajo en relación a Ha de 22 debido al efecto anisotrópico del grupo fosforilo que lo afecta directamente al encontrarse ambos en orientación axial. Las constante de acoplamiento entre Ha y Hb para 21 y 22 están en el rango de 10.10-10.42 Hz lo cual sugiere una orientación trans, orientando a los grupos fenilo y bromo en posición ecuatorial. La confirmación de la configuración relativa en el grupo fosfato se asigna de acuerdo con el desplazamiento químico de Fósforo-31 basado en el criterio de Gorestein [13] (δ(fenoxido)eq - δ(fenoxido)ax = valor positivo, - 9.10 - (-13.2) = + 4.1. De esta forma se establece que la configuración relativa de 21 y 22 está de acuerdo con la representación de la Fig. 2. Aunque no se realizan otros estudios para determinar la conformación y/o mayor contribución conformacional de los compuestos 21 y 22 se puede mencionar que ambos poseen una conformación mayoritaria de silla.
El estudio de radicales libres se inicia con el tratamiento de 21 y 22 en presencia de hidruro de tributilestaño a baja concentración (2.87 × 10-3 M), AIBN en cantidades catalíticas y benceno a reflujo por 8 h. El análisis en Fósforo-31 del crudo de reacción de 22 revela únicamente la presencia del producto de reducción 23, no así 21 que muestra la existencia de 3 nuevos productos (Fig. 3), uno de contracción 24 que presenta un desplazamiento químico en 31 P a 11.2 ppm y dos de reducción (23 y 25) en una relación de 45:40:15, respectivamente (Fig. 3).
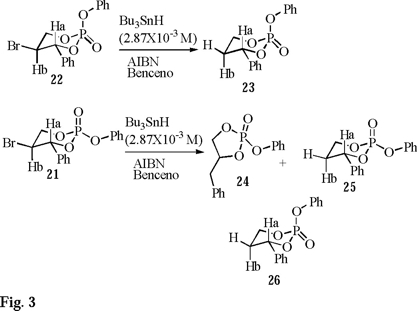
Los productos 23 y 25 se purifican fácilmente por cromatografía rápida en columna y se caracterizan por los mismos métodos descritos anteriormente, el producto de contracción 24 desafortunadamente es altamente inestable y no se puede purificar apropiadamente lo que ocasiona una escasa caracterización espectroscópica. Para confirmar la obtención del producto de contracción, se realiza la síntesis directa de 24 de acuerdo con el siguiente esquema de reacción (Fig. 4).
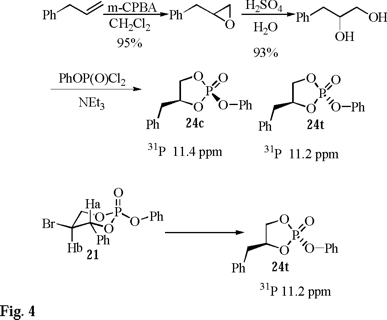
La correlación química confirma la obtención del fosfolano 24 a partir de 21 y con el apoyo de los trabajos de Lowe [14] sobre los estudios configuracionales de análogos de fosfolanos, se puede concluir que 24 posee una configuración relativa trans 24t (la asignación de la estereoquímica relativa se realiza con base en la orientación de los grupos fenóxido y bencilo). La formación del producto de contracción 24 se explica vía el rearreglo típico que sufren los radicales libres alquilo β-fosfatoxi (Esquema 1), ya sea involucrando un mecanismo concertado o heterolítico y/o ambos, sin embargo, la formación del producto 23 sugiere la fragmentación heterolítica de un enlace endocíclico D y un posterior rearreglo del grupo del fosfato F seguido de una recombinación G. En este sentido un mecanismo concertado no explica la formación de 23 a partir de 21 mientras que la existencia de un radical catiónico (mecanismo heterolítico) lo explica claramente (Esquema 5).
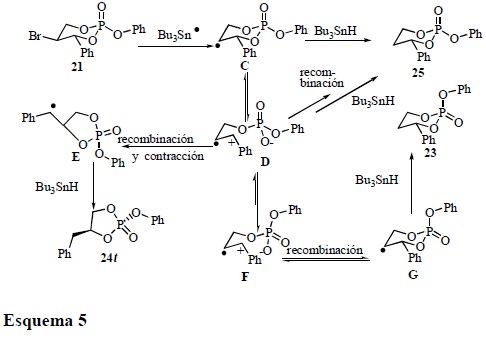
En el caso del precursor 22, no se observa la formación del producto de contracción ni mucho menos la formación del producto de reducción que involucre la epimerización del grupo fosfato. Este resultado se puede explicar con base en la alta estabilidad que presenta el radical catiónico F, que prefiere anoméricamente retener al grupo fenóxido en una posición axial y/o pseudo-axial [15] en lugar de reorientar al grupo fosfato y colocar al grupo fenoxi en posición ecuatorial y/o pseudo-ecuatorial. Es decir, el equilibrio F ↔ D es muy poco favorecido, sin embargo, en el caso de 21 (Esquema 5), el equilibrio D ↔ F se favorece (Esquema 6).
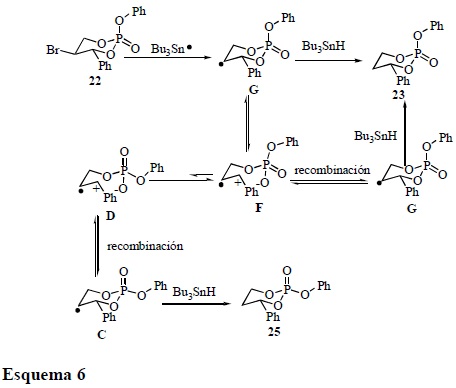
Aunque este trabajo no involucra estudios cinéticos ni estereoquímicos que pudieran apoyar la existencia de radicales catiónico en el transcurso del rearreglo, la ruptura del heterociclo y la recombinación del grupo fosfato en el caso de 21 soportan la teoría de formación de radicales catiónicos en medios no oxidativos a partir de radicales alquilo β-fosfatoxi. Además, el que no exista la formación de un compuesto de contracción a partir de 22, excluye por completo al rearreglo concertado con migración [1, 2] que es energéticamente muy similar al radical catión [4].
Parte experimental
Los disolventes se secan aplicando métodos estándares. Los espectros de RMN de hidrógeno y de fósforo se obtienen en un equipo JEOL de 400 MHz en hidrógeno y 161.8 MHz en fósforo.
Eritro-(1-fenil-2-bromo-1,3-propanodiol) 20 [16]
A una solución de alcohol cinámico (0.63 g, 5.4 mmol) en 20 mL de DMSO y 2 mL de H2O a 10 °C se adiciona NBS (1.93 g, 10.8 mmol). La mezcla de reacción se mantiene en agitación durante 4 horas, posteriormente la reacción se termina con H2O y se extrae con éter etílico (3 porciones con 50 mL cada una). Se evapora en el rotavapor y el residuo se purifica en una columna de cromatografía empacada con gel de sílice en un sistema 2:1 (éter de petróleo/acetato de etilo). Se obtiene 0.94 g del compuesto 20 que corresponde a un rendimiento del 75 %. RMN 1H (400 MHz, CDCl3) δ 7.25 (m, 5H), 4.96 (d, 1H, J = 5.1 Hz), 4.23 (c, 1H, J = 4.4 Hz),3.98 (d, 1H, J = 11 Hz), 3.82 (d, 1H, J = 11 Hz), 3.79 (s, 1H), 3.18 (s, 1H). RMN 13C (100 MHz, CDCl3) δ 140.4, 128.6,128.5,128.3, 126.3, 76.7, 64.2, 59.2.
5-bromo-4-fenil-2-fenoxi-2-oxo-1,3,2-dioxafosforinanos 21 y 22
A una solución de 20 (0.86 g, 3.7 mmol) y trietil amina (2.6 mL, 18.4 mmol) en 30 mL de CH2Cl2 se adiciona lentamente fenildiclorofosfato (0.54 mL, 3.7 mmol) a 0 °C. La mezcla se deja reaccionar por 2 horas y posteriormente se filtra el clorhidrato de trietilamina. El filtrado se evapora en el rotava-por y el residuo se purifica en una columna de cromatografía empacada con gel de sílice en un sistema 6:1 (hexano/acetato de etilo). Se obtiene 0.5 g de 21 (38 %) y 0.51 g (39 %) de 22. 21 RMN 1H (400 MHz, CDCl3). δ 7.31 (m, 10H), 5.56 (dd, 1H, J = 2.2, J = 10.1 Hz), 4.73 (ddd, 1H, J = 11.5, 11.0, 3.5 Hz), 4.59 (ddd, 1H, J = 25.9, 11.5, 5.0 Hz), 4.18 (ddd, 1H, J = 11.0, 10.1, 5.0 Hz). RMN 13C (100 MHz, CDCl3) δ 150.4,135.8, 130.1, 128.7, 127.4, 125.9, 120.4, 84.2, 70.1, 44.4. RMN 31P (161.8 MHz, CDCl3) δ-9.1. Anal Calcd para C15H14BrO4P: C,48.80; H,3.82. Encontrado: C, 48.50; H, 3.83. 22 RMN 1H (400 MHz, CDCl3) δ 7.35 (m, 1H), 5.40 (dd, 1H, J = 10.4, 0.7 Hz), 4.63 (ddd, 1H, J = 26.1, 11.5, 5.3 Hz), 4.59 (dd, 1H, J = 13.4, 11.4 Hz), 4.31 (ddd, 1H, J =13.4, 10.4, 5.3 Hz). RMN 13C (100 MHz, CDCl3) 150.14, 135.4, 130.0, 129.8, 126.6, 127.5, 125.4, 119.3, 85.2,70.9, 44.2. RMN 31P (161.8 MHz, CDCl3) δ-13.5. Anal Calcd para C15H14BrO4P: C, 48.80; H, 3.82. Encontrado: C, 48.50; H, 3.84.
Obtención directa de 24
α-bencil-óxido de etileno [17]
Una solución de alilbenceno (1 g, 8.46 mmol) y m-CPBA (1.46 g, 8.46 mmol) en 30 mL de CH2Cl2 se deja reaccionar por 48 h a temperatura ambiente. El sólido resultante se filtra y la mezcla se evapora en el rotavapor. El residuo se purifica por cromatografía en columna empacada con gel de sílice y hexano como sistema de elución. Se obtiene 1.1 g de producto que corresponde a 95 % de rendimiento. RMN 1H (400 MHz, CDCl3) 7.24 (m, 1H), 3.16 (m, 1H), 2.92 (dd, 1H, J = 5.8, 14.6 Hz), 2.82 ( dd, 1H, J = 14.6, 5.5 Hz), 2.79 (dd, 1H, J = 5.3, 5.1 Hz), 2.54 (dd, 1H, J = 5.3, 2.5 Hz). RMN 13C (100 MHz, CDCl3) δ 137.2, 129.0, 128.6, 126.7, 52.5, 46.9, 38.8.
2-bencil-1,2-etanodiol [18]
Una solución de α-bencil-óxido de etileno (1 g, 7.45 mmol) y trazas de H2SO4 en 30 mL de H2O se agita por 2 h a temperatura ambiente. La mezcla se extrae con CH2Cl2 y la fase orgánica se seca con Na2SO4, se evapora en el rotavapor y se obtiene 0.95g del producto que corresponde al 96 % de rendimiento. RMN 1H (400 MHz, CDCl3) δ 7.20 (m, 5H), 3.87 (m, 1H), 3.58 (dd, 1H, J = 11.4, 2.9 Hz), 3.0 (a, 1H), 2.70 (m, 2H). RMN 13C (100, MHz, CDCl3) δ 137.9, 129.4, 128.6, 126.6, 73.1, 66.0, 39.7.
4-bencil-2-fenoxi-2-oxo-1,3,2-dioxafosfolano 24
A una solución de 2-bencil-1,2-etanodiol (130 mg, 0.85 mmol) y trietilamina (0.24 mL, 1.72 mmol) en 10 mL de éter etílico se adiciona lentamente a 0 °C de fenildiclorofosfita disuelta en 3 mL de éter etílico (0.125 mL, 0.85 mmol). La mezcla de reacción se deja agitar por 1 hora, posteriormente se adiciona una solución 5-6 M de hidroperóxido de terbutilo en decano (0.1 mL, 0.9 mmol). Se deja reaccionar la mezcla por 1 hora más y se filtra el clorhidrato de trietilamina, el filtrado se evapora cuidadosamente a 0 °C y el crudo de reacción se analiza directamente sin purificar. Se obtiene 0.241 g de 24 que corresponde al 97 % de rendimiento. Los datos espectroscópicos se reportan como mezcla de diasteróisomeros. RMN 1H (400 MHz, CDCl3) δ 7.23 (m, 20H), 4.87 (m, 1H), 4.61 (m, 1H), 4.33 (m,1H), 4.19 (m, 2H), 3.83 (ddd, 1H, J = 9.1, 8.4, 4.7 Hz), 3.19 (dd, 1H, J =14.1, 6.9 Hz), 2.97 (dd, 1H, J = 14.1, 7.7 Hz), 2.99 (dd, 1H, J = 14.3, 6.6 Hz), 2.68 (dd, 1H, J = 14.3, 6.6 Hz). RMN 13C (100 MHz, CDCl3) δ 137.5, 134.3, 129.9,129.34, 129.1, 128.9, 128.6. 128.4, 127.4, 126.1, 125.8, 120.7, 120.4, 77.2, 70.8, 46.1, 40.2. RMN 31P (161.8 MHz, CDCl3) δ 11.4, 11.2.
Protocolo general de reacción de contracción de 21 y 22 con Bu3SnH y AIBN
A una solución de 21 o 22 (50 mg, 0.134 mmol) en 50 mL de benceno desgaseado a 80 °C se adiciona lentamente (1 h de adición) una solución de Bu3SnH y AIBN (1.2 equiv de Bu3SnH y 5-10 % en mol. de AIBN en 50 mL de benceno desgaseado). Al término de la adición, la mezcla de reacción se deja agitar por 2 h más y se evapora en el rotavapor. Los productos de reacción se caracterizan utilizando espectros-copía de Fosforo 31.
4-bencil-2-fenoxi-2-oxo-1,3,2-dioxofosfolano 24
RMN 1H (400 MHz, CDCl3) δ 7.23 (m, 10H), 4.61 (m, 1H), 4.19 (m, 2H), 3.19 (dd, 1H, J =14.1, 6.9 Hz), 2.97 (dd, 1H, J = 14.1, 7.7 Hz). RMN 13C (100 MHz, CDCl3) δ 150.42, 134.3, 129.34, 128.6. 128.4, 127.4, 126.8, 79.1, 46.1, 40.2. RMN 31P (161.8 MHz, CDCl3) δ 11.2.
4-fenil-2-fenoxi-2-oxo-1,3,2-dioxafosforinano 23
RMN 1H (400 MHz, CDCl3) δ 7.28 (m,10H), 5.57 (dt, 1H, J = 11.6, 1.8), 4.64 (ddd, 1H, J = 12.0, 11.3, 1.8 Hz), 4.53 (dddd, 1H, J = 24.9, 11.2, 4.7, 1.4 Hz), 2.40 (m, 1H), 2.06 (m,1H). RMN 13C (100 MHz, CDCl3) δ 130.1, 129.5, 129.4, 128.7, 128.4, 120.1, 60.5, 41.4, 23.4. RMN 31P (161.8 MHz, CDCl3) δ-12.6. Anal Calcd para C15H15O4P: C, 62.07; H, 5.21. Encontrado: C, 61.90; H, 5.18.
4-fenil-2-fenoxi-2-oxo-1,3,2-dioxafosforinano 25
RMN 1H (400 MHz, CDCl3) δ 7.34 (m, 10H), 5.68 (dt, 1H, J = 11, 2.9 Hz), 4.68 (m, 1H), 4.49 (m, 1H), 2.32 (m, 1H), 2.01 (m, 1H) RMN 13C (100 MHz, CDCl3) δ 130.2, 129.8, 129.6, 128.7, 127.6, 119.5, 70.9, 44.3, 25.1 31P RMN (161.8 MHz, CDCl3) δ-10.6. Anal Calcd para C15H15O4P: C, 62.07; H, 5.21. Encontrado: C, 61.90; H, 5.18.
Agradecimientos
Agradecemos a CONACyT por el apoyo económico (Proyecto No. 35102-E y Beca No. 121996).
Referencias
1. Crich, D.; Yao, Q. J. Am. Chem. Soc. 1993, 115, 1165-1166. [ Links ]
2. Koch, A.; Lamberth, C.; Wetterich, F.; Giese, B. J. Org. Chem. 1993, 58, 1083-1089. [ Links ]
3. (a) Surzur, J.-M.; Teissier, P. C. R. Acad. Sci. Fr. Ser. C 1967, 264, 1981-1984; [ Links ] (b) Surzur, J.-M.; Teissier, P. Bull. Soc. Chim. Fr. 1970, 3060-3070. [ Links ]
4. Beckwith, A. L. J.; Crich, D.; Duggan, P. J.; Yao, Q. Chem. Rev. 1997, 97, 3273-3312. [ Links ]
5. (a) Bauld, N. L. Radicals, Ion Radicals, and Triplets; Wiley-VCH:New York, 1987. [ Links ] (b) Schmittel, M.; Burghart, A. Angew. Chem., Int. Ed. Engl. 1997, 36, 2550-2589. [ Links ]
6. (a) Stubbe, J.; Kozarich, J. W. Chem. Rev. 1987, 87, 1107-1136. [ Links ] (b) Stubbe, J.; Kozarich, J. W.; Wu, W.; Vanderwall, D. E. Acc. Chem. Res. 1996, 29, 322-330. [ Links ]
7. (a) Nicolaou, K. Chemistry in Britain 1994, 30, 1, 33-36. [ Links ] (b) Crich, D.; Yao, Q. Tetrahedron 1998, 54, 305-318. [ Links ]
8. Giese, B.; Beyrich,-Graf, X.; Erdmann, P.; Giraud, L.; Imwinkelried, P.; Muller, S. N.; Schwitter, U.; J. Am. Chem. Soc. 1995, 117, 6146-6147. [ Links ]
9. Crich, D.; Huang, X.; Newcomb, M. J. Org. Chem. 2000, 65, 523-529. [ Links ]
10. Crich, D.; Ranganathan, K.; Huang, X. Org. Lett. 2001, 3, 1917-1919. [ Links ]
11. Crich, D.; Neelamkavil, S. Org. Lett. 2002, en prensa. [ Links ]
12. Crich, D.; Sartillo-Piscil, F.; Quintero-Cortés, L.; Wink, D. J. J. Org. Chem. 2002, 67, 10, 3360-3364. [ Links ]
13. (a) Gorenstein, D. G.; Rowell, R. J. Am. Chem. Soc. 1979, 101, 4925-4928. [ Links ] (b) Gorenstein, D. G.; Rowell, R. F. J. J. Am. Chem. Soc. 1980, 102, 5077-5081. [ Links ]
14. Cullis, P. M.; Jarvest, R. L.; Lowe, G.; Potter, B. V. L. J. Chem. Soc., Chem. Commun. 1981, 245-246. [ Links ]
15. Juaristi, E. and Cuevas, G. Tetrahedron 1992, 48, 5019-5087. [ Links ]
16. Dolby, L. J.; Wilkins, C.; Frey, T. G. J. Org. Chem. 1966, 31, 4, 1110-1116. [ Links ]
17. Castro, J.; Noller, C. R. J. Am. Chem. Soc. 1946, 68, 203-204. [ Links ]
17. Barluenga, J.; Flores, J.; Yus, M. J. Chem. Soc. Perkin Trans. I, 1983, 3019-3026.














