Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 no.4 Ciudad de México oct./dic. 2002
Investigación
Influencia del intercambio iónico de clinoptilolita natural en la cinética de adsorción de CO2, N2 y CH4 a 20 °C
Gelacio Aguilar Armenta,* María Eugenia Patiño Iglesias
Centro de Investigación de la Facultad de Ciencias Químicas. Benemérita Universidad Autónoma de Puebla, Blvd. 14 Sur y Av. San Claudio, Ciudad Universitaria, C. P. 72570, Puebla, Pue., México. Tel.: (222) 2 295-500 Ext. 7383; Fax: (222) 2 295584. E-mail: geaguila@siu.buap.mx
Recibido el 29 de abril del 2002.
Aceptado el 22 de noviembre del 2002.
Resumen
En este trabajo se estudió la cinética de adsorción de CO2, N2 y CH4 puros a 20 °C en clinoptilolita natural (ZSL), proveniente de Villa de Reyes, San Luis Potosí, México, y en muestras de clinoptilolita cambiadas parcialmente con Na+, K+, Ca2+ y H+ (ZSL-Na, ZSL-K, ZSL-Ca, ZSL-H), utilizando un sistema volumétrico de alto vacío. La capacidad de adsorción que presentaron las muestras ZSL-Na, ZSL-K, ZSL-Ca y ZSL de adsorber estos gases, a tiempos bajos de contacto, disminuyó en el orden CO2 > N2 > CH4, mientras que en la muestra ZSL-H disminuyó en la secuencia CO2 > CH4 > N2. Las muestras ZSL-Ca y ZSL-Na pueden ser recomendadas para la separación de mezclas CO2 / CH4 y N2 / CH4.
Palabras clave: Zeolitas naturales, adsorción, cinética, clinoptilolita, difusión.
Abstract
In this work, the adsorption kinetics of pure CO2, N2 y CH4 on natural clinoptilolite (ZSL) from Villa de Reyes, San Luis Potosi, Mexico, and on clinoptilolite samples exchanged partially with Na+, K+, Ca2+ y H+ (ZSL-Na, ZSL-K, ZSL-Ca, ZSL-H) was studied at 20 °C using a high volumetric system. The adsorption uptake for the ZSL-Na, ZSL-K, ZSL-Ca, and ZSL samples, at short contact times, decreased in the order CO2 > N2 > CH4, whereas for the ZSL-H sample decreased in the order CO2 > CH4 > N2. The ZSL-Ca y ZSL-Na samples could be recommended for the separation of CO2 / CH4 and N2 / CH4 mixtures.
Keywords: Natural zeolites, adsorption, kinetics, clinoptilolite, diffusion.
Introducción
En el esqueleto de la clinoptilolita se encuentran dos canales paralelos A y B, los cuales están formados por anillos de 10 y 8 miembros, respectivamente. Los canales A y B están interconectados con un tercer canal C, compuesto por anillos de 8 miembros [1]. El tamaño (Å) aproximado de los canales es: A, 4.4 × 7.2; B, 4.1 × 4.7; C, 4.0 × 5.5. Pequeños cationes hidratados, como Na+, K+, Ca2+ y Mg2+, pueden entrar libremente en estos canales y ocupar determinados sitios [2-4], denominados M1, M2, M3 y M4. Los sitios y cationes están localizados y distribuidos [3] de la manera siguiente: M1 está en el canal A, donde los cationes Na+ y Ca2+ (Na+ > Ca2+) se ubican en la intersección de los canales A y C; M2 está en el canal B con Ca2+ > Na+; M3 está en el canal C en donde hay solamente K+ y M4 está en el canal A en donde hay solamente Mg2+. Estos cationes son los centros específicos para la adsorción de las moléculas y, por lo tanto, juegan un papel importantísimo en el comportamiento de los procesos de adsorción y separación de mezclas de gases. La clinoptilolita intercambiada con K+ [5] aumenta el coeficiente de producción de O2 del aire. En trabajos previos [6, 7] se ha informado que la clinoptilolita natural puede ser usada en la separación de mezclas N2 / CH4 y que una muestra parcialmente intercambiada con cationes alcalino-térreos es selectiva para el N2.
Las zeolitas naturales, fundamentalmente la shabasita y clinoptilolita, se utilizan en los procesos de purificación del gas natural [8], con alto contenido de CO2, H2S y humedad. En los últimos 25 años ha despertado un gran interés la utilización de recursos energéticos, considerados antes poco rentables. En 1975 [9] fue montado un módulo experimental (EE.UU.) para la recuperación y purificación del gas (50 % CH4, 40 % CO2, y 10 % de H2O, H2S y mercaptanos), generado por la descomposición anaeróbica de desechos orgánicos. El gas generado se comunica a adsorbedores para la eliminación previa de H2O, H2S y mercaptanos. El gas semipurificado se dirige, posteriormente, a tres adsorbedores conectados en paralelo [9], conteniendo una mezcla de zeolitas naturales (erionita-shabasita) para retener selectivamente al CO2, obteniéndose CH4 de alta pureza. Se ha informado [10] que una muestra de clinoptilolita natural puede ser utilizada para la separación, económicamente viable, de mezclas de N2 y CH4 por el método PSA (Pressure Swing Adsorption) y que la eficiencia de esta separación puede ser controlada por la población catiónica del sólido. En los trabajos [4,11] se propone a muestras de clinoptilolita, previamente sometidas a procesos de intercambio iónico con soluciones acuosas de cationes Na+, K+ y Ca2+ para la separación de mezclas de N2 y CH4.
El objetivo del presente trabajo consistió en modificar muestras de clinoptilolita natural, por medio del intercambio iónico con los siguientes cationes H+, Na+, K+ y Ca2+, y estudiar la influencia de estas modificaciones en el comportamiento de la cinética de adsorción de CO2, N2, CH4. La meta consiste en explorar, a través del estudio de la cinética de adsorción de los gases individuales, la posibilidad de uso de este recurso natural de nuestro País en procesos de separación de mezclas binarias de estos gases, principalmente de CO2 / CH4 y N2 / CH4.
Parte experimental
La clinoptilolita original, sin modificación química previa, se denominará ZSL y las muestras sometidas a intercambio iónico con soluciones acuosas de CaCl2, KCl, NaCl y HCl se designarán, respectivamente, como ZSL-Ca, ZSL-K y ZSL-Na y ZSL-H.
La modificación química previa de la clinoptilolita natural con soluciones acuosas de NaCl, KCl, CaCl2 y HCl, a la concentración de 0.5 N, se realizó a 65 °C en condiciones de flujo y a presión atmosférica. En una columna de vidrio se colocó un gramo de sólido y se le hizo pasar, por gravedad, 250 mL de solución a una velocidad de una gota por segundo. Posteriormente, las muestras en la misma columna fueron lavadas con agua desionizada hasta la eliminación de Cl-. La composición química de las muestras (Tabla 3) se determinó por absorción atómica en un equipo Perkin-Elmer A Analyst 100. La cinética de adsorción de los gases puros se midió en un sistema volumétrico de alto vacío, construido totalmente en vidrio Pyrex y equipado con válvulas libres de grasa. Las muestras (malla 30 / 40) se pretrataron al alto vacío in situ a 350 °C hasta alcanzar un vacío del orden de 6 × 10-4 Torr. El alto vacío fue creado por una bomba turbomolecular (Balzers) y las presiones se midieron con dos transductores digitales (Balzers) para alta (1-1000 mb) y baja (10-4-1 mb) presiones. Durante las mediciones cinéticas, la disminución de la presión en el sistema se midió automáticamente con la ayuda de una tarjeta de adquisición de datos, diseñada para este fin, capaz de registrar 5 datos de presión por segundo. La presión inicial en todos los experimentos fue igual a 600 mb (450 Torr).
Resultados y discusión
Las curvas cinéticas del proceso de adsorción de CO2, N2 y CH4 en ZSL, ZSL-Ca, ZSL-K ZSL-Na y ZSL-H se muestran en las Figs. (1a, 2a, 3a) y (1b, 2b, 3b) a tiempos bajos y altos (t → eq) de contacto, respectivamente. De estas figuras se observa que la introducción de los cationes Ca2+, K+, Na+ influye marcadamente y de distinta manera en el comportamiento de la cinética de adsorción de los gases. Con fines de comparación, así como para establecer la influencia de cada tipo de catión, en estas figuras se incluyen las respectivas curvas cinéticas de adsorción para la muestra ZSL y para la muestra ZSL-H. La presentación de las curvas cinéticas a tiempos bajos y altos t → ∞ (eq) de contacto adsorbente-adsorbato tuvo el propósito de observar cómo se comporta la adsorción de los distintos gases en el inicio del proceso y en el estado de equilibrio, es decir, establecer en qué medida puede influir el factor difusional en la velocidad de adsorción de las moléculas de los gases en estudio.
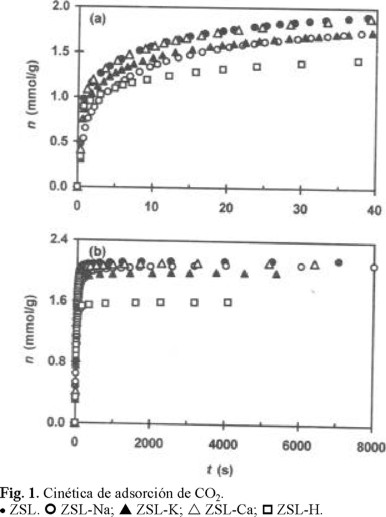

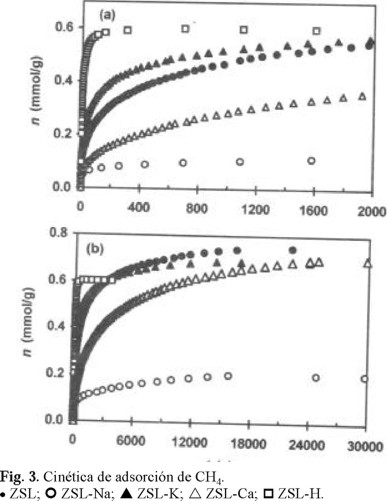
Los resultados de las Figs. 1, 2 y 3 muestran que la introducción de cationes en la estructura microporosa de la clinoptilolita natural (ZSL) influyó en el comportamiento cinético de la adsorción de los tres gases. Se estableció (Fig. 1a) que para t < 10 s, la cantidad adsorbida (n) del CO2 en función del tiempo (t) se comportó de la manera siguiente ZSL ≈ ZSL-Ca > ZSL-K > ZSL-Na. En el estado de equilibrio (Fig. 1b) se observó la tendencia ZSL ≈ ZSL-Ca ≈ ZSL-Na > ZSL-K. Es importante informar que la diferencia ZSL-K > ZSL-Na para t = 2 s fue de 18 %. Por otro lado, la diferencia ZSL-Na > ZSL-K en el equilibrio adquirió un valor de 5.3 %, superior al error experimental (2.1 %) de las mediciones cinéticas. Los comportamientos cinéticos del proceso de la adsorción del N2 fueron muy marcadas: para t < 900 s se estableció que ZSL-Ca > ZSL > ZSL-K > ZSL-Na, mientras que en el equilibrio ZSL-Ca > ZSL > ZSL-Na > ZSL-K. La diferencia ZSL-Na > ZSL-K en este último caso fue de 12.4 %. Las moléculas con momento cuadrupolar, como CO2 y N2 (Tabla 1), son capaces de interaccionar específicamente con los cationes de la estructura zeolítica. El hecho de que n para ambos gases (CO2, N2), en el estado de equilibrio, haya disminuido en el orden ZSL-Ca > ZSL-Na > ZSL-K probablemente puede estar relacionada con la disminución del potencial iónico (Tabla 2) de los cationes en esa misma secuencia: Ca2+ > Na+ > K+. Por otro lado, el hecho de que la capacidad de adsorción que presenta ZSL-Na, a t bajos, sea menor que la de ZSL-K, puede ser atribuido a un efecto de bloqueo de los cations Na+ ubicados en los sitios M1. Fue interesante observar (Fig. 3) que la muestra ZSL-Na haya presentado la menor capacidad de adsorción para la molécula más grande de CH4. Este efecto bloqueador por los cationes Na+ puede ser evaluado por el tiempo (s) que se requiere para que la curva cinética de adsorción de cada gas en ZSL-Na alcance a la curva cinética en ZSL-K: CO2 (30-50) < N2 (750-900) < CH4 (nunca). En esta secuencia aumenta el diámetro cinético σ (Å) de las moléculas (Tabla 1): CO2 (3.30) < N2 (3.64) < CH4 (3.80). Llama la atención el hecho de que para tiempos de contacto menores al del equilibrio, la velocidad de adsorción del CH4 (Fig. 3) en la muestra ZSL-Ca sea considerablemente menor que en la muestra ZSL-K e incluso menor que en la muestra ZSL. Este resultado puede ser atribuido a que para este gas, con el mayor diámetro cinético, los cationes Ca2+ también presentan el efecto de bloqueo. En el trabajo [4] se informa que en clinoptilolita intercambiada con K+, la velocidad de adsorción de CH4 es mayor que en las muestras intercambiadas con Na+ y Ca2+. Es probable que para el CO2 y N2, el efecto de bloqueo por el Ca2+ no se haya observado debido al menor tamaño de sus moléculas y el efecto que determina la cinética del proceso de la adsorción de estos gases es el de las interacciones específicas de sus cuadrupolos con el campo eléctrico creado por los cationes de intercambio.



El análisis de la composición química de las muestras (Tabla 3) reveló que el contenido de K+ en la muestra ZSL es muy alto y que posee en su estructura bajas cantidades de Na+ y Ca2+. A esto último probablemente obedezca el hecho de que la adsorción de CH4 en ZSL se verifique a mayor velocidad que en ZSL-Na y ZSL-Ca.
Los cationes Na+ y K+, como se puede observar de la Tabla 3, sustituyen totalmente a los cationes Ca2+, pero el Ca2+ sustituye parcialmente a los K+ y no es capaz de sustituir a los Na+. Además, se observa que el K+ prácticamente no sustituye al Na+. Los resultados del análisis químico (Tabla 3) revelaron que la acidificación de la muestra condujo a un intercambio casi total de los cationes K+ por H+, mientras que los cationes Na+ y Ca2+ permanecieron en la estructura zeolítica. El hecho de que el contenido (% en peso) de estos cationes, principalmente de Na+, haya resultado mayor que en la muestra ZSL, probablemente obedezca a la caída drástica del contenido de K+.
La modificación previa con HCl condujo a una disminución de la basicidad (aumento de la acidez) del adsorbente, provocando, como consecuencia, una disminución de la adsorción de la molécula del CO2 (Fig. 1). De la Figura 3a se observa un aumento drástico de la velocidad del proceso de la adsorción del CH4 en la muestra ZSL-H en comparación con las otras muestras. Es necesario indicar que, a tiempos bajos de contacto, este aumento fue observado también, aunque en menor proporción, para el CO2 y N2 en la muestra ZSL-H. Este resultado puede obedecer a que al introducir los cationes pequeños de H+, el tamaño de las ventanas de entrada en los microporos haya aumentado, favoreciendo el proceso difusional para la molécula más grande de CH4. Sin embargo, en el estado de equilibrio (Fig. 3b), la cantidad de gas adsorbido es alcanzada y rebasada por la de las otras muestras, con excepción de la muestra ZSL-Na, la cual presenta el efecto bloqueador por los cationes Na+.
Con excepción de la muestra ZSL-H, la capacidad que presentaron todas las demás muestras de adsorber los gases, a tiempos bajos de contacto, disminuyó en el orden CO2 > N2 > CH4, es decir, en el orden de la disminución del momento cuadrupolar (Tabla 1) de los gases. Debido a la mayor polarizabilidad de la molécula de CH4 que de N2, la cantidad de gas adsorbido en ZSL-H disminuyó en la secuencia: CO2 > CH4 > N2.
En virtud de la complejidad de la estructura microporosa de las clinoptilolitas, es evidente que existen muchos factores que están involucrados en el proceso difusión-adsorción de las moléculas. Para argumentar con mayor rigurosidad la influencia de un determinado tipo de catión en el proceso de adsorción, será necesario estudiar la cinética de adsorción de estos gases en muestras homoiónicas de clinoptilolita.
Comparación de la influencia de la modificación química de ZSL para determinados pares de gases
En esta sección, la posibilidad del uso de un adsorbente dado para la separación de mezclas binarias N2 / CH4 y CO2 / CH4 se evaluará con base en la diferencia del comportamiento cinético del proceso de la adsorción de cada gas en estado puro.
N2 / CH4
En las Figs. 4 (a, b), 5 (a, b), 6 (a, b) y 7(a, b) se presentan las curvas cinéticas de adsorción de estos gases a tiempos bajos (t 100 s) y altos (equilibrio) de contacto en las muestras ZSL-K, ZSL-Na, ZSL-Ca y ZSL-H, respectivamente. Con fines de comparación, en cada una de estas figuras se incluyen las curvas cinéticas de adsorción de ambos gases para la muestra ZSL. Los resultados revelaron que a tiempos bajos y altos (equilibrio) de contacto, la muestra ZSL-Na (Fig. 5 a,b) adsorbe N2 más rápido y en mayores cantidades que CH4 (N2 > CH4), mientras que para la muestra acidificada ZSL-H (Fig. 7a,b) se observa todo lo contrario: CH4 > N2. Para el caso de ZSL-K, ZSL y ZSL-Ca existe un cambio de selectividad de adsorción hacia uno u otro gas en función del tiempo de contacto. La selectividad hacia CH4 (CH4 > N2) de las muestras aparece en el orden de aumento del tiempo de contacto t (s): ZSL-K (260) < ZSL (2000) < ZSL-Ca (16000). Es interesante observar que el contenido del cation K+ (Tabla 3) en las muestras disminuye en el siguiente orden: ZSL-K > ZSL > ZSL-Ca. Estos resultados revelan que el contenido de K+ determina la selectividad hacia CH4 en el equilibrio. Es decir, mayor contenido de K+ y, por lo tanto, mayor acidez, favorece la selectividad hacia CH4 debido a la contribución del factor de polarización [12] en la energía total de interacción adsorbente-adsorbato. Como se indicó anteriormente, la muestra ZSL-Na siempre presentó mayor adsorción de N2 que de CH4 a pesar de que contiene, a excepción de ZSL-H, el contenido más bajo de K+. El hecho de que para ZSL-Na nunca se haya observado la selectividad hacia CH4 puede obedecer al efecto bloqueador del proceso difusión-adsorción en la microporosidad del sólido.
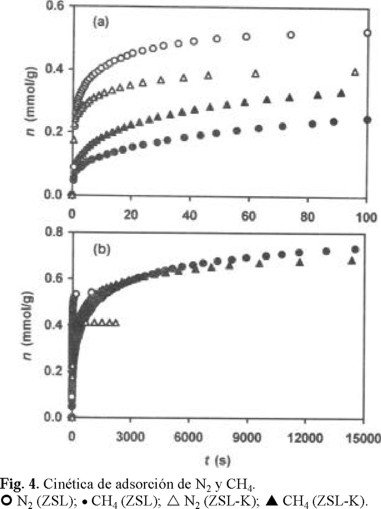


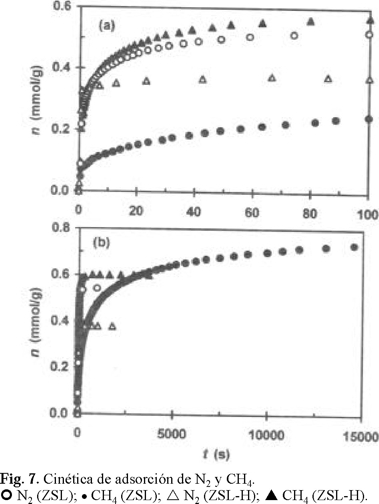
Las Figs. 4a, 5a y 6a muestran que la eficiencia de separación de mezclas binarias reales N2 / CH4 podría disminuir en el orden de disminución de la electronegatividad de los cationes (Tabla 2) Ca2+ > Na+ > K+, es decir, en el orden de disminución de la basicidad de las muestras. Cuando la acidez de la muestra aumenta, la adsorción de CH4 también aumenta (Fig. 7), superando la adsorción de N2. Este hecho puede obedecer a la mayor polarizabilidad de la molécula de CH4 (Tabla 1), que de N2, así como también a que al cambiar los cationes grandes Na+, K+ y Ca2+, principalmente K+ (Tabla 3), por cationes pequeños H+ existe un aumento del tamaño de las ventanas de entrada en los microporos, facilitando, como consecuencia, la penetración de las moléculas de CH4 a través de estas ventanas y, por lo tanto, provocando un aumento de la difusión en el interior de los microporos.
En la muestra ZSL-K, la velocidad de adsorción de N2 disminuyó y la de CH4 aumentó (Fig. 4a), respecto a lo observado para la muestra original ZSL. Esto indica, por lo tanto, que para llevar a cabo la separación de estos gases no hay que introducir cationes K+ en su estructura. Sin embargo, la modificación con Ca2+ (Fig. 6a) condujo a un efecto totalmente opuesto al anterior, es decir, que es recomendable el tratamiento de la muestra con Ca2+ para una mejor separación de mezclas N2 / CH4. En el caso del Na+ (Fig. 5a) se puede afirmar, que a pesar de que la adsorción de N2 haya disminuido considerablemente, esta modificación es recomendable debido a la muy baja adsorción del CH4 que presenta la muestra ZSL-Na.
Como se indicó anteriormente, la muestra ZSL-H (Fig. 7) presentó una mayor adsorción de CH4 que de N2, por lo que, al contrario de las otras cuatro muestras, puede ser utilizada para purificar N2 contaminado con CH4. Sin embargo, es poco probable que esta muestra presente buena eficiencia de separación de la mezcla CH4 / N2 debido a que la adsorción de N2 es considerable.
CO2 / CH4
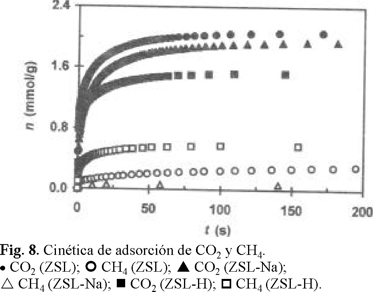
Todas las muestras siempre presentaron una selectividad de adsorción hacia CO2, observándose que la eficiencia de separación de estos gases disminuye en el orden: ZSL-Na ≈ ZSL-Ca > ZSL > ZSL-K > ZSL-H. Para mayor claridad, en la Fig. 8 se presentan las curvas cinéticas de adsorción de estos gases sólo para las muestras ZSL-Na, ZSL y ZSL-H. Debido a la muy baja adsorción de CH4, las muestras cálcica y sódica podrían recomendarse para llevar a cabo la separación de estos gases con mejor eficiencia que la muestra natural. El hecho de que se haya observado una disminución de la adsorción de CO2 (Fig. 1a) y un aumento de la adsorción del CH4 (Fig. 8) en ZSL-H indica que esta muestra no puede ser recomendada para la separación de mezclas de estos gases. En virtud de que el CO2 se retiene fuertemente en las zeolitas, gracias a la gran interacción entre los cationes existentes en la estructura de estos materiales y el gran momento cuadrupolar del gas, es posible obtener CH4 de alta pureza, utilizando principalmente las muestras ZSL-Na y ZSL-Ca.
Conclusiones
Fue establecido que la introducción de los cationes Ca2+, K+, Na+ influye marcadamente y de distinta manera en el comportamiento de la cinética de adsorción de los gases. Los cationes Na+ y Ca2+ ejercen un efecto bloqueador en el proceso difusión-adsorción y este efecto aumenta precisamente en el orden de aumento del diámetro cinético de las moléculas: CO2 < N2 < CH4. Se estableció que a bajos tiempos de contacto adsorbente-adsorbato, la eficiencia de separación de mezclas binarias reales N2 / CH4 podría disminuir en el orden de disminución de la electronegatividad de los cationes Ca2+ > Na+ > K+, es decir, en el orden de disminución de la basicidad de las muestras. Con base en el estudio de la adsorción de los gases puros, las cuatro muestras estudiadas podrían presentar la propiedad de purificar N2 y CH4 contaminados con CO2. Así mismo los resultados revelaron, que la eficiencia de separación de mezclas N2 / CH4 y CO2 / CH4 podría disminuir en la secuencia ZSL-Ca > ZSL-Na > ZSL > ZSL-K y que la muestra ZSL-H no es recomendable para estas separaciones.
Agradecimientos
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología el otorgamiento de la beca No. 144883 de doctorado a María Eugenia Patiño Iglesias.
Referencias
1. Breck, D.W. Zeolite Molecular Sieves, J. Wiley & Sons, Inc. New York, 1974; Chapter One. [ Links ]
2. Ming, D.W.; Dixon, J.B. Clays & Clay Minerals, 1987, 35, 463-468. [ Links ]
3. Koyama, K.; Takeuchi, Y. Z. Kristallogr. 1977, 145, 216-221. [ Links ]
4 Ackley, M.W.; Giese, R.F.; Yang, R.T. Zeolites, 1992, 12, 780-788. [ Links ].
5. Barrer, R. M.; Stuart W. I. Proc. Roy. Soc. 1959, A 249, 464-483. [ Links ]
6. Ayao, T.; Yoshihiro, M. J. Soc. Mater. Sci. Japan, 1979, 28, 794-797. [ Links ]
7. Hernández-Huesca, R.; Diaz, L.; Aguilar-Armenta, G. Sep. and Purif. Technol. 1999, 15, 163-173. [ Links ]
8. Mumpton, F. A. Miner. Soc. Amer. 1997, 4, 177-204. [ Links ]
9. Goeppner, J.; Masselmann, D. E. Water and Wastes Eng. 1974, 11, 30-38. [ Links ]
10. Frankiewicz, T. C.; Donnelly, R. G. In: Industrial Gas Separations, Whyte, T. E., Jr., et al., Eds.; Am. Chem. Soc.: Washington, DC, 1983; p. 213. [ Links ]
11. Aguilar-Armenta, G.; Hernández-Ramírez, G.; Flores-Loyola, E.; Ugarte-Castañeda, A.; Silva-González, R.; Tabares-Muños, C.; Jiménez-López, A.; Rodríguez-Castellón, E. J. Phys. Chem. B 2001, 105, 1313-1319. [ Links ]
12. Ruthven, D. M. Principles of adsorption and adsorption processes. J. Wiley & Sons, New York, 1984; Chapter 2, p. 33. [ Links ]














