Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 no.3 Ciudad de México jul./sep. 2002
Investigación
Un estudio cuantitativo de la relación estructura-actividad de una serie de N-[2-(dimetilamino)etil]acridina-4-carboxamidas con actividad citotóxica
Zurisaddai Hernández-Gallegos* y Víctor Pérez-Álvarez
Sección Externa de Farmacología, Centro de Investigación y de Estudios Avanzados, Instituto Politécnico Nacional, AP 14-740, México DF. 07000, México. Tel. 5747-7000, Ext. 5426, Fax 5747-7095. E-mail zhernand@mail.cinvestav.mx
Recibido el 13 de marzo del 2002.
Aceptado el 5 de julio del 2002.
Resumen
Se presentan los resultados de un análisis Hansch de la actividad citotóxica de una serie de N-[2-(dimetilamino)etil]acridina-4-carboxamidas. Los resultados mostraron que la actividad citotóxica de los compuestos esta relacionada con el tamaño y capacidad deslocalizante de carga positiva de los sustituyentes. Se encontró una dependencia parabólica de la actividad citotóxica con respecto a la anchura de los sustituyentes en la posición 5 de la molécula, mientras que para los susituyentes en las posiciones 6 y 7 se encontró que existía impedimento de tipo estérico.
Palabras clave: Estructura-actividad, acridinas, actividad citotóxica, QSAR.
Abstract
The Hansch analysis was applied to a series of N-[2-(dimethylamino)ethyl] acridine-4-carboxamide analogues with cytotoxic activity. The results showed a significant relationship between the cytotoxicity of the compounds and the size and the delocalizating positive charge of the substituents. A parabolic dependence of cytotoxic activity was observed with the width of substituents in 5-position, while for substituents in the 6-position and 7-position steric hindrance was found.
Keywords: Structure-activity, acridines, cytotoxic activity, QSAR.
Introducción
Las acridinas son una clase importante de agentes intercaladores del DNA que presentan actividad inhibitoria de las topoisomerasas I y II [1, 2]. Su valor potencial como agentes anticancerígenos ha incrementado el interés por este tipo de compuestos, dando lugar a la síntesis y evaluación biológica de diversas series de acridinas [3-5]. Esta búsqueda ha conducido al descubrimiento de las acridina-4-carboxamidas, que constituyen una nueva generación de agentes intercaladores del DNA con actividad de amplio espectro contra una variedad de tumores murinos y leucemias. Las acridina-4-carboxamidas han sido estudiadas intensivamente y uno de los derivados, la N-[2-(dimetilamino)etil]acridina-4-carboxamida (DACA; Fig. 1), ha completado los estudios clínicos de fase I [6]. Estudios cristalográficos sugieren que las acridina-4-carboxamidas se intercalan entre pares de bases citosina-guanina contiguos, con su cadena lateral básica descansando sobre el surco mayor de la hélice de DNA [7,8]. Estos estudios también muestran que tanto el núcleo acridina como la cadena N-[2-(dimetilamino) etil]carboxamida toman parte en la interacción de la molécula con el DNA.

Recientemente se ha reportado en la literatura una serie de acridinas análogas de DACA que presentan una gran variedad de sustituyentes en el núcleo acridina de la molécula [9]. En ese estudio, los autores no pudieron encontrar correlaciones satisfactorias para toda la serie de compuestos. En el presente trabajo se presenta un estudio cuantitativo de la relación estructura-actividad (QSAR, por sus siglas en inglés) que explora la influencia de los efectos hidrofóbicos, electrónicos y estéricos de los sustituyentes sobre la actividad citotóxica de estos compuestos.
Datos y métodos
Los datos analizados en el presente trabajo son aquellos reportados por Spicer y colaboradores, que incluyen la citotoxicidad en las líneas celulares: leucemia murina P388 (P388), carcinoma pulmonar murino de Lewis (LLTC) y leucemia Jurkat humana tipo salvaje (JLC), de 36 análogos de DACA [9]. De los compuestos reportada en ese estudio, se descartaron aquellos sustituidos en las posiciones 8 (2 compuestos) y 9 (2 compuestos) y sólo se trabajó con los sustituidos en las posiciones 5, 6 o 7. También fueron descartados los compuestos 5-azo y 7-CONH(CH2)2N(CH3)2 por no contar con los parámetros fisicoquímicos de estos sustituyentes. Los compuestos 6-CF3 y 7-CF3 no se ajustaron a los modelos propuestos y por ello no fueron tomados en cuenta en la derivación final de los mismos. La estructura de los 28 análogos de DACA incluidos en el estudio y sus datos de actividad citotóxica (expresada en términos de log (1/CI50), en donde CI50 es la concentración inhibitoria media) son presentados en la Tabla 1.
El análisis de QSAR realizado consistió en un análisis de tipo Hansch, en donde la actividad biológica (variable dependiente) es correlacionada con uno o varios parámetros moleculares (variables independientes) por medio de análisis de regresión simple o múltiple. Esto con el propósito de encontrar un modelo matemático que nos permita proponer qué propiedades moleculares son importantes o determinantes para la actividad biológica de una serie de compuestos. La validez de cada ecuación obtenida fue determinada por los estadísticos: coeficiente de correlación (r2), desviación estándar (s) y la bondad del ajuste dado por la prueba de F. Los análisis de regresión y la evaluación estadística de las ecuaciones obtenidas fueron realizadas por medio del programa SigmaStat versión 2.03 (SPSS Inc., Chicago Illinois, USA).
El efecto electrónico de los sustituyentes fue estimado por el parámetro σ+ (constante de Hammett para la deslocalización de carga positiva), cuyos valores fueron tomados de Hansch y colaboradores [10]. Los valores correspondientes de σ+ ortho, σ+ meta, y σ+ para fueron aplicados a los sustituyentes en las posiciones 5, 6 y 7, respectivamente. Para aquellos sustituyentes en posición 5 cuya σ+ ortho no estaba reportada, y que fueron etilo, isopropilo, dimetilamino y trifluorometilo, se les aplicaron los correspondientes valores de σ+ para (ya que el efecto electrónico de un sustituyente en ortho y para es muy parecido). La anchura (W) y longitud (L) de los sustituyentes, calculadas a partir de parámetros Sterimol [11], fueron usadas para medir el efecto estérico de los sustituyentes. Debido a que varios estudios han mostrado que el nitrógeno del núcleo acridina de análogos de DACA está protonado a pH neutro [8,12], se realizaron cálculos de mecánica molecular (método MMFF94, programa TITAN, Wavefunction Inc., Irvine, CA, USA y Schrödinger Inc., Portland, OR, USA) para examinar la conformación de los sustituyentes bajo estas condiciones. Estos cálculos indicaron que la conformación preferida de los sustituyentes fenilo y dimetilamino en posición 5 es diferente de aquella que presentan cuando están en posición 6 o 7, por lo que valores diferentes del parámetro W fueron usados para estos sustituyentes dependiendo de su posición. Los valores de los parámetros σ+, W y L usados en este trabajo son mostrados en la Tabla 1.
Cabe mencionar que además de los parámetros σ+, W y L, también fueron probadas las constantes hidrofóbicas: ϖ de Hansch y f de Leo-Hansch, los parámetros estéricos: ESde Taft, volumen de Van der Waals, refractividad molar (MR) y parámetros Sterimol B1 y B5, y los parámetros electrónicos: σ de Hammett y sus variantes σIy σR(componentes inductivo y de resonancia de σ, respectivamente), así como las constantes F y R (efectos de campo y resonancia) de Swain y Lupton, entre otros.
Resultados y discusión
El uso potencial de algún tipo de compuestos como agentes terapéuticos hace interesante y necesario conocer los requerimientos moleculares que intervienen o determinan su actividad biológica, de ahí la pertinencia de los estudios de QSAR. En el caso particular de nuestro estudio, la relación cuantitativa entre la estructura y la actividad citotóxica de compuestos análogos de DACA fue modelada por medio de las ecuaciones 1-3 (resultantes del análisis Hansch aplicado):
i) Actividad citotóxica en leucemia murina P388.

ii) Actividad citotóxica en carcinoma pulmonar murino de Lewis.

iii) actividad citotóxica en leucemia Jurkat humana.
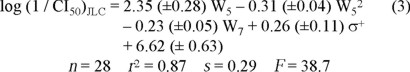
Los estadísticos de estas ecuaciones nos indican que las correlaciones encontradas son válidas (p < 0.001 en todos los casos). En cada ecuación, la prueba estadística de t aplicada a los coeficientes indicó que, en todos los casos, éstos fueron diferentes estadísticamente de cero (a un nivel de significancia de p < 0.05). El uso o la introducción del parámetro hidrófobico ϖ o de otros parámetros estéricos o electrónicos no resultó en correlaciones mejores a las representadas por las ecuaciones 1 a 3; la única excepción fue al sustituir L6 por la correspondiente anchura del sustituyente, con lo que se obtuvieron correlaciones muy semejantes (y casi tan buenas) a las de las ecuaciones 1 y 2, lo que era de esperarse ya que existe una alta correlación (r2 = 0.96) entre los parámetros L y W para los sustituyentes en posición 6.
Las ecuaciones 1 a 3 proponen que la actividad citotóxica de la serie estudiada de análogos de DACA está determinada en forma importante por el efecto estérico (tamaño) de los sustituyentes. Efecto que es diferente dependiendo de la posición de sustitución. En las tres líneas celulares existe una dependencia parabólica de la potencia citotóxica con respecto a la anchura de los sustituyentes en posición 5, encontrándose una anchura óptima de sustituyente de 3.65 Å, 3.78 Å y 3.83 Å para las líneas celulares P388, LLTC y JLC, respectivamente. En sus trabajo, Spicer y colaboradores también notaron que sustituyentes pequeños en posición 5 incrementaba la potencia citotóxica de los compuestos [9]; ellos pudieron obtener, para 10 de los compuestos sustituidos en 5, una correlación (r2 = 0.58) entre la actividad citotóxica (línea celular JLC) y el parámetro MR y sugirieron que sustituyentes de tamaño grande en esta posición disminuyen la potencia. Recientemente, Garg y colaboradores [13] publicaron un estudio de QSAR de dímeros de DACA en el que encontraron correlaciones parabólicas semejantes a las obtenidas por nosotros. Con respecto a la influencia de los sustituyentes de las posiciones 6 y 7, las ecuaciones 1 y 2 indican que existe un impedimento estérico para ellos en las líneas celulares P388 y LLTC, por lo que un incremento en el tamaño de los sustituyentes en estas posiciones implicará una disminución en la potencia citotóxica de los compuestos. En el caso de la línea celular JLC, también existe un impedimento estérico para los sustituyentes en posición 7 pero no para aquellos que se encuentran en posición 6; la inclusión del término L6 en la ecuación 3 no mejoró la correlación (r2 = 0.88) y el coeficiente correspondiente no fue diferente estadísticamente de cero (p = 0.25). Debido a que el efecto citotóxico de los compuestos tipo acridina depende tanto del hecho de su intercalación en el DNA como de su interacción molecular directa con las enzimas topoisomerasas I y II (en la formación del complejo enzima-fármaco-DNA) [14], la diferencia en la ecuación 3 podría significar de alguna manera una diferencia estructural entre las topoisomerasas (I y/o II) en JLC y aquellas en P388 y LLTC en el área de la enzima en donde interacciona con los sustituyentes en posición 6 de las acridinas.
Nuestros resultados indican además que la actividad citotóxica de los análogos de DACA también es dependiente de la influencia electrónica de los sustituyentes (expresada en términos de σ+). En este caso, la potencia citotóxica es mayor en aquellos compuestos con sustituyentes que no favorecen la deslocalización de la carga positiva del núcleo acridina (protonado a pH fisiológico), incrementando así la densidad de carga positiva del mismo. La presencia de este tipo de sustituyentes bien podría aumentar la fuerza del complejo de transferencia de carga que se forma entre los pares de bases y la molécula de acridina intercalada, reforzándose con ello la interacción con el DNA.
La hidrofobicidad de los sustituyentes parece no ser determinante para la actividad citotóxica de los compuestos estudiados; como se mencionó anteriormente, la inclusión de la constante ϖ o de algún otro parámetro de tipo hidrofóbico no fue válida estadísticamente. Lo anterior esta de acuerdo con la mayoría de los estudios de QSAR que se han realizado sobre acridinas [15].
Con el fin de validar los modelos propuestos, se buscó en la literatura otros análogos de DACA, no incluidos en nuestra serie de estudio, a los que se les hubiera determinado la actividad citotóxica en las líneas celulares P388, LLTC y JLC, encontrándose 5 nuevos compuestos disustituidos [16]. La estructura de estos compuestos, así como las potencias calculadas por las ecuaciones 1 a 3 y la experimental reportada en la literatura, son presentados en la Tabla 2. A pesar de que no existe una amplia gama de potencias entre estos 5 compuestos, se puede observar una buena correspondencia entre los valores experimentales y los calculados. Asimismo, en cada línea celular se puede observar que, con la sola excepción del compuesto 5,7-Br2 en P388 y LLTC, el orden de potencia relativo de los demás compuestos es similar entre los valores calculados y experimentales (5,7-Cl2 > 5-Cl, 7-CH3 > 5-CH3, 7-Cl > 5,7-(CH3)2).
En conclusión, nuestros resultados indican que la actividad citotóxica de las acridinas análogas de DACA estudiadas está relacionada con el tamaño y la capacidad deslocalizante de carga positiva de los sustituyentes.
Agradecimientos
Este trabajo fue financiado parcialmente por el CONACyT, donativo 28082M.
Referencias
1. Finlay, G.J.; Riou, J.-F.; Baguley, B.C. Eur. J. Cancer 1996, 32A, 708-714. [ Links ]
2. Bridwell, D. J.; Finlay, G. J.; Baguley, B.C. Cancer Chemother. Pharmacol. 1999, 43, 302-308. [ Links ]
3. Denny, W.A.; Cain, B.F.; Atwell, G.J.; Hansch, C.; Panthananickal, A.; Leo, A. J. Med. Chem. 1982, 25, 276-315. [ Links ]
4. Atwell, G.J.; Rewcastle, G.W.; Baguley, B.C.; Denny, W. A. J. Med. Chem. 1987, 30, 664-669. [ Links ]
5. Gamage, S.A.; Spicer, J.A.; Atwell, G.J.; Finlay, G.J.; Baguley, B.C.; Denny, W.A. J. Med. Chem. 1999, 42, 2383-2393. [ Links ]
6. Schofield, P.C.; Robertson, I.G.; Paxton, J.W.; McCrystal, M. R.; Evans, B.D.; Kestell, P.; Baguley, B.C. Cancer Chemother. Pharmacol. 1999, 44, 51-58. [ Links ]
7. Todd, A.K.; Adams, A.; Thorpe, J.H.; Denny, W.A.; Wakelin, L. P.G.; Cardin, C. J. J. Med. Chem. 1999, 42, 536-540. [ Links ]
8. Adams A.; Guss, J.M.; Collyer, C.A.; Denny, W.A.; Wakelin, L. P.G. Biochemistry 1999, 38, 9221-9233. [ Links ]
9. Spicer, J.A.; Gamane, S.A.; Atwell, G.J.; Finlay, G.J.; Baguley, B.C.; Denny, W.A. J. Med. Chem. 1997, 40, 1919-1929. [ Links ]
10. Hansch, C.; Leo, A.; Hoekman, D. Exploring QSAR: Hydrophobic, electronic, and steric constants. ACS, Washington DC, 1995. [ Links ]
11. Verloop, A.; Hoogenstraaten, W.; Tipker, J. In: Drug Design, Vol. 7, Ariens, E., Ed., Academic Press, London, 1976, 165-207. [ Links ]
12. Adams, A.; Guss, J.M.; Collyer, C.A.; Denny, W.A.; Prakash, A.S.; Wakelin, L. P. G. Mol. Pharmacol. 2000, 58, 649-658. [ Links ]
13. Garg, R.; Denny, W.A.; Hansch, C. Bioorg. Med. Chem. 2000, 8, 1835-1839. [ Links ]
14. Finlay, G.J.; Atwell, G.J.; Baguley, B.C. Oncol. Res. 1999, 11, 249-254. [ Links ]
15. Gao, H.; Denny, W.A.; Garg, R.; Hansch, C. Chem.-Biol. Inter. 1998, 116, 157-180. [ Links ]
16. Spicer, J.A.; Finlay, G.J.; Baguley, B.C.; Velea, L.; Graves, D. E.; Denny W. A. Anti-Cancer Drug Des. 1999, 14, 37-45. [ Links ]














