Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 no.2 Ciudad de México abr./jun. 2002
Investigación
Adsorción de salicilato de sodio en solución acuosa sobre carbón activado
R. Leyva Ramos*, L. G. Velázquez Vargas, J. Mendoza Barrón y R. M. Guerrero Coronado
Centro de Investigación y Estudios de Posgrado. FCQ, Universidad Autónoma de San Luis Potosí, Av. Dr. M. Nava. No 6, San Luis Potosí 78210, SLP, México. Tel: (444)8262-440; Fax: (444)8262-372. E-mail: rlr@uaslp.mx
Recibido el 1o. de diciembre del 2001.
Aceptado el 28 de junio del 2002.
Resumen
Los datos experimentales de adsorción del salicilato sobre carbón activado se interpretaron satisfactoriamente por la isoterma Prausnitz-Radke. La capacidad de adsorción aumenta al disminuir el pH, pero disminuye al aumentar la temperatura y cuando }l carbón se oxida con HNO3. A pH de 5 y 11, la capacidad aumenta ligeramente con la adición de NaCl, pero no a pH de 3. Se concluye que el mecanismo de adsorción del salicilato es dependiente del pH y de la interacción entre la molécula del salicilato y la superficie del carbón.
Palabras clave: Adsorción, salicilato, Prausnitz-Radke, carbón.
Abstract
The experimental adsorption data of salicylate onto activated carbon were interpreted satisfactorily by the Prausnitz-Radke isotherm. The adsorption capacity increases diminishing the pH, but decreases increasing the temperature and when the carbon is oxidized with HNO3. At pH 5 and 11, the capacity increases lightly with the NaCl addition, but no at pH 3. It is concluded that the adsorption mechanism of salicylate is dependent upon the pH and the interaction between the salicylate molecule and the carbon surface.
Keywords: Adsorption, salicylate, Prausnitz-Radke, carbon.
Introducción
La presencia de compuestos orgánicos en aguas subterráneas, potables y residuales municipales e industriales, representa un serio peligro para el medio ambiente y, en particular, para la salud humana. La gran mayoría de estos compuestos son tóxicos, cancerígenos y resistentes a la biodegradación natural (recalcitrantes)[1]. Las principales fuentes de estos compuestos orgánicos son las descargas industriales y municipales y los lixiviados de confinamientos de residuos industriales y municipales. Los compuestos orgánicos tóxicos más frecuentemente encontrados son los compuestos fenólicos y el salicilato es uno de los más típicos, ya que tiene aplicaciones muy diversas [2].
Los compuestos orgánicos se pueden eliminar del agua mediante varios procesos y entre estos destaca la adsorción sobre carbón activado, que es la mejor tecnología disponible para tratar soluciones acuosas que contienen los compuestos orgánicos siguientes: solventes aromáticos, aromáticos polinucleares, aromáticos clorados, surfactantes, compuestos fenólicos, pesticidas, herbicidas, aminas aromáticas y alifáticas de alto peso molecular y colorantes orgánicos solubles [1].
El carbón activado es el adsorbente más versátil y eficiente para remover compuestos orgánicos en solución acuosa. Su capacidad de adsorción se debe no solamente a su gran área específica sino también a su naturaleza, la cual depende considerablemente del proceso de oxidación-activación empleado para preparar el carbón activado [3, 4]. En solución acuosa el carbón activado tiene un comportamiento anfotérico, esto significa que la carga de su superficie depende del pH de la solución. Este comportamiento es muy importante en la adsorción de solutos débiles, porque éstos se pueden adsorber como moléculas disociadas o sin disociarse. Dependiendo del pH de la solución, el soluto disociado puede ser atraído o repelido por interacciones electrostáticas entre la superficie del carbón y la molécula del soluto disociado [5]. Por otro lado, el soluto sin disociar puede acumularse en la superficie debido a interacciones hidrofóbicas entre la molécula del soluto y el solvente o bien por la afinidad específica que puede existir entre la molécula del soluto y los sitios activos del carbón. Por lo tanto, la adsorción de un compuesto orgánico sobre carbón activado depende de las interacciones entre la molécula orgánica y los sitios activos del carbón, es decir los complejos superficiales del oxígeno [6].
El ácido salicílico y sus derivados constituyen aproximadamente la mitad del total de medicamentos derivados del alquitrán de hulla que se producen en los Estados Unidos [2]. Por otro lado, el salicilato presente en las aguas residuales se debe remover para evitar la contaminación de ríos, lagos y mantos acuíferos. En un estudio anterior [7] se reportó que el salicilato se adsorbió sobre carbón activado y la masa adsorbida disminuyó drásticamente cuando el pH se incrementó de 1 a 13; sin embargo, es necesario investigar más detallada y extensamente la adsorción de salicilato sobre carbón activado. Esto permitirá saber si el salicilato presente en solución acuosa se puede remover mediante la adsorción sobre carbón activado.
El objetivo del presente trabajo es investigar el efecto de las interacciones moleculares entre el salicilato y la superficie del carbón, así como el efecto del pH y de la temperatura sobre la isoterma de adsorción. Además, se estudiará el efecto de la oxidación del carbón sobre la capacidad de adsorción y la reversibilidad de la isoterma de adsorción, y se elucidará el mecanismo de adsorción.
Metodología experimental
En este estudio se usó carbón activado marca Barneby-Sutcliff, denominado comercialmente como PE y fabricado a partir de concha de coco. El carbón activado se trató mediante el procedimiento siguiente: se lavó varias veces con agua destilada, hasta que el agua ya no presentó polvo de carbón suspendido, luego se secó en una estufa a 383 K durante 24 h y se guardó en un recipiente de plástico cerrado. El carbón se caracterizó físicamente por medio de un equipo de fisisorción, marca Micromeritics, modelo ASAP 2010, y además, se le determinaron los sitios ácidos y básicos por el método de titulación ácido-base propuesto por Boehm [8].
La determinación de la carga del carbón activado en solución acuosa así como la variación de ésta con respecto al pH se efectuó por el método de titulación potenciométrica ácido-base reportado en la literatura [9,10]. A partir de esta información se evaluó el punto de carga cero (PCC) del carbón. Más detalles sobre la metodología y los cálculos se pueden encontrar en Ruiz Salazar [10].
El carbón se oxidó con ácido nítrico mediante el procedimiento siguiente: A un vaso de precipitado de 1000 mL se agregaron 40 g de carbón tratado y se añadieron 200 mL de una solución de ácido nítrico al 50 % v/v. Luego, se calentó durante 2 h aproximadamente, procurando que la temperatura no fuese mayor de 323 K, se dejó enfriar la solución a temperatura ambiente (≈ 20 °C) y se drenó la solución ácida. El carbón se dejó en agua desionizada durante 24 h, y enseguida se lavó varias veces con agua desionizada hasta que el pH del agua de lavado se mantuvo constante y cercano al pH del agua desionizada. Posteriormente, se secó en una estufa a 383 K durante 24 h y se guardó en un rec©piente cerrado.
Los datos experimentales de la isoterma de adsorción se obtuvieron en#un adsorbedor de lote consistente de un matraz Erlenmeyer de 500 mL, colocado dentro de un baño a temperatura constante. La solución del adsorbedor se mezcló por medio de una barra de agitación recubierta con Teflón, accionada por una placa de agitación colocada debajo del baño de temperatura constante. El carbón se colocó en canastillas de malla de Nylon para evitar que la fricción entre las partículas y la pared formase polvos finos que interfirieran con el análisis de la solución.
La concentración del salicilato de sodio en solución acuosa se determinó por un método espectrofotométrico UV-Visible. La absorbancia se midió mediante un espectrofotómetro UV-Visible de doble haz, marca Shimadzu, modelo UV-160, a una longitud de onda de 297 nm. La concentración de la muestra se determinó preparando previamente una curva de calibración, concentración contra absorbancia, en un intervalo de concentraciones de 1 a 20 mg / L, al mismo pH de la muestra.
Los datos de las isotermas de adsorción se obtuvieron en el adsorbedor de lote, contactando 0.5 o 0.25 g de carbón con un volumen de 250 o 500 mL de una solución de salicilato de sodio de concentración inicial conocida y pH ajustado previamente. Antes de agregar el carbón se tomó una muestra de 10 mL para corroborar la concentración inicial del salicilato de sodio en la solución. El carbón se agregó a la solución de salicilato y se dejaron en contacto durante 6 o 7 días, tiempo suficiente para alcanzar el equilibrio. En cada periodo de tiempo el pH de la solución se midió por medio de un pHmetro y se ajustó a un cierto valor adicionando, según el caso, solución de HCl o NaOH 0.01 M. Se consideró que ya se había alcanzado el equilibrio cuando las concentraciones de dos muestras consecutivas no varían significativamente. Las concentraciones de las muestras se determinaron mediante el procedimiento indicado, mientras que la cantidad de salicilato adsorbido sobre el carbón se calculó mediante un balance de masa.
La reversibilidad de la adsorción se investigó efectuando experimentos de desorción, consistentes en realizar un experimento de adsorción y, una vez que se alcanzó el equilibrio, el carbón saturado con salicilato de sodio se removió de la solución y se colocó dentro de un volumen conocido de una solución sin salicilato de sodio y de pH conocido. Esta etapa se efectuó removiendo la canastilla de Nylon conteniendo el carbón activado saturado y lavando la canastilla con agua destilada para eliminar la solución de salicilato atrapada o adherida a las partículas de carbón dentro de la canastilla. La etapa de lavado se realizó sumergiendo la canastilla en agua desionizada durante 10 seg. El carbón y la solución se dejaron en contacto durante 5 días, para alcanzar un nuevo equilibrio. En este periodo el pH de la solución se mantuvo constante, adicionando solución de HCl o NaOH 0.01 M. La cantidad de salicilato que permaneció adsorbido se calculó por un balance de masa.
Para evaluar el efecto de la adición de NaCl en la isoterma de adsorción se realizaron experimentos de adsorción a pH de 3, 5 y 11 agregando NaCl a la solución para obtener concentraciones de 0.01 y 0.1 M de NaCl.
Resultados y discusión
Caracterización fisicoquímica del carbón activado
Las propiedades fisicoquímicas del carbón activado se exhiben en la Tabla 1. Los valores del área específica y el diámetro promedio del poro se encuentran dentro del intervalo de valores reportados en la literatura para los carbones activados [7, 11]. Como se puede observar en la Tabla 1, el carbón activado contiene aproximadamente el doble de sitios básicos con respecto a los sitios ácidos.

Como era de esperarse, la superficie del carbón se modificó al oxidarlo con ácido nítrico. En la Tabla 1 se observa que la oxidación del carbón provocó que la concentración de los sitios ácidos aumente 5 veces y, por el contrario, la de los sitios básicos disminuye cerca de 3 veces. Resultados similares han sido reportados para otros carbones [12]. También, se observa que el área específica disminuye ligeramente con dicha modificación mientras que el diámetro promedio de los poros prácticamente se mantiene constante.
Isotermas de adsorción
Los datos experimentales de las isotermas de adsorción se ajustaron con las isotermas de Langmuir, Freundlich y Prausnitz-Radke [13] que se expresan matemáticamente como:


Las constantes de estas isotermas se evaluaron por un método de mínimos cuadrados mediante el método de optimización de Rosenbrock y quasi-Newton [14]. Los valores de las constantes de cada isoterma, así como los porcentajes de desviación promedio absoluto, se muestran en las Tablas 2 y 3. El porcentaje de desviación promedio se definió de la manera siguiente:

Donde N = número de datos experimentales
Se consideró que la isoterma que mejor ajustó a los datos es aquella que presenta el menor porcentaje de desviación promedio absoluto. Revisando los valores de los porcentajes de desviación promedio reportados en las Tablas 2 y 3, se notó que la isoterma de Prausnitz-Radke ajusta mejor los datos experimentales que las isotermas de Langmuir y Freundlich. En base a lo anterior se consideró que la isoterma de Prausnitz-Radke interpreta los datos en condiciones diversas de temperatura y pH. Esto se debe a que la isoterma de Prausnitz-Radke tiene tres parámetros de ajuste, mientras que las isotermas de Langmuir y Freundlich solamente tienen dos.
Los datos experimentales de las isotermas se muestran en la Fig. 1, en donde las líneas continuas representan a las isotermas de Prausnitz-Radke. Los datos de las isotermas que se exhiben en la Fig. 1 no siguen el comportamiento de la isoterma de Langmuir porque la masa de salicilato adsorbido no se hace asintótica a altas concentraciones, sino continúa incrementando cuando se aumenta la concentración. Por esta razón, la isoterma de Langmuir no interpreta correctamente los datos de la isoterma de adsorción.

Efecto del pH en la isoterma de adsorción
En la Fig. 1 se muestran las isotermas de adsorción a una temperatura de 298 K y para valores del pH de la solución de 2, 3, 5, 7, 9 y 11. En esta figura se observa que a medida que se aumenta el pH de la solución, de 2 a 11, la masa de salicilato adsorbido disminuye consigerablemente. En este intervalo de pH la máxima capacidad de adsorción, qm, obtenida por medio de la isoterma de Langmuir (Tabla 2), disminuye un poco más de seis veces. Esto indica que la adsorción del ion salicilato es favorecida por la presencia de iones hidrógeno en la solución. Un comportamiento similar ha sido reportado para la adsorción de ácidos carboxílicos aromáticos sobre carbón activado [15]. Es importante mencionar que se hicieron experimentos a pH = 1, pero no se reportaron debido a que se formó un precipitado blanco que probablemente sea ácido salicílico.
Esta bien documentado que el ácido salicílico (H2Sa) es un ácido débil con pK1 = 2.97 y pK2 = 13.40 [16]. Las reacciones de disociación son las siguientes:

Usando estos valores se preparó el diagrama de especiación que se muestra en la Fig. 2. En este diagrama se observa que a pH de 2 o menor, la especie predominante es el ácido salicílico sin disociar (H2Sa); a pH = 3, valor muy cercano a pK1 = 2.97, se encuentran presentes las especies H2Sa y HSa-1 en una relación cercana de 1 / 1; y a pH entre 5 y 11, la especie predominante es HSa-1. Con base en que el salicilato se adsorbe sobre el carbón activado en el intervalo de pH entre 2 y 11, entonces el salicilato se adsorbe como ácido salicílico sin disociar y también como anión HSa-1.

La masa de salicilato adsorbido a pH de 2 y 3 es mucho mayor que a pH de 9 y 11. Con base en el diagrama de especiación, se puede concluir que la especie H2Sa se adsorbe mucho más que la especie HSa-1. A pH = 2 la especie H2Sa representa 90.3 % molar del salicilato total presente en la solución, mientras que a pH = 3 la especie de H2Sa es 48.3 %. Suponiendo que en este intervalo de valores de pH el salicilato se adsorbe únicamente como H2Sa, entonces la isoterma puede expresarse en términos de los moles de H2Sa adsorbido contra la concentración de H2Sa. Esta concentración se estima por medio del diagrama de especiación, la concentración total del salicilato y el pH de la solución. La isoterma del H2Sa calculada de esta forma se exhibe en la Fig. 3.

La característica más sobresaliente de la Fig. 3 es que los datos a pH = 2 y pH = 3 se pueden representar por una sola isoterma de adsorción, considerando que H2Sa es la única especie que se adsorbe. Por lo anterior, la disminución de la cantidad de salicilato adsorbido cuando el pH aumenta de 2 a 3, puede atribuirse a que la fracción molar o la concentración de la especie H2Sa disminuye al aumentar el pH de la solución.
La isoterma de adsorción del H2Sa se representa por la isoterma de Prausnitz-Radke siguiente:

Los parámetros de esta isoterma son cercanos a los valores que se habían calculado a pH = 2 (Tabla 3), sin considerar alguna especie en particualr. Esto se debe a que pH = 2, la especie H2Sa predomina, correspondiendo al 90.3 % molar de todo el salicilato presente en la solución.
Reversibilidad de la adsorción del salicilato de sodio sobre el carbón activado
La reversibilidad de la adsorción se investigó realizando experimentos de adsorción-desorción. En la etapa de adsorción, el salicilato se adsorbe sobre el carbón activado al introducir el carbón en una solución de salicilato de sodio, mientras que en la de desorción el salicilato se desorbe al colocar el carbón saturado con salicilato en una solución que no contiene salicilato. El proceso de adsorción-desorción se ilustra en la Fig. 4.

Durante la adsorción, la concentración del salicilato (C) disminuye de Cohasta Ce, mientras que la masa de salicilato adsorbido (q) aumenta de 0 a qe. Realizando un balance del salicilato, se obtiene la ecuación siguiente:

Esta es la ecuación de una línea recta que expresa la relación entre q y C durante la adsorción. Una vez que se alcanza el equilibrio, entonces q = qe y C = Ce y este punto se encuentra sobre la isoterma de adsorción. Esta etapa de adsorción se ilustra en la Fig. 4.
En la desorción, la concentración del salicilato aumenta de 0 a Ce', mientras que la masa de salicilato adsorbido se reduce de qo a qe'. El termino qo corresponde a la masa de salicilato que se adsorbió en la etapa de adsorción (qo= qe). En este caso, la relación entre q y C se representa por la ecuación lineal siguiente:

En el equilibrio q = qe' y C = Ce'. La etapa de desorción se exhibe en la Fig. 4, que muestra un dato de adsorción y su correspondiente para la desorción, la adsorción se designó con a y la desorción con d. La desorción y adsorción se realizaron usando la misma relación V / m y por lo tanto las líneas rectas que las representan son paralelas (Fig. 4).
Si la adsorción es reversible entonces el nuevo equilibrio se encuentra sobre la isoterma de adsorción y éste se representa en la Fig. 4 como qe' = qTeo y Ce' = C'Teo. Los valores de qTeo y C'Teo se pueden calcular resolviendo las ecuaciones siguientes:

En caso de que la adsorción no sea reversible, entonces qe' es mayor que qTeo y Ce' es menor que C'Teo.
Los datos e isotermas que se obtuvieron en la adsorción y la desorción del salicilato se graficaron en las Figs. 5 y 6 para valores del pH de 3 y 11, respectivamente. En la Fig. 3 se observa que los datos de desorción no se encuentran sobre la isoterma de adsorción, esto indica que la adsorción no es reversible a pH = 3. Por otro lado, los resultados a pH = 11 graficados en la Fig. 6 revelan que la adsorción es reversible para Ce' ≥ 0.011 mmol / L o qe' > 0.091 mmol / g porque los datos de desorción siguen el mismo comportamiento que la isoterma de adsorción; pero no lo es para Ce' ≥ 0.011 mmol / L o qe' > 0.091 mmol / g porque los datos de desorción no corresponden a la isoterma de adsorción.

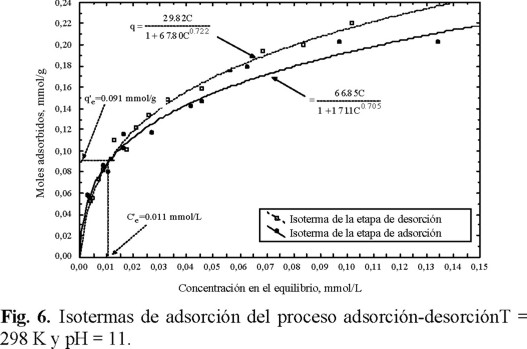
El porcentaje de desorción del salicilato adsorbido se estimó por medio de la ecuación siguiente:

El numerador representa la masa de salicilato que se desorbió mientras que el denominador es la masa de salicilato que se desorbería si la adsorción fuera reversible. Es importante aclarar que los porcentajes de desorción dependen de la relación V / m.
El porcentaje de desorción se puede considerar como un criterio de reversibilidad. La adsorción es reversible cuando el porcentaje de desorción es igual a 100 % pero no lo es cuando es menor de 100 %. A pH = 3 los porcentajes de desorción varían de 18 % a 84 %, entonces a este pH la adsorción no es reversible. A pH = 11 el porcentaje de desorción es igual a 100 %, cuando la masa de salicilato adsorbido al final del proceso de desorción, qe', es menor de 0.091 mmol / g; y está en el intervalo de 75 a 100 % para qe' mayor de 0.091 mmol / g. En otras palabras, la adsorción es reversible cuando qe' es igual a qTeo, para pH = 11; esta condición se alcanza cuando la isoterma de adsorción y la de desorción se empalman. Una posible explicación de estos resultados es que la adsorción puede ocurrir por dos mecanismos, uno que es reversible (adsorción física) y otro que no lo es (adsorción química). La adsorción física ocurre exclusivamente para q ≤ 0.091 mmol / g, mientras que la adsorción física y química se llevan a cabo para q > 0.091 mmol / g. Esto implicaría que la adsorción ocurre en dos tipos de sitios activos diferentes.
Efecto de la temperatura sobre la isoterma de adsorción
El efecto de la temperatura sobre la isoterma de adsorción se estudió determinando la isotermas a las temperaturas de 288, 298 y 313 K y pH de 3 y 9. Las isotermas a pH = 9 se exhiben en la Fig. 7, donde se observa que a medida que se aumenta la temperatura, la isoterma de adsorción diminuye. Al incrementar la temperatura de 288 K a 298 K se provoca una ligera disminución de la isoterma, pero el aumento de 298 K a 313 K provoca una disminución considerable. En promedio, la capacidad de adsorción se reduce 5.3 % y 19.1 % cuando la temperatura se aumenta de 288 a 298 K y de 298 a 313 K, respectivamente. Estos valores se estimaron comparando las masas máximas de salicilato adsorbido, qm (Tabla 2). No se muestran los resultados del efecto de la temperatura a pH = 3 porque se observó un comportamiento muy similar que a pH = 9.

El comportamiento anterior puede explicarse considerando que al aumentar la temperatura las moléculas de salicilato en solución poseen más energía, por lo que requieren más energía para adsorberse. Por otro lado, la energía vibracional de las moléculas adsorbidas crece cuando se eleva la temperatura, y de esta manera, más moléculas adsorbidas poseen la suficiente energía para desorberse [7]. Por lo anterior, a mayor temperatura se adsorbe un menor número de moléculas de salicilato.
Efecto de la oxidación del carbón en la isoterma de adsorción
Este efecto se investigó determinando la isoterma de adsorción sobre el carbón sin oxidar y el carbón oxidado con HNO3. Los resultados se exhiben en la Fig. 8 para pH = 3 y pH = 11. Para estos valores del pH, la oxidación del carbón provoca una disminución de la capacidad de adsorción, la cual es más pronunciada a pH = 11 que a pH = 3, esto se observa al comparar los valores de qm para el carbón sin oxidar y para el oxidado (Tabla 2). Se puede puntualizar que a pH = 3 la masa máxima de salicilato adsorbido se reduce 18.4 % y a pH = 11, 33.75 %. Por otro lado, la oxidación del carbón provoca que los sitios ácidos aumenten cinco veces, mientras que los sitios básicos disminuyen un poco más de tres veces. Resultados similares se han reportado en otros trabajos sobre la oxidación del carbón activado con HNO3 [12].

La disminución de la capacidad de adsorción con la oxidación del carbón se puede explicar considerando que la adsorción del salicilato de sodio ocurre principalmente en los sitios básicos del carbón, entonces la disminución de la capacidad de adsorción se puede atribuir a la reducción del número total de sitios básicos causada por la oxidación. Sin embargo, el porcentaje de reducción en la capacidad de adsorción no es proporcional al porcentaje de disminución de los sitios básicos. El carbón es un adsorbente heterogéneo y puede tener varios tipos distintos de sitios básicos. La concentración de los sitios básicos que se reporta en la Tabla 1 corresponde al total. El salicilato se puede estar adsorbiendo en un cierto tipo de sitio básico y quizás por esta razón la reducción de la capacidad de adsorción no es proporcional a la disminución de la concentración total de sitios básicos.
Efecto de la adición de NaCl en la isoterma de adsorción
En la Fig. 9 se muestra el efecto de la adición de NaCl sobre la isoterma de adsorción y se nota que la adición de NaCl no afecta la capacidad de adsorción a pH = 3, esto puede atribuirse a que el salicilato se adsorbe como ácido salicílico (H2Sa) sin disociar, por lo que la adsorción no se debe a interacciones electrostáticas que pudieran ser afectadas por la presencia de los iones Na+ y Cl-. Sin embargo, la adición de NaCl afecta considerablemente la adsorción del salicilato a pH = 11, provocando un aumento de la capacidad de adsorción. En la Fig. 9 se nota que aumentando la concentración de NaCl de 0.01 a 0.1 M, aumenta la cantidad de salicilato adsorbido.

Resultados similares se reportan en el caso de la adsorción de ácido benzoico sobre carbón activado, cuando se adiciona NaCl [15]. Este efecto puede explicarse suponiendo que el salicilato se esta adsorbiendo como anión HSa-, pero no por intercambio iónico. En estas condiciones, el anión salicilato adsorbido hace que la superficie del carbón esté cargada negativamente, y por esta razón los aniones salicilato que están en solución son repelidos de la superficie y no se adsorben. Al agregar cationes Na+ se considera que estos son atraídos por la carga negativa del anión HSa- adsorbido, reduciendo la repulsión a los aniones salicilato y de esta manera se aumenta la capacidad de adsorción. La anterior explicación fue sugerida por Cooney y Wijaya [15].
Carga superficial del carbón
La distribución de la carga superficial del carbón con respecto al pH de la solución se evaluó mediante un método de titulación. En la Fig. 10 se exhiben los resultados del carbón sin oxidar. El punto de carga cero (PCC) del carbón es el pH al cual la carga superficial es neutra; el PCC del carbón PE sin oxidar es igual 7.13. A pH menores del PCC, la superficie está cargada positivamente y a pH mayores del PCC, está cargada negativamente. La distribución de la carga sobre el carbón oxidado también se determinó y se encontró que el PCC del carbón oxidado es de 3.05. Así, la oxidación del carbón disminuye el PCC porque se formaron más sitios ácidos sobre la superficie del carbón.

Mecanismo de adsorción
Con base en la discusión anterior, se puede suponer que la adsorción del salicilato de sodio no ocurre por medio de un mecanismo único y es función de varios tipos de interacción entre el soluto y la superficie del carbón, así como del pH de la solución.
A pH ≤ 3, la superficie está cargada positivamente, por lo que la especie que se adsorbe solo puede ser H2Sa, que es neutra. En estas condiciones, las atracciones electrostáticas parecen no influir en la adsorción. A pH entre 5 y 7 la especie que se adsorbe es H2Sa-1 y la superficie está cargada positivamente, por lo tanto la atracción electrostática entre la superficie y el anión favorece la acumulación del HSa-1 sobre la superficie del carbón. La disminución en la capacidad de adsorción al aumentar el pH se puede atribuir a que la carga también disminuye. A pH entre 7 y 11, la superficie esta cargada negativamente y la especie presente es el HSa-1, por lo tanto existe repulsión entre el anión y la superficie. La adsorción ocurre al vencer esta repulsión electrostática.
Conclusiones
La isoterma de adsorción del salicilato sobre el carbón activado PE se ajustó mucho mejor mediante la isoterma de Prausnitz-Radke. Esta es muy dependiente del pH; la isoterma disminuye drásticamente cuando el pH aumenta de 3 a 11 y la máxima adsorción se obtiene a pH = 2. La isoterma también depende de la temperatura y disminuye con la temperatura.
La oxidación del carbón activado con HNO3 aumenta la concentración de los sitios ácidos pero disminuye la concentración de los sitios básicos. La capacidad de adsorción del carbón se reduce al oxidarlo, porque parte del salicilato se adsorbe sobre los sitios básicos.
Los estudios de reversibilidad de la adsorción del salicilato demostraron que la adsorción no es reversible a pH = 3, lográndose porcentajes de desorción entre 18 y 84 %. A pH = 11 la adsorción es reversible para q menores de 0.091 mmol / g, pero no lo es para q mayores de este valor.
Para aquellos valores de pH entre 5 y 11, la adición de NaCl causa un aumento de la masa de salicilato adsorbido, porque los iones Na+ interactúan con el ion HSa- adsorbido sobre la superficie y, de esta manera, reducen la repulsión entre los ion HSa- adsorbidos y los aniones HSa- que están en solución. Sin embargo, a pH = 3, la adición de NaCl no afecta la isoterma de adsorción porque el salicilato está adsorbido como H2Sa.
La adsorción de salicilato ocurre por dos mecanismos, uno que es reversible y otro que no lo es. Además, el mecanismo que predomina depende del pH de la solución.
Referencias
1. EPA, Granular Activated Carbon Treatment, Engineering Bulletin, EPA/540/2-91/024, 1991. [ Links ]
2. Kirk, R.E.; Othmer, D.F. Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, USA, 1992. [ Links ]
3. Mahajan, O. P.; Moreno-Castilla, C.; Walker, P. L. Sep. Sci. Technol. 1980, 15, 1733-1752. [ Links ]
4. Güzel, F. Sep. Sci. Technol. 1996, 31, 283-290. [ Links ]
5. Moreno-Castilla, C.; Rivera-Utrilla, J.; López-Ramón, M. V.; Carrasco-Marín, F. Carbon. 1995, 33, 845-851. [ Links ]
6. Boehm, H.P. Carbon. 1994, 32, 759-769. [ Links ]
7. Cooney, D. O. Adsorption Design for Wastewater Treatment, Lewis Publisher, USA, 1999, 1-38. [ Links ]
8. Ovalle Turrubiartes, J. Desarrollo de un Nuevo Adsorbente a Base de Carbón Aluminizado para la Remoción de Fluoruro Presente en Soluciones Acuosas, Tesis de Maestría, UASLP, San Luis Potosí, S.L.P., México, 1996. [ Links ]
9. Bockris, J. O'M.; Otagawa, T. J. Electrochem. Soc. 1984, 131, 290-302. [ Links ]
10. Ruiz Salazar, C. V. Equilibrio y Velocidad de Adsorción de Selenio IV y Selenio VI en Solución Acuosa sobre Carbón Activado, Tesis de Maestría, UASLP, S.L.P., México, 2000. [ Links ]
11. Cheremisinoff, N. P.; Cheremisinoff, P. N. Carbon Adsorption for Pollution Control, Prentice Hall, USA, 1993, 21. [ Links ]
12. Bandosz, T. J.; Jagiello, J.; Schawarz, J. A. Anal. Chem. 1992, 64, 891-895. [ Links ]
13. Leyva Ramos, R.; Geankoplis, C. J. Can. J. Chem. Eng. 1994, 72, 262-271. [ Links ]
14. Dennis, J.E.; Schnabel, J.E. Numerical Methods for Unconstrained Optimization and Nonlinear Equations, SIAM, Philadelphia, USA, 1996, 112-113. [ Links ]
15. Cooney, D. O.; Wijaya, J., en: Fundamentals of Adsorption, Liapis, A. I., Ed., Engineering Foundation, USA, 1986, 185-194. [ Links ]
16. Lide, D. R. Handbook of Chemistry and Physics, 76th Edition, CRC Press, 1995-1996. [ Links ]














