Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 n.2 Ciudad de México Apr./Jun. 2002
Investigación
Estudio por dicroísmo circular de la desnaturalización térmica de la subtilisina BPN'. Modelo irreversible de dos estados
Salvador R. Tello-Solís * y Alfonso Arroyo-Reyna
Área de Biofisicoquímica. Departamento de Química. Universidad Autónoma Metropolitana-Iztapalapa. Apartado Postal 55-534, México 09340, D.F., Iztapalapa, México. E-mail: srts@xanum.uam.mx
Recibido el 28 de enero del 2002.
Aceptado el 3 de abril del 2002.
Resumen
Se estudió la desnaturalización térmica de la subtilisina BPN' por dicroísmo circular. Se observa que el proceso fue fuertemente dependiente de la velocidad de calentamiento, como es de esperarse para un proceso de desplegamiento que se encuentra bajo control cinético, debido a la presencia de una reacción irreversible. El proceso de desnaturalización térmica sigue un modelo simple de dos estados (N → D). Se calculó la energía de activación (E) para la reacción por diferentes métodos. El valor de E obtenido fue muy similar variando de 266 a 339 kJ mol-1.
Palabras clave: Subtilisina BPN', desnaturalización, dicroísmo circular, irreversibilidad.
Abstract
Thermal denaturation of Subtilisin BPN' was studied by circular dichroism. It was observed that the process was strongly dependent on the heating rate, as is expected for an unfolding process kinetically controlled due to presence of an irreversible reaction. Thermal unfolding process follows a simple two-state mechanism (N → D). The activation energy (E) to this reaction was calculated by different methods. The obtained values for E were rather than similar to one another, varying from 266 to 339 kJ mol-1.
Keywords: Subtilisin BPN', denaturation, circular dichroism, irreversibility.
Introducción
Hoy en día, la desnaturalización térmica de proteínas es estudiada intensamente. La investigación de los procesos de desnaturalización puede ayudar a elucidar el mecanismo del proceso contrario, esto es, el plegamiento de las proteínas. El desplegamiento térmico de muchas proteínas globulares pequeñas es altamente cooperativo y sigue un mecanismo de dos estados, bajo condiciones de equilibrio [1, 2]. La calorimetría diferencial de barrido se ha utilizado ampliamente en los últimos 25 años para el estudio de las transiciones térmicas en proteínas. Esta técnica da información sobre la energía y el mecanismo del proceso de plegamiento / desplegamiento de las proteínas [2, 3]. El análisis de los datos calorimétricos requiere que el proceso de desplegamiento sea reversible. Cuando hay irreversibilidad en el proceso de desnaturalización, esto es, cuando se está bajo control cinético, es necesario realizar un estudio calorimétrico más complejo [4-6]. Para algunas proteínas que se obtienen en bajas concentraciones, dichos estudios son prácticamente imposibles de realizar.
En este trabajo empleamos un método alternativo para el estudio de la desnaturalización térmica de una proteína, la subtilisina BPN', a pH 7.5. El método consiste en el monitoreo de la elipticidad, seguida por dicroísmo circular, en función de la velocidad de calentamiento.
Parte experimental
Todos los reactivos utilizados fueron grado analítico (Merck, Alemania).
Se utilizó rutinariamente agua desionizada en la preparación de todas las disoluciones y reguladores.
Enzima. La subtilisina BPN' se obtuvo de un extracto comercial (EC 3.4.21.62) de Sigma Chemical Co, St. Louis, Mo, E.U.A.
Purificación. Un gramo del extracto comercial de subtilisina fue disuelto en 25 mL de regulador de fosfatos 0.01 M, pH 7.5, filtrado por membrana Millipore y aplicado a una columna de filtración en gel TSK-HW 50 F (2.5 × 54 cm) (Merck, Alemania), acoplada a un sistema de colección LKB. La columna fue equilibrada con regulador de fosfatos 0.01 M, pH 7.5, se colectó con un flujo de 1 mL / min. Las fracciones con actividad proteolítica fueron unidas en una nueva fracción, concentradas y recromatografiadas en una columna de filtración en gel Biosep sec-S2000 (0.78 × 30.0 cm) (Phenomenex ) acoplada a un sistema cromatogáfico líquido de alta resolución, Varian 9000, utilizando como eluyente regulador de fosfatos 0.01 M, pH 7.5.
La purificación final se llevó a cabo por intercambio iónico en cromatografía líquida de alta resolución (HPLC). Disoluciones de un mililitro de aproximadamente 1.0 mg de proteína / mL fueron inyectadas en una columna de sulfopropilo SP-5PW (0.75 × 7.5 cm) (Bio-Rad, E.U.A.), acoplada a un cromatógrafo Varian 9000. Los componentes proteicos fueron eluídos de la columna con una velocidad de flujo de 0.7 mL / min empleando un gradiente lineal de KCl (0-1M) en regulador de fosfatos 0.01 M, pH 7.5.
Electroforesis en gel de poliacrilamida. Después de la purificación, la homogeneidad de la enzima, se determinó por electroforesis en gel de poliacrilamida [7] tanto en presencia como en ausencia de dodecilsulfato de sodio (SDS), en un sistema PhastSystem de Pharmacia.
Actividad proteolítica. Durante las etapas de purificación la actividad proteolítica fue rutinariamente ensayada a pH 7.5 por una modificación del método de Anson [7], usando como sustrato hemoglobina (Sigma) al 2 % (desnaturalizada por calentamiento), en un regulador de fosfatos 0.01M, pH 7.5, a una temperatura de 30 °C.
Inhibición de la subtilisina. Para prevenir la autohidrólisis, durante los estudios de dicroísmo circular, la acción enzimática de la subtilisina fue inhibida con fluoruro de fenilmetilsulfonilo (PMSF) 10 mM [8].
Concentración de proteína. Durante las diferentes etapas de purificación, la concentración de proteína total fue determinada por el método de Lowry. En los estudios de actividad y dicroísmo circular, la cantidad de proteína fue calculada espectrofoto métricamente a 280 nm, utilizando la absorbencia específica, de 11.7 [9].
Dicroísmo circular. Los espectros de dicroísmo circular (DC) se obtuvieron en un espectropolarímetro Jasco J-715, equipado con un portacelda rectangular con controlador de temperatura tipo Peltier PTC-348WI y agitación magnética. La temperatura fue medida en el interior de la celda con la sonda externa del sistema Peltier. Los espectros en la región del UV lejano (190-240 nm), para el estudio del cambio conformacional en función de la temperatura se realizaron en una celda de recorrido óptico de 1.0 cm. La subtilisina fue disuelta en un regulador de fosfatos 0.01 M, pH 7.5 a una concentración de 20 µg / mL. Los espectros de dicroísmo circular son reportados como elipticidad por residuo medio (θ)MWR, la cual fue calculada utilizando una masa molecular de 110 por residuo.
La desnaturalización térmica se siguió por el cambio en la elipticidad a 220 nm. El cambio de temperatura en la muestra (de 25 a 70 °C), controlada con el sistema Peltier, se realizó a velocidad de calentamiento constante. Se seleccionaron velocidades de calentamiento de 0.5 a 5.0 grad / min (con una precisión de ± 0.02 grad / min). Las elipticidades observadas fueron transformadas a fracción de proteína desnaturalizada, fD:

Donde θT es la elipticidad de la muestra a la temperatura T y θN y θD son las elipticidades del estado nativo y del estado desnaturalizado, respectivamente. La reversibilidad de la transición se estudió, también, por el cambio en la elipticidad a 220 nm.
Análisis de datos
Los datos de elipticidad obtenidos a partir del estudio de la desnaturalización térmica fueron analizados asumiendo un proceso irreversible de dos estados:

Donde N es el estado nativo, D el estado desnaturalizado irreversiblemente y k la constante de velocidad de primer orden la cual obedece la ecuación de Arrhenius.
Sánchez-Ruiz et al. [4] han propuesto varios métodos para el análisis de las curvas calorimétricas basados en el mecanismo anterior. Tres de estos métodos pueden ser adaptados a los estudios por dicroísmo circular [10, 11].
El primero relaciona la temperatura media de la curva de transición (Tm) del estado nativo al estado desnaturalizado, con la velocidad de calentamiento, v:

donde A es el factor pre-exponencial de la ecuación de Arrhenius. Por lo que, a partir de un gráfico del ln v / Tm2 en función de, se obtendrá una línea recta con pendiente igual a -E / R.
El segundo método relaciona la fracción de proteína en el estado nativo, fN, (fN+ fD= 1), como una función de la temperatura según:

Por lo que un gráfico de ln (ln (1 / fN)) en función de 1/T dará una pendiente m = -E / R, a partir de la cual se podrá calcular la energía de activación del proceso, E.
El tercer método relaciona la fracción de proteína en el estado nativo, fN, la constante de velocidad de la reacción, k, en función de la temperatura y la velocidad de calentamiento v:

entonces, a partir de un gráfico del ln k en función de 1/T se obtendrá una línea recta con pendiente igual a -E / R.
Resultados y discusión
Los espectros de DC, a pH 7.5, en la región del ultravioleta lejano (190-240 nm) para la subtilisina BPN' nativa (25 °C) y la subtilisina BPN' desnaturalizada (70 °C), por efecto del aumento de la temperatura, se muestran en la Fig. 1. Los cambios observados son atribuibles a la pérdida de estructura secundaria [10-13]. Además, se observó que no existe reversibilidad en el proceso de desnaturalización térmica (Fig. 1).
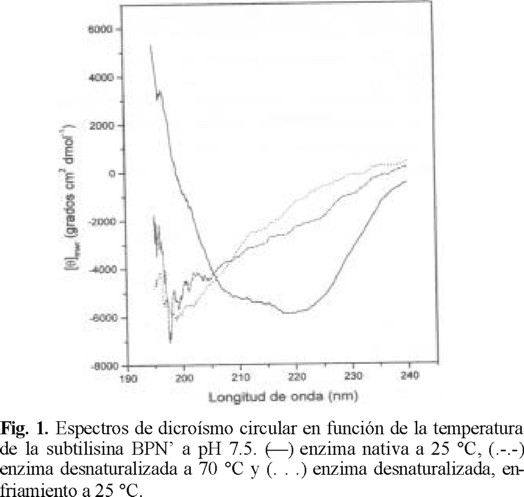
Efecto de la velocidad de calentamiento en la desnaturalización térmica de la subtilisina BPN'
La Fig. 2, muestra las curvas de transición térmica seguidas a diferentes velocidades de calentamiento, por monitoreo de la elipticidad a 220 nm. Como se observa en la Fig. 2, la transición de la desnaturalización fue fuertemente dependiente de la velocidad de calentamiento, como es de esperarse para un proceso de desplegamiento que se encuentra bajo control cinético, debido a la presencia de una reacción irreversible [10-13]. Asímismo, las muestras que fueron calentadas a temperaturas superiores a 70 °C (temperatura a la cual la transición había sido completada) no mostraron reversibilidad de la señal de DC cuando fueron enfriadas a 25 °C.

Desde el punto de vista del carácter irreversible de la desnaturalización térmica de la subtilisina BPN', se analizaron las curvas de transición en términos de un modelo irreversible simple de dos estados:

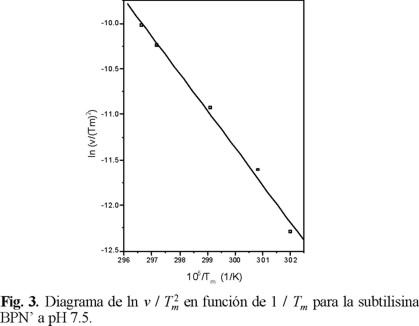
Se utilizó la ecuación 3 para el análisis de las curvas de transición. En la Fig. 3 se muestra el diagrama de ln v / Tm2 en función de 1 / Tm, de la pendiente de la línea recta resultante (coeficiente de correlación 0.99), se obtuvo un valor para la energía de activación, E = 339 ± 18 kJ / mol. El factor preexponencial de Arrhenius fue de 1.3 × 1054 min-1.
En la Fig. 4 se muestra el diagrama de ln (ln (1 / fN)) en función de 1 / T, para la velocidad de calentamiento de 2 grad / min, en donde se obtuvo una línea recta con pendiente m = -E / R, a partir de la cual se calculó el valor de la energía de activación, E. Diagramas similares fueron trazados para las demás velocidades de calentamiento, obteniéndose buenas relaciones lineales (coeficiente de correlación de 0.99). El valor promedio de la energía de activación, 285 ± 3 kJ mol-1.

En la Fig. 5, se presenta el gráfico de ln fNen función de la temperatura absoluta, para calcular los valores de la constante de velocidad, k, ecuación 5, para una velocidad de calentamiento de 5 grad / min. A partir de los diferentes valores de k calculados, se construyó el diagrama de Arrhenius correspondiente (Fig. 6) y se determinó la energía de activación del proceso de desnaturalización (tercer método). Diagramas similares fueron trazados para las demás velocidades de calentamiento, obteniéndose buenas relaciones lineales (coeficiente de correlación de 0.99). El valor promedio de la energía de activación, 266 ± 11 kJ mol-1. Por lo tanto, se observa una concordancia entre los tres métodos utilizados para calcular la energía de activación, de la desnaturalización térmica de la subtilisina BPN', a pH 7.5.


El valor promedio para la energía de activación (E = 297 kJ / mol) del desplegamiento térmico de la subtilisina BPN', determinado en este trabajo, es del mismo orden del valor promedio reportado para el desplegamiento térmico de enzimas proteolíticas de masa molecular semejante a la subtilisina BPN' (27.5 kDa), como son: actinidina (27.5 kDa, E = 217 kJ / mol) [12] y bromelaína (25.8 kDa, E = 206 kJ / mol) [13].
Conclusión
La desnaturalización térmica de la subtilisina BPN' a pH 7.5, está bajo control cinético y sigue un modelo irreversible de dos estados.
Referencias
1. Kim, P.S.; Baldwin, R.L. Annu. Rev. Biochem. 1982, 51, 459-462. [ Links ]
2. Privalov, P.L. Adv. Protein Chem. 1979, 33, 167-241. [ Links ]
3. Sturtevant, J.M. Annu. Rev. Phys. Chem. 1987, 38, 463-488. [ Links ]
4. Sánchez-Ruiz, J.M.; López-Lacomba, J.L.; Cortijo, M.; Mateo, P.L. Biochemistry 1988, 27, 1648-1652. [ Links ]
5. Guzmán-Casado, M.; Parody-Morreale, A.; Mateo, L.P.; Sánchez-Ruiz, J.M. Eur. J. Biochem. 1990, 188, 181-185. [ Links ]
6. Sánchez-Ruiz, J.M.; López-Lacomba, J.L.; Mateo, P.L.; Vilanova, M.; Serra, M.A.; Avilés, F.X.. Eur. J. Biochem. 1988, 176, 225-230. [ Links ]
7. Tello-Solís, S.R.; Romero-Rodríguez, A.; Hernández-Arana, A. Biochem. Mol. Biol. Int. 1994, 33, 759-768. [ Links ]
8. Kim, S-H.; Choi, N-S. Biosci. Biotechnol. Biochem. 2000, 64 (8), 1722-1725. [ Links ]
9. Ottesen, M.; Svendsen, I. Methods Enzymol, 1970, 19, 199-215. [ Links ]
10. Tello-Solís, S.R.; Hernández-Arana, A. Biochem. J. 1995, 311, 969-974. [ Links ]
11. Tello-Solís, S.R.; Romero-García, B. Int. J. Biol. Macrom. 2001, 28, 129-133. [ Links ]
12. Tello-Solís, S.R. Afinidad 2000, LVII No. 490, 547-461. [ Links ]
13. Arroyo-Reyna, A; Hernández-Arana, A. BBA 1995, 1248, 123-128. [ Links ]














