Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 no.2 Ciudad de México abr./jun. 2002
Investigación
Determinación del estado de equilibrio de un sistema hídrico
Icela D. Barceló,1* Ignacio Allende,2 Hugo E. Solís,1 Anne-Laure Bussy,1 y Carmen González1
1 Universidad Autónoma Metropolitana-Azcapotzalco, Av. San Pablo No. 180, Col. Reynosa Tamaulipas, Azcapotzalco, México 02200, D.F. Tel: 55 5318-9360; Fax: 55 5318-9360. E-mail: ibarcelo@att.net.mx
2 Instituto Superior Politécnico José Antonio Echeverría, ISPJAE, La Habana, Cuba.
Recibido el 27 de noviembre del 2001.
Aceptado el 12 de marzo del 2002.
Resumen
Se comparan dos métodos analíticos para la determinación del comportamiento químico de un sistema hídrico natural con poca movilidad hidrodinámica. En el primero, se consideran únicamente los iones calcio y al sistema carbonato; en el segundo se propone la importancia de considerar la fuerza iónica y se comprueba a través de un conjunto de ecuaciones, la relación del Ca2 +, H2CO3, HCO3- y CO32-, con otros iones denominados iones ajenos presentes en un sistema hídrico, con ello además, se demuestra la influencia de los iones disueltos a los índices de saturación lo que hace deficiente el empleo del primer método.
Palabras clave: Agua, sistema carbonato, contaminantes, curva de estabilización, precipitación, iones ajenos.
Abstract
Two analytical methods are compared in order to determine the chemical behaviour of a natural water system, with low hydrodynamic mobility. The first method considers only the carbonate species and Ca2+ whereas the ionic force is taken into account in the second. A series of equations is presented, in order to establish the relations of Ca2+, H2CO3, HCO3- y CO32- with other significant ions that are present in the reservoir, called foreign ions. It is demonstrated that foreign ions modify Saturation Indexes, discrediting the first method.
Keywords: Water, carbonate species, contaminants, stability curve, precipitation, foreign ion.
Introducción
El CO2 es un ácido débil de gran importancia en las aguas naturales, que proviene tanto del CO2 atmosférico, como de la degradación microbiana de la materia orgánica y de los procesos fotosintéticos. La presencia de minerales carbonatados en los sedimentos en conjunto con el CO2, generan un efecto de amortiguación sobre el pH del agua, principalmente a través de los dos siguientes equilibrios [1, 2]:
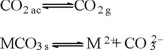
El comportamiento de los contaminantes químicos en las aguas naturales y residuales, es función de las propiedades fisicoquímicas que predominan en éstas. La presencia del CO2 disuelto y de sus productos de ionización HCO3- y CO32- en los cuerpos hídricos, influye en los equilibrios de precipitación y disolución de compuestos inorgánicos [3]. La concentración de este CO2 se puede relacionar con la presencia de bicarbonatos; para ello, es conveniente tomar en cuenta la cantidad de CO2 necesaria para mantener en disolución el HCO3- que se encuentra en el agua; este CO2 se define como CO2 de equilibrio ([CO2]eq, [1]). Sin embargo, en un sistema natural, por los procesos de producción citados anteriormente, puede existir CO2 disuelto en mayor o menor concentración respecto a [CO2]eq. Si se tiene [CO2]ac > [CO2]eq, el excedente de CO2 podrá reaccionar con los carbonatos presentes para formar más bicarbonatos, según el siguiente equilibrio:

A este CO2, se le denominará "potencialmente agresivo", y el agua correspondiente será "agresiva", favoreciendo las disoluciones, es decir, manteniendo en solución a los contaminantes [3-5]. Por lo contrario, si [CO2]ac < [CO2]eq, el equilibrio se desplazará hacia la izquierda, favoreciendo la precipitación de carbonatos con los cationes presentes; en este caso, el agua será de naturaleza "incrustante" [3-5].
Originalmente, los criterios de pH (pHs) e índice de saturación (Is) de Langelier, este último también conocido como índice de Langelier [4, 6, 7], se utilizaron para el control en el tratamiento de las aguas naturales que se empleaban en servicio doméstico (potable) y en la industria [8], mediante su caracterización en incrustantes o agresivas en función de los iones Ca2+, Mg2+ y del sistema carbonato [8-11]. Otros investigadores [9] modificaron este índice con el objeto de considerar interferencias debidas a sulfatos o iones alcalinos, por ejemplo, en el tratamiento de aguas residuales de origen minero. Sin embargo, estas modificaciones se establecieron en forma empírica.
Las descargas industriales y agrícolas han generado una contaminación de los cuerpos acuáticos, en particular al incorporar compuestos inorgánicos, como los metales pesados, derivados fosfatados, nitrogenados, etc. Las especies iónicas provenientes de estos contaminantes influyen en la alcalinidad, la electroneutralidad, la salinidad y la fuerza iónica (entre otros). El índice de Langelier [4, 6, 7], así como pHs, son de gran utilidad, no solo para el control del tratamiento de aguas de servicio, sino en la reutilización de aguas residuales y en la caracterización de cuerpos hídricos contaminados para su saneamiento. Sin embargo, para poder usar adecuadamente pHs en aguas residuales industriales y agrícolas, es necesario modificarlo de manera que incluya de alguna forma la influencia de estos iones disueltos en concentraciones relevantes.
Se ha observado que al aplicar pHs y por lo tanto Is, sin considerar la fuerza iónica (µ), a dos aguas con la misma agresividad, éstas pueden tener distintos índices de saturación o, por el contrario, dos aguas con el mismo Is pueden presentar agresividades diferentes [4, 8], lo que hace a este índice semicuantitativo. Barceló [3] y Allende [4] han encontrado que un mayor valor de Is (sin corrección por fuerza iónica), no coincide necesariamente con una mayor agresividad, sino que sólo es útil para definir cualitativamente si el agua es agresiva o incrustante. También, permite calcular el pH que tendrá el agua agresiva al estabilizarse si el exceso de CO2 se elimina mediante una aeración (inyección de aire), o para el control durante el proceso de desacidificación del agua; pero únicamente en el caso de un tratamiento del agua en una planta tratadora. En un cuerpo hídrico, río o presa, el interés será más bien el estudio de la evolución de la calidad del agua y de los equilibrios químicos en el tiempo y/o en el espacio. Para ello, es necesario la obtención de un índice más cuantitativo, donde se consideren formalmente las concentraciones del máximo número de iones disueltos presentes, así como la fuerza iónica, ya que esta influye en los equilibrios químicos. Relacionar los cocientes de las concentraciones de los iones componentes de cierta especie química para obtener una relación de equilibrio, no sería confiable por su susceptibilidad ante cualquier cambio del medio, como la influencia de otros iones presentes que afectarían los equilibrios químicos; es importante considerar las actividades en lugar de las concentraciones [12] para garantizar realmente una constante de equilibrio, principalmente cuando se conoce la existencia de una multiplicidad de iones en el sistema acuoso. Tener en cuenta lo anterior y considerarlo en el cálculo del índice de Langelier, permite estudios más finos del comportamiento químico de los contaminantes inorgánicos en un cuerpo hídrico y su influencia en la naturaleza y calidad del agua.
En este trabajo, se presentan dos metodologías para caracterizar las aguas de un sistema hídrico contaminado y de poca movilidad hidrológica; la primera considera únicamente la influencia del calcio y del sistema carbonato, mientras que la segunda toma en cuenta la fuerza iónica causada por otros iones de importancia presentes en el medio, empleando los índices de Langelier [3-5, 7, 9, 13]. Esta última propuesta se presenta mediante una serie de ecuaciones que permiten llegar a una determinación cuantitativa de la naturaleza del agua, a través de una modificación a pHs, y por tanto a Is de Langelier, a partir de las concentraciones de cationes y aniones de influencia, presentes en el medio, diferentes del calcio y del sistema carbonato, aunque indirectamente estén relacionados. Se demuestra que al combinar el conjunto de concentraciones predominantes y la fuerza iónica resultante de estos iones, modifica pHs cambiando la naturaleza del agua en función de su clasificación en agresiva o incrustante.
El sistema hídrico seleccionado para el estudio, fue la presa José Antonio Alzate, embalse situado en el curso del río Lerma en el Estado de México, unos 30 kilómetros aguas abajo del puente de la carretera Toluca-México. Se construyó principalmente para el control de inundaciones y para irrigación [14]. La industrialización en el corredor Toluca-Lerma, ha generado desechos industriales y el desarrollo de la ciudad de Toluca y de poblados aledaños rurales ha producido también desechos domésticos y agrícolas [15, 16]. Actualmente la presa está altamente contaminada por las descargas de aguas residuales industriales, agrícolas y municipales [3, 17-20]. Para ilustrar la metodología, se seleccionó una temporada, la posterior al periodo de lluvias, en el mes de noviembre, cuando el embalse está lleno [17].
Desarrollo de las ecuaciones
Ecuaciones matemáticas para la construcción de las curvas de equilibrio considerando dominante al sistema carbonato y al calcio. Para calcular [CO2]eq, es necesario tomar en cuenta el pH del agua y las concentraciones de HCO3- y CO32-. Mediante los valores de las constantes del sistema carbonato (ecuaciones 1 y 2), se construyó el diagrama de predominio de las tres especies CO2, HCO3- y CO32- en función del pH (Fig. 1), para una concentración total de 5.13 ± 0.86 mmol / L; este valor representa el promedio medido en la presa J.A. Alzate (36 medidas [3]).


Un cuerpo hídrico superficial como esta presa, al ser un sistema abierto, la concentración total de las especies carbonato no es constante (por el flujo atmosférico, catabólico y fotosintético), como sería el caso cuando se maneja un sistema cerrado [10]. Por está razón, es más conveniente el empleo de la concentración de Ca2+ (mediante la electroneutralidad), en lugar del HCO3- en los cálculos.
A continuación se desarrollan las ecuaciones que permiten construir la curva de estabilización del agua respecto al CO2 de equilibrio.
Se consideran las siguientes limitaciones:
1. Se estima que las actividades y las concentraciones son equivalentes (factores de actividad f ≈ 1).
2. La fuerza iónica y la temperatura del agua se consideran constantes (respectivamente 0.013 ± 0.005 mol / L y 16 ± 3 °C [3]).
3. Se desprecian las concentraciones del H+ y del OH- por ser muy bajas frente a otras especies (los pH del agua del embalse se encuentran entre 6 y 7.8 [3]).
4. A estos valores de pH, el ion CO32- no influye fuertemente (Fig. 1).
5. Se consideran el Ca2+ y el HCO3- (Fig. 1), como los principales responsables de la salinidad del agua.
En consecuencia, la electroneutralidad del sistema acuoso se resume a [4]:

Al combinar los equilibrios ácido-base (ecuaciones 1 y 2) y el de disolución-precipitación (ecuación 4), se tiene la ecuación 5.
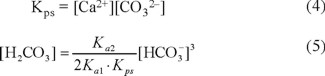
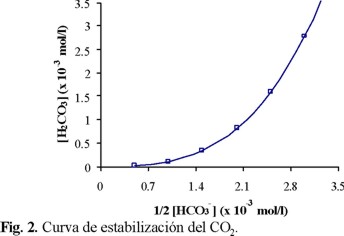
La ecuación es una parábola cúbica Y = AX3. Si se considera la ordenada Y = [H2CO3] y la abscisa X = 1/2[HCO3-] (= [Ca2+]), se obtiene la curva que se representa en la Fig. 2, que se denominará "curva de estabilidad del agua respecto al CO2 de equilibrio". Esta se considera como referencia comparativa del desplazamiento del Ca2+ en disolución o precipitable, en función del CO2 disuelto (H2CO3).
Al despejar [H2CO3] de la ecuación 1, considerando [H+] constante, se tiene la ecuación 6, que representa una recta que pasa por el origen. Por tanto, las curvas para diferentes valores de pH se representan por líneas rectas que pasan por el origen (Fig. 3), y se observa que para mayores valores de pH, la pendiente de la recta será menor.
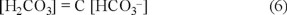

Según Morel y Hering [21], la velocidad de difusión del CO2(g) en el agua es más rápida que la cinética de formación del HCO3-. En consecuencia, si el agua está en contacto con el aire, se puede considerar constante [HCO3-], mientras que [H2CO3] (=[CO2]ac) será variable, debido al aporte atmosférico. Así X = constante y Y = variable, esto correspondería a la recta paralela al eje [H2CO3] de la Fig. 4.
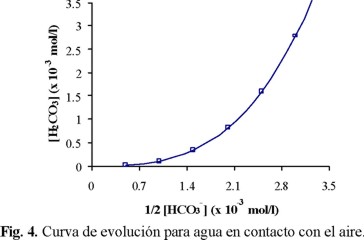
Si el agua está en contacto con el CaCO3, como sucede con el agua del fondo del embalse, se tiene el siguiente equilibrio dinámico:
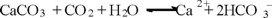
Lo cual indica que un mol de H2CO3 permite la formación de dos moles de HCO3-, o su equivalencia en iones Ca2+ (un mol). Si se considera el agua de fondo como un sistema cerrado, se tiene la ecuación 7, representada en la Fig. 5.

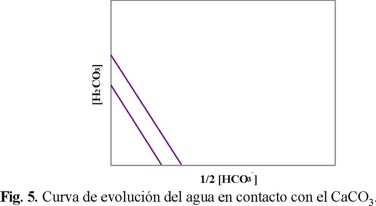
En la ecuación 5, se considera la relación (Ka2 / Ka1.Kps) = constante, sin tomar en cuenta otros iones diferentes al calcio y al sistema carbonato (limitación 5), esto conduce a que la curva de estabilidad sea igual para todas las aguas [4]. Esta simplificación se aleja mucho de la realidad, en particular en aguas contaminadas por cationes y aniones inorgánicos, donde es importante considerar la influencia de estos iones ("iones ajenos") en el agua, para mantener tanto la electroneutralidad y la fuerza iónica del medio, como los diferentes equilibrios químicos que puedan presentarse.
Cálculo del pH de saturación considerando la fuerza iónica
Por definición, la alcalinidad del medio es [10]:

y según Langelier [6]:

Cuando sea necesario tener en cuenta todos los iones, hay que considerar el efecto interiónico [8]. Este efecto traduce las fuerzas de repulsión y atracción existentes entre los iones. La magnitud del efecto interiónico es función de la fuerza iónica µ [22, 23], por lo que conviene tomar en cuenta la corrección de las concentraciones por el factor de actividad f, para obtener las actividades [22-24]. La fuerza iónica del embalse no fue mayor de 0.1 mol / L en los muestreos y la temperatura se mantuvo en un promedio de 16 ± 3 °C [3]. Al considerar estos datos, se seleccionó la ecuación de Debye-Hückel extendida para el cálculo del factor de actividad [24]:
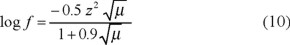
donde: f = factor de actividad
z = carga del ion cuyo coeficiente de actividad se determina
µ = fuerza iónica del disolvente
Para simplificar la ecuación 10, se consideró:


Las ecuaciones 1, 2, 4, 5 y 9 se corrigieron por los factores de actividad. Al emplear la ecuación 12, todos los aniones y cationes monovalentes tendrán el mismo factor de actividad f1, al igual que los aniones y cationes divalentes tendrán a f2, etc. En particular, las ecuaciones 2 y 4 se transforman:

Si se despeja [CO32-] de la ecuación 13 y [OH-] de la ecuación 15, y se sustituyen en la ecuación 8, se obtiene la ecuación 16.
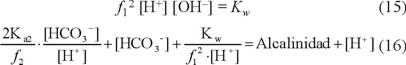
Al dividir la ecuación 14 entre la ecuación 13, al despejar [HCO3-] y al sustituir en la ecuación 16, se obtiene:

Si se designa [H+] = [H+]s; (concentración de H+ de saturación), la ecuación se representa como:

al despejar [H+]s:

ado que el pH promedio en el agua de la presa no es superior a 8 ni inferior a 5, se pueden establecer las siguientes consideraciones:
1. [H+]sy Kw/ [H+]sson muy pequeños con relación a la alcalinidad.
2. 2Ka2 / [H+]ses muy pequeño respecto a la unidad.
Lo que simplifica la ecuación 19 en:
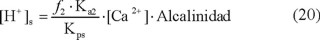
Al aplicar logaritmos:

Se puede introducir el pH de saturación (pHs) en la ecuación 21 mediante la ecuación 22.

Se reemplaza log f1 y log f2 por su expresión en función de ε, según la ecuación 12. Si se considera que la alcalinidad es igual al contenido de bicarbonato (Fig. 1), la ecuación 21 se escribe:

Al utilizar el índice de saturación propuesto por Langelier [4, 6, 7, 10]:

con pHreal = pH medido in situ,
se considera que si Is< 0, el agua es "agresiva" y si Is> 0, el agua es "incrustante".
Mediante el criterio de Langelier, se pueden relacionar los conceptos de corrosión e incrustación con la influencia principal del sistema carbonato y de los cationes Ca2+ y Mg2+, en función del concepto de pH de saturación de cualquier agua [4, 6, 7, 10]. Si el pH real del agua está por debajo de pHs, el índice de saturación será positivo, entonces el equilibrio de la reacción:

se desplazará hacia la izquierda, precipitando al CaCO3, máxime si el agua no está saturada de CO2, mientras que cuando existe un exceso de CO2, la reacción se desplazará hacia la formación de HCO3-, y permaneciendo más Ca2+ en disolución.
Cálculo del pH de saturación considerando iones diferentes de Ca2+ y de HCO3-
Como se indicó antes, el índice de Langelier que se ha presentado hasta el momento, incluye a la alcalinidad en función del sistema carbonato y de la concentración de Ca2+. Para estudios de caracterización o de comportamiento químico en sistemas acuáticos contaminados (ríos, costas, etc.), es importante relacionar el índice de saturación con la fuerza iónica y el mayor número de iones disueltos medibles. A continuación, se presentan las ecuaciones conducentes a este nuevo contexto, donde el índice de saturación de Langelier se expresa en función de las concentraciones de los iones diferentes a CO32-, HCO3- y Ca2+ ("iones ajenos").
Para el cálculo del pH de saturación en el que se consideran los iones ajenos, se parte de una ecuación de electroneutralidad más completa que la ecuación 3, como sigue:
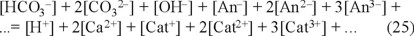
donde An3- = aniones trivalentes
An2- = aniones divalentes diferentes a CO32-
An- = aniones monovalentes diferentes a HCO 3- y OH-
Cat3+ = cationes trivalentes
Cat2+ = cationes divalentes diferentes a Ca2+
Cat+ = cationes monovalentes diferentes a H+
Además, la fuerza iónica se puede escribir como:
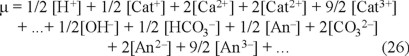
Al combinar las ecuaciones 8 y 25, se obtiene otra definición de la alcalinidad (ecuación 27), que puede considerarse como la diferencia entre la suma de las concentraciones en miliequivalentes de todos los cationes (excepto el H+) y la suma de las concentraciones en miliequivalentes de todos los aniones procedentes de ácidos minerales diferentes de HCO3-, CO32- y OH-.
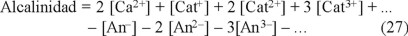
Los cationes y aniones trivalentes (o más) se pueden despreciar ya que prácticamente se encontrarían formando compuestos insolubles con más naturaleza covalente (reglas de Fajans [25], diagramas de solubilidad [26]). Por lo tanto, los cálculos siguientes se efectuarán en función de los iones mono- y divalentes.
Para simplificar las ecuaciones, se definen los siguientes parámetros en función de los iones ajenos:
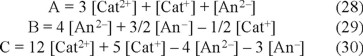
A partir de estos parámetros, se pueden determinar tres diferentes expresiones de la fuerza iónica. Al dividir la ecuación 25 entre dos y al adicionar el resultado a la ecuación 26, se establece la expresión A de la ecuación 28, con ello µ se representa según la ecuación 31. Si se sustrae la ecuación 25 de la 26, tomando en cuenta la ecuación 29, se obtiene la ecuación 32. Por último al multiplicar la ecuación 25 por dos y al adicionar el resultado a la ecuación 26, despejando C de la ecuación 30, se define la ecuación 33.

Generalmente, las aguas naturales no presentan un pH menor de 4.5 ni mayor de 9.5, por lo que se puede despreciar [H+] y [OH-]. Con estas restricciones, las ecuaciones 31 a 33 se simplifican en:

Con estas ecuaciones, se determinan las expresiones de [Ca2+] y alcalinidad en función de los iones ajenos y la fuerza iónica que se reemplazan en la ecuación 21. Al sustituir el [CO32-] en la ecuación 34 por su expresión despejada de la ecuación 14, se llega a:
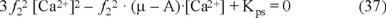
Esta ecuación de segundo grado tendrá las soluciones:
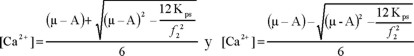
Se seleccionará la primera solución, con la que se obtendrá la más alta concentración de Ca2+; definiéndose de esta forma la ecuación 38.
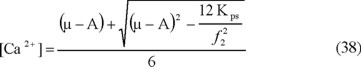
Si se multiplica por dos la ecuación 34 y si se adiciona el resultado a la ecuación 36, para luego reemplazar [Ca2+] por su expresión en la ecuación 38 y despejando [HCO3-], se llega a la expresión 39:

Al despejar [CO32-] de la ecuación 14, y reemplazar [Ca2+] por su expresión (ecuación 38), se llega a la ecuación 40. Si se multiplican numerador y denominador por el conjugado del denominador, se simplifica la ecuación 40 en la ecuación 41.
Al combinar las ecuaciones 27 y 35 con la definición modificada de la fuerza iónica, considerando las simplificaciones anteriores (ecuación 42), y reemplazando [HCO3-] y

[CO32-] por sus expresiones en las ecuaciones 39 y 41, se define nuevamente la alcalinidad en la ecuación 43.
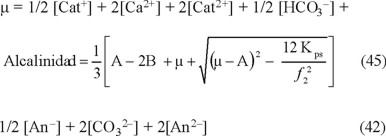
Por otro lado, si se combinan las ecuaciones 34 a 36, se tiene que C = 4A − 2B (44)
Lo que transforma la ecuación 43 en:
Al reemplazar [Ca2+] y la Alcalinidad por sus expresiones
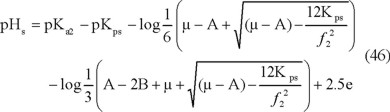
en función de los iones ajenos (ecuaciones 38 y 45) en la ecuación 21, se define un pH de saturación en función de las concentraciones de los iones presentes, menos el Ca2+, el HCO3- y CO32- (ecuación 46).
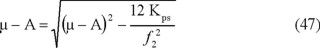
Por lo general los cuerpos acuáticos contienen un pH que no sobrepasa el valor de 8.3, así la concentración del CO32- es
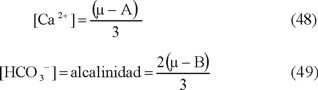
despreciable. Al considerar lo anterior, la ecuación 41 se puede simplificar en:

De la misma manera las ecuaciones 38, 39 y 45 también simplifican en:
Lo que genera la expresión simplificada de pHs en función de los iones ajenos:
Parte experimental
Medidas de campo y muestreo. La presa Alzate, por su forma y tamaño se dividió en seis sitios (Fig. 6). Durante la campaña de muestreo, se tomaron muestras a 20 cm de la superficie y en el fondo (el cual fue variable en cada sitio, Tabla 1) de las diferentes columnas de agua para cada sitio de la presa, después de medir los parámetros fisicoquímicos (temperatura, pH y conductividad).
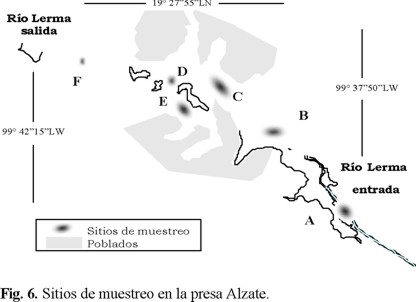
Se estableció el momento de la recolección de muestras de agua mediante un estudio preliminar de parámetros fisico-químicos, incluyendo al oxígeno disuelto [3, 11]. Se seleccionó las 13 horas del día, donde se midió la concentración de oxígeno disuelto máxima, correspondiendo a una actividad microbiológica máxima y por consecuencia relativamente reproducible en el agua. En la Tabla 1 se indican los valores del pH, temperatura y la conductividad a la hora del muestreo, así como la profundidad de cada columna de agua en los sitios de recolección.
Pretratamiento y análisis
— Las aguas colectadas se filtraron con membranas de 0.45 µm de poro (HA, Millipore) para separar los compuestos disueltos de los compuestos asociados con partículas [27]. Las muestras filtradas se refrigeraron hasta su análisis.
— Se determinó la alcalinidad por potenciometría [28]. Los resultados están reunidos en la Tabla 2.

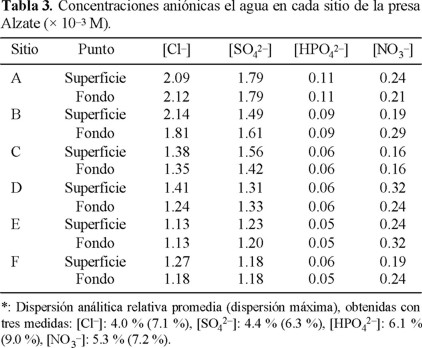
— Se determinaron las concentraciones aniónicas por espectrofotometría (NO3-, HPO42- [28]) o por volumetría (Cl-, SO42- [3, 28]). Los resultados se indican en la Tabla 3.
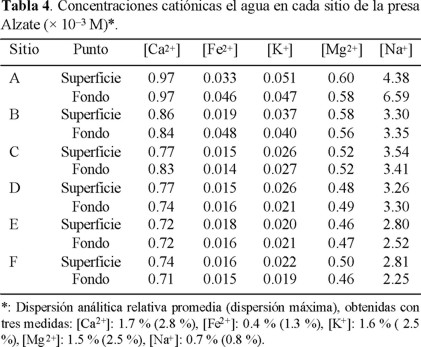
— Las muestras destinadas al análisis de cationes se conservaron a pH ≈ 2, en refrigeración, mediante la adición de HNO3 concentrado (Merck, Suprapur). Se analizaron los cationes Ca2+, Fe2+, K+, Mg2+, Mn2+ y Na+ mediante espectrofotometría de absorción atómica por flama (Varian, Spectra AA-20Plus). Los resultados están reunidos en la Tabla 4.
Resultados y discusión
A partir de la Fig. 2, se determinó la situación de cada muestra de agua estudiada en función de las concentraciones [Ca2+] y [HCO3-] medidas (Tablas 2 y 4) y de las ecuaciones 1 y 3, se consideraron las concentraciones iguales a las actividades (f = 1); el calcio y el sistema carbonato fueron las únicas especies de influencia. La Fig. 7 ilustra los resultados encontrados para el agua superficial (Fig. 7a) y en el fondo (Fig. 7b). En todos los sitios y en las dos profundidades, las aguas presentaron CO2 disuelto en exceso ([CO2]ex). El agua del sitio A resultó más alejada de la curva de estabilidad, tanto en la superficie como en el fondo. Este estado se justifica por el valor promedio del pH medido in situ, que fue el más bajo (Tabla 1), ya que es un sitio donde predomina el agua residual industrial. En los sitios E y D, el [CO2]ex fue menor que en el sitio A, y el agua de los sitios B, C y F se acercó más a la estabilidad del sistema carbonato.
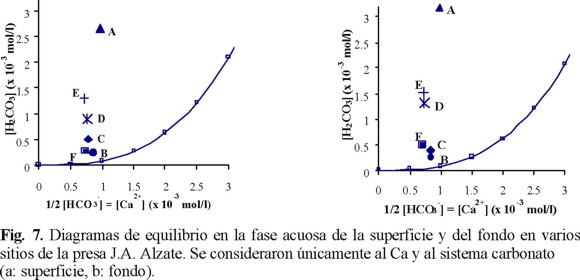
El sitio A presentó la diferencia más importante entre el agua de la superficie y la del fondo, notándose un aumento en [CO2]ex del fondo. En el sitio F, la concentración del CO2ex del agua de fondo fue casi el doble del valor calculado en la superficie, sin embargo, en ambos casos las concentraciones resultaron muy bajas respecto al sitio A, lo que le resta importancia a esta variación. Los sitios E y D mostraron simultáneamente una tendencia al aumento de la superficie al fondo, aunque en menor proporción, esto puede provenir de la degradación microbiológica del material orgánico presente en los sedimentos, principalmente como resultado de los procesos oxidativos del material orgánico biodegradable en CO2.
En una segunda etapa, se volvieron a calcular los valores de [H2CO3] para cada muestra de agua, tanto en superficie como en fondo, empleando la curva de estabilidad de la Fig. 2 y la ecuación 1, pero considerando esta vez los iones ajenos en la ecuación de electroneutralidad, y tomando en cuenta la fuerza iónica del medio (a través de los factores de actividad). Al ser diferente la fuerza iónica de cada muestra, esta última modificación, en particular, genera una curva de estabilidad diferente para cada agua colectada. En la Fig. 8, se representan los resultados obtenidos por este método. La curva representada por la línea sólida es la misma que en las Figs. 2 y 7, mientras que la línea punteada, corregida por la fuerza iónica, muestra el promedio de todas las curvas obtenidas (12 muestras). Es interesante notar que si las nuevas curvas son muy similares entre sí (lo que parece lógico para muestras pertenecientes al mismo cuerpo hídrico), el desplazamiento de la curva generada por la fuerza iónica no es despreciable y aumenta con las concentraciones. En ambas profundidades, si se emplea la primera curva como referencia, por ejemplo en el caso de los sitios D y E como muy cercanos a la estabilidad del sistema carbonato respecto al CO2eq, se origina un error grave, ya que estos se pueden considerar muy cercanos a la estabilidad del sistema carbonato; situación diferente se presenta al emplear la curva corregida, en este caso el agua de los sitios D y E presentan un exceso de CO2 relativamente importante, lo mismo sucede con los sitios B y C, que en la curva sólida están por arriba y en el otro caso se desplazan hacia abajo. Además la curva punteada es la específica para las condiciones de los parámetros medidos en el agua de la presa de este estudio
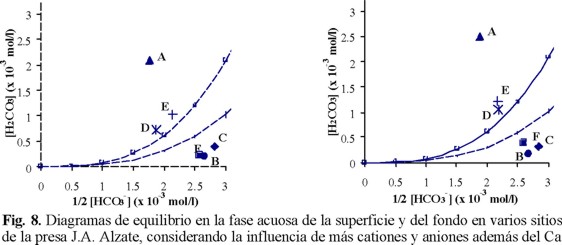
Con la comparación de las Fig. 7 y 8, se demuestra que no se puede simplificar el conjunto de compuestos inorgánicos disueltos de un agua contaminada como un sistema donde se considera únicamente al Ca2+ y al HCO3-. En particular, en el caso de la presa J.A. Alzate, no se verifica la ecuación 3, donde 2[Ca2+] = [HCO3-]. El empleo de la concentración medida para el bicarbonato, así como de las actividades, modifica poco la posición relativa de los puntos, pero provoca un traslado importante del conjunto de puntos hacia la derecha. Este fenómeno tiene una consecuencia considerable en la percepción de la calidad del agua de los sitios B, C y F, que pasan de un ligero exceso a una deficiencia en CO2, lo que podría interferir negativamente en decisiones futuras relativas a estos sitios, ya que de sitios con tendencia agresiva, donde el calcio y el carbonato estarán en estado disuelto, pasan a sitios de naturaleza incrustante, en donde existe la probabilidad de que el calcio tienda a precipitar. Por último, se nota que al considerar las concentraciones en lugar de las actividades, el cálculo sobrestima a la concentración de CO2 disuelto.
La comparación entre los resultados encontrados en la superficie (Fig. 8a) con los del fondo (Fig. 8b) muestra el mismo comportamiento de [H2CO3] de una profundidad a la otra con los dos métodos (Fig. 7 y 8), aunque en una amplitud menor, mientras que [Ca2+] (Fig. 7) tiene una evolución inversa (con excepción del sitio C) a la de 1/2[HCO3-] (Fig. 8).
Los índices de saturación de Langelier permiten también determinar la naturaleza de una agua como agresiva o incrustante, pero con más claridad, ya que se maneja un valor único en lugar de la posición de un punto en un plano (Fig. 7 y 8). Sin embargo, el empleo de logaritmos puede modificar la percepción de los resultados, aminorándolos.
Se presentan en la Fig. 9 los índices de saturación obtenidos para cada sitio, donde se consideran primero (sist. 1), únicamente a los iones Ca2+ y HCO3- donde se utilizó la ecuación 9 para los cálculos. En otro caso (sist. 2), tomando en cuenta además a los cationes Mg2+, Na+, K+, Fe2+ y los aniones Cl-, SO42-, NO3-, HPO42-, cuyas concentraciones son influyentes, a través de la fuerza iónica, para los cálculos se utilizó la ecuación 23. Como se observa en los diagramas respecto al CO2 disuelto (Fig. 7 y 8), se pueden clasificar los sitios en tres grupos: el sitio A como el más agresivo (aunque se supone que en el sist. 1, Is es un indicador cualitativo) en ambas profundidades, las aguas de los puntos B, C y F con una agresividad baja o características tendientes a una posible naturaleza incrustante y los puntos D y E con agresividad intermedia.

Sin embargo, en la caracterización de las aguas, se presentan contradicciones: la Fig. 7 y el sistema 1, se basan en el predominio de los iones Ca2+ y HCO3- y deberían presentar resultados parecidos y, por el contrario, la primera clasifica a todas las muestras como agresivas cuando el Is es positivo en varios casos; similarmente, si se compara la Fig. 8 con el sist. 2, en la que ambos toman en cuenta la fuerza iónica generada por iones ajenos, la situación se invierte, donde el Is presenta únicamente carácter agresivo aun cuando la Fig. 8 indica un déficit de CO2 disuelto en los sitios B, C y F. Esta contradicción demuestra que las dos formas de caracterizar la naturaleza del agua no reflejan los mismos fenómenos y no se pueden emplear igualmente. Las Fig. 7 y 8 ilustran únicamente el estado de estabilidad del agua respecto al CO2 de equilibrio, y no se podrá hacer el nexo con las características agresivas o incrustantes de las aguas estudiadas.
La evolución de los índices de saturación entre la superficie (Fig. 9a) y el fondo (Fig. 9b), en los dos sistemas, muestra la misma tendencia que la evolución del CO2 disuelto: el agua del fondo es más agresivo que el de la superficie en los sitios A, D, E y F, y más incrustante en los sitios B y C.
Al igual que la comparación de las Fig. 7 y 8, el estudio de los sistemas 1 y 2 considerados en la Fig. 9, demuestra la influencia notable de los iones ajenos en la caracterización de las aguas. En particular, el sist. 1 clasifica cuatro muestras como agresivas (B superficie y fondo, C fondo y F superficie), mientras que el sist. 2 presenta a todas como agresivas. De hecho, se observa que la influencia de los iones ajenos sobre los índices de saturación es un desplazamiento hacia valores más negativos o un desplazamiento de las aguas hacia características más agresivas, donde otra vez, reduce el valor de la información dada cuando se considera un sistema simplificado de manera exagerada, y hace que el Is modificado por la fuerza iónica se acerca más a la realidad, generando una información más confiable.
También se muestran en la Fig. 9 (que se representó como concentr.) los resultados de los cálculos cuando se utilizó la expresión del índice de saturación dependiente de la fuerza iónica y de las concentraciones de los iones ajenos, eliminando por completo las concentraciones de los iones Ca2+ y HCO3- (ecuación 46). Estos Is resultaron prácticamente idénticos a los del sist. 2, lo que apoya todavía más la necesidad de tomar en cuenta la fuerza iónica en el cálculo de los índices de Langelier. Además, esta serie de ecuaciones indica que con esta corrección, el índice pasa de cualitativo a cuantitativo, y se pueden aceptar las comparaciones entre diferentes sitios de misma característica, lo que aumenta el valor de este indicador. Por último, la restricción de estos cálculos a aguas naturales con pH inferior a 8.3, permite considerar al bicarbonato como la especie más importante, aunque está relacionado a la fuerza iónica y a la expresión B (ecuación 29), sigue siendo el principal responsable de la alcalinidad (ecuación 49).
La medida de todos los iones del sist. 2 puede parecer muy compleja, sin embargo, la información que refleja es más estricta y cuantitativa. No obstante, si se tiene poca información sobre la contaminación del cuerpo hídrico, se corre el riesgo de omitir algunas especies iónicas de importancia, generando errores en el cálculo del Is. En particular, en estudios sencillos, como para tratamiento de aguas provenientes de plantas industriales, en el que no se requiere de un estudio detallado sobre los equilibrios químicos, al contrario del caso de estudios más finos como el de cuerpos hídricos. Eaton et al. [28] presentan una relación empírica que permite calcular la fuerza iónica mediante la conductividad, simplificando los análisis y los cálculos:

Empleando las ecuaciones 23, 24 y 51 es posible calcular los Is midiendo solamente temperatura, conductividad, pH, [Ca2+] y alcalinidad. La diferencia observada con los Is del sist. 2 (Fig. 9, conductiv.) es poco importante (en promedio 0.04), y tiende a un desplazamiento hacia aguas más incrustantes. Todavía se necesita repetir el estudio con nuevas muestras para verificar la realidad de esta tendencia. Sin embargo, se tiene aquí un cuarto método para calcular los Is que fortalece la importancia de la influencia de los iones ajenos en este cálculo.
Eso implica que, si se quiere llevar a cabo la caracterización completa de un cuerpo hídrico, incluyendo estudios de especiación química y determinación de predominio de especies químicas, es decir establecer los equilibrios químicos del conjunto de especies químicas que coexisten bajo las condiciones de CO2 disuelto, pH, temperatura, fuerza iónica, etc., en una cierta estación del año, es necesario (y se tienen todos los datos para ello) considerar la expresión del índice de Langelier en función de los iones ajenos (ecuación 46).
En la Fig. 10, se presenta un gráfico de Is (sist. 2) vs. pHreal, donde se nota claramente la diferencia de valores de Is en cada sitio. Si bien, todos los sitios resultaron agresivos, A, D y E presentaron propiedades aún más agresivas que los otros. El menos agresivo fue el sitio B, tanto en el agua de la superficie como la del fondo. La zona A, en toda la columna de agua (superficie y fondo), según el modelo de Langelier es la más agresiva. Se puede observar que los sitios B, C y F en superficie y fondo, son los más cercanos a la estabilización (Is = 0) y relacionados con el CO2 eq, como lo indican también las concentraciones de CO2 disuelto, lo que demuestra la gran influencia de los bicarbonatos en los índices de Langelier. Existe una aparente relación lineal entre el Is y el pHreal, sin embargo, necesita verificarse con otros muestreos en diferentes estaciones del año.

Conclusiones
1. Los sistemas hídricos naturales tienden hacia una estabilización heterogénea del agua relacionada con los equilibrios químicos. En particular, la relación de estabilidad de un agua frente al equilibrio del sistema carbonato puede favorecer reacciones de precipitación cuando el sistema se encuentra debajo de la curva de estabilidad o reacciones de disolución cuando el sistema se encuentra arriba de la curva de estabilidad. Esta caracterización de un agua es importante para predecir el comportamiento del Ca2+ disuelto o su tendencia a la precipitación, siempre y cuando no existan otros cationes y otros aniones diferentes a HCO3- en aguas a pH entre 5 y 8.3; ya que para el tratamiento de aguas a pH < 5, se tendrá que considerar a H+, y para el tratamiento de aguas a pH > 8.3, se tendrá que considerar a CO32-. Aún más, para agua en tratamiento con pH > 9, se deberá considerar además a OH-.
2. Los diagramas CO2 / HCO3- permiten determinar la estabilidad de un sistema hídrico respecto al CO2 en exceso, siempre y cuando no existan iones en concentraciones importantes que influyan en los equilibrios químicos del sistema carbonato y en la concentración del Ca2+. Sin embargo, la contaminación de un agua implica en general un aumento de las concentraciones iónicas, lo que hace caduca la suposición anterior. En este caso es importante considerar la fuerza iónica.
3. Los índices de Langelier, cuando consideran la influencia de la mayoría de los iones presentes en la ecuación de electroneutralidad y en la fuerza iónica, son más precisos, además de más sencillos de interpretar. La evolución de la diferencia que existe entre el valor de los índices para un sistema sencillo y un sistema más complejo permite demostrar a su vez la influencia de la contaminación sobre estos índices.
4. La expresión de pHs en función de la fuerza iónica y de las concentraciones de los iones ajenos permite demostrar que el pHs modificado por la fuerza iónica, al contrario del pHs original de Langelier, genera un Is que se puede considerar como un indicador cuantitativo de la naturaleza agresiva o incrustante de diferentes aguas, permitiendo su comparación y su clasificación.
5. Es importante considerar las ecuaciones relacionadas con H2CO3, HCO3-,CO32-, Ca2+ y con los iones ajenos cuando se requieran estudios finos, donde se necesite conocer los diferentes equilibrios entre especies inorgánicas, en un cuerpo de agua natural que ha sido contaminado por descargas residuales de origen industrial o agrícola, donde se han incorporado contaminantes orgánicos, o cuando se necesite la determinación de las especies químicas (especiación).
6. En la presa J.A. Alzate, se observaron aguas agresivas en todos los sitios de la presa, con más agresividad en el sitio A, que es el más contaminado. Comparando lo obtenido en superficie y en fondo, las aguas superficiales de las zonas E y F (las de mayor profundidad), demostraron que el CO2 no proviene solamente de la atmósfera, sino del sedimento y en particular de los procesos biológicos que ocurren en su seno.
7. Por fin, se podría reducir la parte analítica de la determinación de los índices de Langelier, empleando una relación empírica entre la fuerza iónica y la conductividad, disminuyendo también los errores analíticos que se introducen en los cálculos, cuando se necesite desarrollar técnicas de tratamiento de aguas residuales de origen industrial, con contaminantes inorgánicos.
Agradecimientos
Este trabajo se realizó con el apoyo del Consejo Nacional de Ciencia y Tecnología a través del proyecto 34154-T.
Referencias
1. Manahan, S. E. Environmental Chemistry. 6th Edition, Lewis, Boca Raton, 1994. [ Links ]
2. Kiely, G. Ingeniería ambiental. Mc Graw-Hill, Madrid, 1999. [ Links ]
3. Barceló Quintal, I. D. Tesis doctoral, Universidad Autónoma del Estado de México, Facultad de Ingeniería, México, 2000.
4. Allende Abreu, I. V. Apuntes sobre química del agua, editado en el I.S.P.J.A.E., La Habana, Cuba, 1976, 284-289 y 344-345. [ Links ]
5. González Cortés, C. Tesis de Maestría en Química, UAM-Iztapalapa, D.F. 1997.
6. Langelier, W. F. J. Am. Wat. Works Ass. 1936, 28, 1500-1521. [ Links ]
7. Largon, T. E.; Buswell, A. M. J. Am. Wat. Works Ass. 1942, 34, 1667-1675. [ Links ]
8. Kemmer, F. N.; Mc Callion, J. Manual del agua, McGraw-Hill, México, 1989, 1, 4.16-4.17. [ Links ]
9. Miyamoto, H. K.; Silver, M. D. Mat. Eng. Chem. 1986, 9, 89-92. [ Links ]
10. Snoeyink, V. L.; Jenkins, D. Química de agua, Limusa, México, 1996. [ Links ]
11. Solís Correa, H. E.; Barceló Quintal, I. D.; González Cortés, C.; García Aragón, J. A.; Avila Pérez, P.; García Albortante, J. Memorias del XI Congreso Nacional de la Federación de Ingeniería Sanitaria y Ciencias Ambientales, A.C. (FEMISCA), Zacatecas, México, 1997, 2, 1-10. [ Links ]
12. Harris, D. C. Análisis Químico Cuantitativo. Grupo Editorial Iberoamérica, México, 1992. [ Links ]
13. Feitler, H. Mater. Protection and Perf. 1975, 11, 31. [ Links ]
14. Comisión Nacional del Agua. Presas de México. Gerencia de Información y Participación Ciudadana, Grupo Impergraf S.A. de C.V., 1993. [ Links ]
15. Secretaría de Ecología del Edo. de México. Diagnóstico preliminar ambiental de la presa José Antonio Alzate, Dirección General de estudios y Proyectos Ecológicos, Toluca, Edo. de México, 1993. [ Links ]
16. Organización Mundial de la Salud, Diagnóstico ambiental de la zona industrial del Alto Lerma por medio de la técnica de evaluación rápida de fuentes de contaminación del aire, agua y suelo. Secretaría de la Salud del Edo. de México, 1983. [ Links ]
17. Barceló Quintal, I. D.; García Aragón, J. A.; Avila Pérez, P.; Solís Correa, H. E. Memorias de la FIUAEM, 1996, 1, 154-159. [ Links ]
18. Avila Pérez, P. Tesis doctoral, Universidad Autónoma del Estado de México, Facultad de Ingeniería, México, 2001.
19. Barrios Sánchez, L. A. Tesis doctoral, Universidad Autónoma del Estado de México, Facultad de Ingeniería, México, 2001.
20. Barceló Quintal, I. D.; Solís Correa, H. E.; González Cortés, C.; Bussy Beaurain, A. L.; Avila Pérez, P.; García Aragón, J. A. Rev. Soc. Quim. Méx. 1999, 43, 43-49. [ Links ]
21. Morel, F. M. M.; Hering, J. G. Principles and applications of aquatic chemistry, Wiley and Sons, New York, 1993, 223. [ Links ]
22. Maron, S.; Prutton, C. F. Fundamentos de Fisicoquímica, Limusa, México, 1996. [ Links ]
23. Glasstone, S. Tratado de química física, Aguilar, Madrid, 1961. [ Links ]
24. Pankow, J. F. Aquatic Chemistry Concepts, Lewis, Chelsea, 1991. [ Links ]
25. Huheey, J. E. Química Inorgánica, Principios de Estructura y Reactividad, Harla, México, 1981. [ Links ]
26. Pérez, S. V. Química de las disoluciones: diagramas y cálculos gráficos, Alhambra, Madrid, 1979. [ Links ]
27. Shiller, A. M.; Taylor, H. E. Environmental Science & Technology, 1996, 30, 3397-3400. [ Links ]
28. Eaton, A. D.; Clesceri L. S.; Greenberg A. E. Standard methods for the examination of water and wastewater, American Public Health Association, Washington, 1995. [ Links ]














