Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.45 no.4 Ciudad de México oct./dic. 2001
Investigación
Síntesis y estudio estructural por RMN de 1H y 13C de la N-[4-[2-(2-oxo-2H-1-benzopiranil-3-carboxamidil)etil]bencensulfonil]-N'-ciclohexilurea y de la N-[4-[2-(4-nitrobenzamidil)etil]-bencensulfonil]-N'-ciclohexilurea
Miguel A. Espinosa,1 Joaquín Tamariz,2 Itzia I. Padilla-Martínez1 y Francisco J. Martínez-Martínez1*
1 Departamento de Química, Unidad Profesional Interdisciplinaria de Biotecnología del IPN, Av. Acueducto s/n Barrio la Laguna Ticomán, México 07340, D. F. Tel: 57296000 ext. 56324; Fax: 5729-6000 ext. 56325. E-mail: fjmartin@acei.upibi.ipn.mx
2 Departamento de Química Orgánica, Escuela Nacional de Ciencias Biológicas del IPN, Prol. de Carpio y Plan de Ayala, Col. Casco de Santo Tomás, México 11340, D.F.
Recibido el 30 de noviembre del 2001.
Aceptado el 27 de diciembre del 2001.
Dedicado al Profesor Fernando Walls Armijo en su 70 aniversario.
Resumen
En este trabajo se describe la síntesis y el estudio estructural en solución, de las sulfonilureas N-[4-[2-(2-oxo-2H-1-benzopiranil-3-carboxamidil)etil]bencensulfonil]-N'-ciclohexilurea (5a) y N-[4-[2-(4-nitrobenzamidil)etil]bencensulfonil]-N'-ciclohexilurea (5b). Se realizó la asignación completa de las señales de RMN de 1H y 13C de los intermediarios 1-4. El compuesto 5a es un compuesto nuevo con actividad farmacológica potencial.
Palabras clave: Sulfonilurea, estudio por RMN de 1H y 13C.
Abstract
This contribution describes the synthesis and structural study in solution of the new sulfonylurea agents N-[4-[2-(2-oxo-2H-1-benzopyran-3-carboxamide)ethyl]-benzenesulfonyl]-N'-cyclohexylurea (5a) and N-[4-[2-(4-nitrobenzamide)ethyl]benzenesulfonyl]-N'-cyclohexylurea (5b). Full assignment of 1H and 13C NMR spectra in solution of the intermediates 1-4 was accomplished. The new compound 5a constitutes a member of an important class of sulfonylurea drug with potential pharmacological activity.
Keywords: Sulfonylurea drug, 13C and 1H NMR study.
Introducción
La diabetes mellitus es un trastorno crónico, congénito o adquirido del metabolismo de los carbohidratos, que se caracteriza por una insuficiencia del organismo para aprovechar los azúcares debido a la ausencia o disminución de insulina en el páncreas [1].
Las sulfonilureas, con estructura R'-C6H4-SO2NHCONH-R constituyen los fármacos orales más empleados en el tratamiento de este padecimiento y son en realidad sulfonamidas modificadas. El tratamiento de la diabetes mellitus con sulfonilureas facilita la secreción [2] de insulina produciendo hipoglucemia. Su mecanismo de acción se encuentra a nivel de las células β, actuando como bloqueadores de los canales de K+ sensibles al ATP [3].
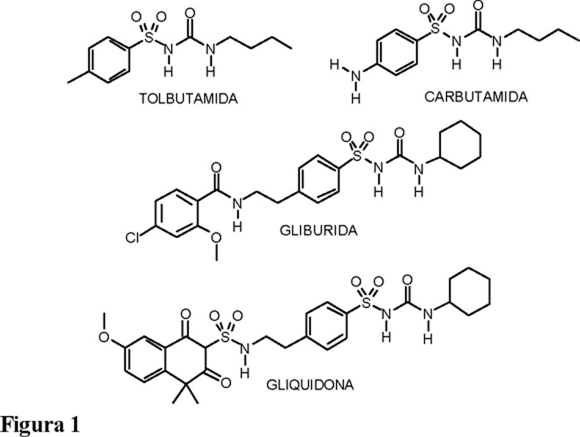
Desde los años cuarenta, se han preparado una gran variedad de estos compuestos modificando los sustituyentes R y R', entre los que destacan: la carbutamida, tolbutamida, y más recientemente la gliburida y la gliquidona (Fig. 1). Estas últimas pertenecen a la tercera generación de hipoglucemiantes, cuya actividad es cien veces más potente que la tolbutamida, perteneciente a la primera generación. La introducción de pequeños cambios estructurales genera una gran modificación de la actividad, tal es el caso de las sulfoniltioureas, a las cuales se les ha establecido actividad como bloqueadores cardioselectivos de los canales de K+ sensibles al ATP [4].
Los métodos de síntesis para estos fármacos son escasos en la literatura y se encuentran generalmente protegidos por patentes [5]. Esto se traduce en una carencia de información relacionada con sus características espectroscópicas, muy necesarias para su detección y análisis. Al respecto y con fines clínicos, se ha reportado la síntesis de un metabolito de la gliburida, el hemisuccinato de 4-trans-[1-[4-[2-(5-cloro-2-metoxibenzamidil)etil]-bencensulfonil]ureido]ciclohexanol [6], donde únicamente se cambia el ciclohexilo por el éster del hemisuccinato de ciclohexilo.
En este trabajo se describe la síntesis de la N-[4-[2-(2-oxo-2H-1-benzopiranil-3-carboxamidil)etil]bencensulfonil]-N'-ciclohexilurea (5a), sin precedente en la literatura, y de la N-[4-[2-(4-nitrobenzamidil)etil]bencenesulfonil]-N'-ciclohexilurea (5b). Estos compuestos, así como sus intermediarios 3a,b-4a,b, se caracterizaron completamente en solución por medio de RMN de 1H y de 13C en una y dos dimensiones, con la finalidad de obtener datos espectroscópicos sistemáticos que faciliten su caracterización y detección. Esto ayudaría, en su momento, a la mejor comprensión de su mecanismo de acción.
Resultados y discusión
El esquema 1 muestra la síntesis de las sulfonilureas 5a y 5b. El cumarín-3-carboxilato de etilo (1) se obtuvo por condensación del salicilaldehído con malonato de dietilo [7]. La clorosulfonación de la amida 3a, obtenida por condensación de la cumarina 1 con la fenetilamina, se realizó con ácido clorosulfónico, seguido de un tratamiento con hidróxido de amonio para obtener la sulfonamida 4a. Posteriormente, la sulfonilurea 5a se obtuvo por condensación en medio básico del compuesto 4a con el isocianato de ciclohexilo. La síntesis de 5b se realizó a partir del cloruro de p-nitrobenzoilo 2, siguiendo la metodología descrita para 5a, los rendimientos de ambas sulfonilureas son moderados (Esquema 1).

Los desplazamientos químicos en RMN tanto de 1H como de 13C del fragmento proveniente de la fenetilamina (Fig. 2) pueden utilizarse como una sonda química, ya que reflejan los cambios estructurales ocurridos en los intermediarios y derivados de las sulfonilureas. En las Tablas 1 y 2 se resumen los desplazamientos químicos en RMN de las sulfonilureas, así como de los precursores 3a, 3b, 4a y 4b. Los desplazamientos químicos del protón amídico NHA y del carbono C-1 son sensibles al efecto electroatractor del sustituyente R'. Ambos aparecen a frecuencias mayores en la serie b, donde se tiene un grupo nitro (R' = p-nitrofenilo), que en la serie a correspondiente a la cumarina.

Como era de esperarse, los átomos de carbono del anillo aromático de la fenetilamida varían sus desplazamientos químicos de acuerdo con el sustituyente en el anillo. El carbono C-4 (en posición para al sitio de la sustitución) parece ser el más sensible, desplazándose de 139 ppm (3a-b) a 143 ppm por efecto de la sulfonación (4a-b), y dos ppm más por formación de la sulfonamida (5a-b). El carbono C-7, si bien se recorre 16 ppm a frecuencias mayores por ser el que se sustituye directamente, no sufre cambio alguno por la formación de la sulfonamida.
El fragmento etilénico se presenta en 3a,b-5a,b como un conjunto de dos señales, un doble de triples para los protones metilénicos unidos al nitrógeno y un triplete para los protones metilénicos unidos al fenilo. Sin embargo, resulta de poca utilidad como sonda estructural ya que los desplazamientos químicos de 3a,b-5a,b, tanto de 1H como de 13C, permanecen sin cambio.
La asignación inequívoca de los desplazamientos químicos se realizó mediante experimentos de correlación heteronuclear 1H-13C (HETCOR). En todos los casos, los carbonos cuaternarios fueron resueltos mediante espectros acoplados de los compuestos 3a, 3b y 4b. Así, el espectro acoplado de RMN de 13C de 4b mostró cuatro señales para los carbonos ipso entre 140-150 ppm; es decir, en 149.0 ppm se observó una señal triple de triple para el carbono base del grupo nitro, en 140.1 ppm se observó una señal triple para el carbono base de la fenetilamida, mientras que en 142.1 ppm se encontró una señal triple para C-7, y una señal muy acoplada en 143.6 ppm para C-4, debido a los protones del metileno y del anillo aromático.
La asignación cuidadosa de las señales en los compuestos 1 y 3a,b permitió, por analogía, la asignación de las señales en los productos subsecuentes. Los protones amídicos pueden distinguirse fácilmente, NHA (3a,b-5a,b), aparece a frecuencias mayores (8.78-8.96 ppm) y siempre presenta acoplamiento con los protones metilénicos del fragmento proveniente de la fenetilamina, mientras que NHC (5a, b) se presenta a frecuencias menores (ca. 5.6 ppm, 3J = 8.1 Hz) como un doblete por acoplamiento con el protón axial del ciclohexilo.
Los desplazamientos químicos de 1H y 13C, correspondientes a la cumarina 1, se encuentran en la literatura [8]. Sin embargo, es conveniente destacar que la señal correspondiente al hidrógeno H-4 aparece como una señal simple en 8.49 ppm, debido a la desprotección del carbonilo del éster. Al formarse la amida, esta señal se recorre a frecuencias mayores, observándose entre 8.62 y 8.87 ppm (3a-5a) (pie de la Tabla 1). Por otra parte, el carbonilo lactónico del anillo de la cumarina se recorre a mayores frecuencias, de 156.4 ppm en el carboxilato de etilo de la cumarina 1 a 159.8-160.4 ppm, en (3a-5a) (pie de la Tabla 2). Estos hechos sugieren un cambio en el esquema de enlace del anillo de la cumarina. En las amidas 3a-5a existe una menor tendencia a deslocalizar la densidad electrónica hacia el carbonilo exocíciclico que hacia el carbonilo lactónico (debido a la formación de la amida). Por el contrario, en el éster 1, la deslocalización electrónica se da tanto hacia el carbonilo lactónico como hacia el carbonilo exocíclico.
Parte experimental
Los puntos de fusión fueron determinados en un aparato Electrothermal IA 9100 y no están corregidos. Los espectros de IR se hicieron en un espectrofotómetro Perkin-Elmer 16F PC. Los espectros de RMN se adquirieron en un espectrómetro Varian Mercury 300 (1H 300.07, 13C 75.45 MHz), utilizando TMS como referencia interna. Los datos de análisis elemental fueron obtenidos en un equipo de Análisis Elemental Perkin-Elmer 2400.
Cumarin-3-carboxilato de etilo (1). Preparado según la literatura [7] a partir de 2.44 g (0.02 mol) de salicilaldehído y 4.16 g (0.026 mol) de malonato de dietilo para obtener 3.29 g de 1 (80 %): IR (KBr) νmax 1764 (C=O), 1606 (=C-H) cm−1; RMN 1H (DMSO-d6) δ 8.49 (1H, s, H-4), 7.93 (1H, d, H-5), 7.39 (1H, dd, H-6), 7.74 (1H, dd, H-7), 7.45 (1H, d, H-8), 4.30 (2H, t, CH2), 1.36 (3H, q, CH3), 8.76 (t, NH) ppm. RMN 13C (DMSO-d6) δ 156.4 (C-2), 118.9 (C-3), 149.0 (C-4), 130.7 (C-5), 125.3 (C-6), 134.7 (C-7), 116.6 (C-8), 154.5 (C-9) 163.0 (C-11), 61.7 (CH2), 14.5 (CH3) ppm.
N-(2-feniletil)-2-oxo-2H-1-benzopiránil-3-carboxamida (3a). En 50 mL de etanol se refluyeron por 24 h una mezcla del compuesto 1 (5.0 g, 22.7 mmol) y fenetilamina (3.0 mL, 2.37 mmol). La mezcla de reacción se enfrió a temperatura ambiente y el sólido formado se filtró y lavó con etanol frío. El sólido amarillo resultante fue secado al vacío para obtener 3a como cristales color blanco (3.4 g, 56 %): pf 178-180 °C, IR (KBr) νmax 3325 (N-H), 1705 (C=O lactona), 1656 (C=O amida), 1608 (=C-H) cm−1. Anal. C, 73.69; H, 5.15; N, 4.77, calcd. para C18H15NO3; C, 74.34, H, 5.19, N, 4.20 %, encontrado.
4-nitro-N-(2-feniletil)benzamida (3b). A una mezcla de 3.0 g (16.1 mmol ) de cloruro de p-nitrobenzoilo y 2.9 g (16.1 mmol) de trietilamina en 25 mL de THF, se adicionaron, lentamente y con agitación vigorosa, 1.9 g de fenetilamina (16.1 mmol, 1 eq.) en atmósfera de nitrógeno y en baño de hielo. La mezcla resultante se dejó reaccionar, con agitación constante, por 24 h. El sólido resultante se filtró y lavó con 5 mL de agua y posteriormente se secó al vacío, para obtener 3b como cristales color naranja (3.51 g, 80.4 %): pf 147-149 °C, IR (KBr) νmax 3252 (N-H), 1636 (C=O amida) cm−1. Anal. C, 66.65; H, 5.21; N, 10.36, calcd. para C15H14N2O3; C, 65.99; H, 5.39; N, 9.70 %, encontrado.
4-[2-(2-oxo-2H-1-benzopiranil-3-carboxamidil)etil]bencensulfonamida (4a). A una solución de 3a (1.0 g, 3.4 mmol) en diclorometano (15 mL) y en baño de hielo, le fueron adicionados gota a gota y con agitación vigorosa, 1.13 mL de ácido clorosulfónico (16.9 mmol, 5.0 eq.). La mezcla resultante se dejó reaccionar a temperatura ambiente por 1 h. Se vació sobre una mezcla de agua y hielo. El sólido formado se filtró y lavó con agua fría, para después disolverse en 20 mL de dioxano. A la disolución anterior se le adicionaron 5 mL de hidróxido de amonio y se dejó en agitación por 1 h en baño de hielo. El sólido resultante se filtró y secó al vacío para obtener 4a como un sólido color blanco (0.64 g, 50 %). pf 230 °C desc.; IR (KBr) νmax 3346 (N-H), 3245 (SO2N-H), 1698 (C=O lactona), 1653 (C=O amida), 1607 (=C-H) cm−1. Anal. C, 52.87; H, 4.18; N, 6.85; calcd. para C18H16N2SO5.HCl; C, 53.91; H, 4.44; N, 5.94 %, encontrado.
4-[2-(4-nitrobenzamidil)etil]bencensulfonamida (4b). Se sintetizó en forma similar a la descrita para 4a, a partir de 3b (1.0 g, 3.7 mmol) utilizando 20 mL de una mezcla de CCl4 / CH2Cl2 (4:1) como disolvente. El sólido blanco resultante se neutralizó y secó al vacío para obtener 0.875 g (67.7 %) de 4b: pf 158-160 °C; IR (KBr) νmax 3307 (N-H), 1635 (C=O amida) cm−1. Anal. C, 44.61; H, 4.48; N, 10.40, calcd. para C15H15N3SO5.HCl.H 2O; C, 44.21; H, 3.97; N, 11.18 %, encontrado.
N-[4-[2-(2-oxo-2H-1-benzopiranil-3-carboxamidil)etil]bencensulfonil]-N'-ciclohexilurea (5a). A una mezcla de 4a (135 mg, 0.4 mmol) y K2CO3 (248 mg, 1.8 mmol, 5 eq.) en 10 mL de THF, se adicionaron, lentamente y con agitación, 45.1 mg (0.4 mmol, 1 eq.) de isocianato de ciclohexilo. La mezcla se refluyó por 24 h, se enfrió a temperatura ambiente y se filtró. El filtrado se evaporó a presión reducida para dar 50 mg (27.1 %) de 5a como un sólido blanco: p.f. = 158-160 °C; IR (KBr) νmax 3334 (N-H), 1709 (C=O) cm−1. Anal : C, 52;71; H, 6.18; N, 7.37, calcd. para C25H27N3SO6.4H2O. C, 52.23; H, 5.68; N, 6.61 % encontrado.
N-[4-[2-(4-nitrobenzamidil)etil]bencensulfonil]-N'-ciclohexilurea (5b). Se sintetizó siguiendo el procedimiento descrito para 5a, a partir de 4b (0.5 g, 1.43 mmol) y utilizando 25 mL de una mezcla 1:1 de dioxanoacetona (20 mg, 30.0 %): pf 129-132 °C; IR (KBr) νmax 1326 (NH), 1626 (C=O) cm−1. Anal. C, 40.37; H, 7.07; N, 8.55, calcd. para C22H26N4 SO6.10H20; C; 40.61; H, 6.33; N, 7.33 % encontrado.
Agradecimientos
Se agradece el apoyo financiero a la Coordinación General de Posgrado e Investigación del Instituto Politécnico Nacional, para el programa 5201.
Referencias
1. Velasco, A.; Lorenzo, P.; Serrano, J. S.; Andrés-Trelles, F. Farmacología de Velázquez, Interamericana-McGraw Hill: Madrid, 1994, pp. 864-868. [ Links ]
2. Litter, M; Farmacología Experimental y Clínica, El Ateneo: Buenos Aires, 1988, pp. 955-963. [ Links ]
3. Girardin, E.; Devolx, B. C. Therapie 1991, 46, 311-314; [ Links ] Okamoto, Y.; Tsura, Y.; Ishida, H. Diabetes Front 1990, 1, 603-608. [ Links ]
4. Englert, H. C.; Gerlach, U.; Goegelein, H.; Hartung, J.; Heitsch, H.; Mania, D.; Schidler, S. J. Med. Chem. 2001, 44, 1085-1098. [ Links ]
5. Hitzel, V.; Geisen, K.; Wayer, R.; Ritzel, H. (Hoechst A-G), J. Ger. Offen. DE 3,210,063, Chem. Abstr. 1983, p. 487, 1984, vol. 100. [ Links ]; Hitzel, V.; Weyer, R.; Geisen, K.; Ritzel, H. (Hoechst A-G), J. Ger. Offen. DE 3,209,866; Chem. Abstr. 1983, p. 440, 1984, vol. 100. [ Links ]
6. Stephon, R. L.; Niedbala, R. S.; Scharay, K. J.; Heidel, N. D. Org. Prep. Proced. Int. 1992, 24, 339-342. [ Links ]
7. Bonsignore, L.; Cottiglia, F.; Maccionini, A. M.; Secci, D.; Lavagna, S. M. J. Heterocycl. Chem. 1995, 32, 573-577. [ Links ]
8. Martínez-Martínez, F. J.; Padilla-Martínez, I. I.; Trujillo-Ferrara, J. Magn. Res. Chem. 2001, 39, 765-767. [ Links ]














