Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.45 no.2 Ciudad de México abr./jun. 2001
Investigación
Cálculo teórico y experimental del parámetro termodinámico de interacción de Flory del Poli(adipato de etileno)
Martha L. Cecopieri-Gómez*1 y Joaquín Palacios2
1 Instituto Mexicano del Petróleo, Dirección Ejecutiva de Exploración y Producción. L. Cárdenas 152, Col. San B. Atepehuácan, México 07730, D. F. E-mail: mcecopie@www.imp.mx
2 Universidad Nacional Autonóma de México, Facultad de Química, Lab. de Fisicoquímica de Macromoléculas; México 04510, D. F. E-mail: polylab1@sevidor.unam.mx
Recibido el 26 de marzo del 2001.
Aceptado el 5 de julio del 2001.
Resumen
En este trabajo se presenta la estimación del parámetro de interacción de Flory (χ), segundo coeficiente de virial (A2) y parámetro de solubilidad (δ2), para el Poli(Adipato de Etileno) PAE, plastificante polimérico para el PVC, mediante el empleo de un procedimiento basado en el modelo hidrodinámico de Stockmayer-Fixman que permite la estimación de tales cantidades a partir de mediciones viscométricas de soluciones de polímero en buenos disolventes a temperatura constante, en viscosímetros Ubbelhode. El método permite también la estimación de kϑ, parámetro no perturbado, haciendo uso de las constantes k y a de la ecuación de Mark-Houwink-Sakurada (MHS), lo cual resulta muy conveniente cuando se desea conocer el comportamiento hidrodinámico de un polímero en el estado no perturbado, lo que requiere de la disponibilidad de su disolvente ϑ (theta) y del conocimiento de la temperatura a la cual el polímero alcanza dicho estado; condiciones que en ocasiones imposibilitan la determinación experimental. Los resultados obtenidos mediante cálculo están en concordancia con aquellos determinados experimentalmente y son del mismo orden de magnitud de los reportados en la literatura especializada para poliésteres de estructuras similares. No obstante la importancia comercial del PAE, las cantidades determinadas no están reportadas en la literatura.
Palabras clave: Parámetro de interacción de Flory, segundo coeficiente de virial, parámetro de solubilidad, propiedeades hidrodinámicas del Poli(Adipato de Etileno).
Abstract
In this work we present the theoretical and experimetal determinations of the Flory interaction parameter χ, the second virial coefficient A2, and the solubility parameter δ2, of Poly (Ethylene Adipate) PEA, a PVC plasticizer. We have used the viscometric method for measuring dilute PEA solutions in good solvents: 1,4 dioxane, benzene, toluene, chloroform, THF and acetone. A procedure based on the Stockmayer-Fixman, (SF), hydrodynamic solution theory allows us to evaluate the thermodynamic parameters via the intrinsic viscosity, [h], measured in several solvents. This method estimates the unperturbed parameter, kϑ, in combination with the Mark-Houwink-Sakurada, (MHS), constants, k and a, obtained by viscosity measurements at constant temperature.
This procedure is a convenient way, when we want to know the hydrodynamic behavior of the polymers in the unperturbed state, specially when we do not have a theta solvent available, or the theta conditions make unable the viscosity measurements.
Our theoretical calculations of the solubility parameter, and interaction parmeter are in good agreement with the experimental values. These results were compared with those reported in the literature for a series of similar adipates, since PEA data have not previously been published.
Keywords: Flory Interaction Parameter, Second virial coefficient, Solubility parameter, Hydrodynamic Properties of Poly(Ethylene Adipate).
Introducción
El parámetro de interacción polímero-disolvente (χ), mejor conocido como parámetro de interacción de Flory, fue introducido por primera vez en 1942 por Flory [1] y Huggins [2] en la descripción de soluciones poliméricas. Esta cantidad, continúa siendo importante en la determinación de la estabilidad de los polímeros en solución.
χ puede medirse experimentalmente por los siguientes métodos: Hinchamiento de equilibrio, presión osmótica, presión de vapor, ultracentrifugación, sedimentación de equilibrio y viscometría, entre otros.
En 1986 Chee y colaboradores [3], con fundamento en el modelo hidrodinámico de Stockmayer y Fixman y a partir de las constantes empíricas, k y a, de la ecuación de Mark-Houwink-Sakurada (MHS), desarrollaron un procedimiento de análisis para estimar el parámetro no perturbado, (kϑ), el parámetro de interacción, (χ) y el segundo coeficiente de virial, (A2).
Una vez conocido χ, el cálculo de A2, que también representa una medida de la interacción entre el disolvente y el polímero se expresa de acuerdo con la teoría de Flory-Huggins-Krigbaum, [4] como:

Donde:
χ = Parámetro de interacción de Flory,
ν = Volumen específico del polímero,
V1 = Volumen molar del disolvente.
Existen algunos métodos experimentales para la estimación del parámetro de solubilidad para el polímero (δ2), tales como la determinación de la viscosidad intrínseca [η] de polímeros lineales en una serie de disolventes, con un amplio espectro de valores para δ (parámetro de solubilidad del disolvente). El parámetro de solubilidad para el polímero será el mismo de aquel disolvente en el cual el polímero tenga el más alto valor de viscosidad [5], [6].
Aunque este método experimental indirecto es de gran utilidad, hay otras formas de estimar δ2, entre ellas el Método de Fedors [7], que se basa en la suposición de que existen contribuciones atómicas y de grupo que pueden sumarse una vez conocida la estructura de la sustancia. Este procedimiento es aplicable tanto a líquidos como a polímeros.
En este trabajo se muestra la utilidad de la viscometría como una herramienta poderosa de análisis, mediante la cual a partir de mediciones de [η] de soluciones diluídas de PAE en: 1,4 dioxano, benceno, tolueno, cloroformo, tetrahidrofurano y acetona, se pueden determinar las cantidades termodinámicas que describen a las soluciones del PAE y que representan una medida de su interacción con los disolventes utilizados.
Metodología
La metodología de trabajo para la estimación de los parámetros termódinamicos está basada en la determinación de [η] a 30 °C, de soluciones diluídas de PAE en: 1,4 dioxano, benceno, tolueno, cloroformo, tetrahidrofurano y acetona. Para este fin, se obtuvo el poliéster mencionado, haciendo reaccionar ácido adípico y monoetilén glicol [9].
Síntesis y caracterización del polímero
Se sintetizó el PAE mediante la polimerización en solución de cantidades equimolares (0.15 moles) de ácido adípico y mono etilén glicol, reactivo Q. P. de Baker en 0.564 moles de tolueno, reactivo Analítico de Baker como medio de reacción. Se emplearon 0.0031 moles de ácido p-toluensulfónico con reactivo Q.P. de Baker como catalizador. La reacción se efectuó a 94 °C de acuerdo con los procedimientos reportados en la literatura para la obtención de poliésteres [8]. Durante el transcurso de la misma se tomaron muestras para disponer de polímero con diferentes pesos moleculares. Los grados de conversión seleccionados fueron bajos y menores al 20 %. Después de transcurridas 26 horas (tiempo total de reacción) la disolución final y cada una de las muestras se dejaron enfriar a temperatura ambiente y se precipitaron en etanol para posteriormente filtrarse y eliminar el exceso de disolvente en la estufa de vacío a no más de 30 °C.
Con el propósito de obtener muestras con un índice de polidispersidad bajo, las muestras así obtenidas, se purificaron mediante el proceso de precipitación por adición de un no disolvente, utilizando el par solvente / no-disolvente, benceno / éter de petróleo. Todas las muestras se filtraron a través de filtros millipore de 0.5 mm para posteriormente eliminar el no disolvente por evaporación con vacío.
Para la identificación del PAE se utilizaron las técnicas de espectroscopía de infrarrojo (IR); Resonancia Magnética Nuclear (RMN) y Calorimetría Diferencial de Barrido (DSC). Se encontró que las bandas de absorción en IR y las señales en RMN, así como el valor del punto de fusión, obtenido por DSC, corresponden a los del Poli(Adipato de Etileno) [9].
El peso molecular número promedio, Mn, de las muestras se determinó por la técnica de crioscopía, siguiendo el procedimiento que se describe en la literatura [14], para contar con valores absolutos del peso molecular. También, se determinaron los pesos moleculares número promedio, Mn, peso promedio, Mw, y z promedio, Mz, por GPC, en un cromatógrafo Waters con detector de Índice de Refracción Waters 410, columna Ultrastyragel Lineal Waters, empleando THF como eluyente a una velocidad de flujo de 1 ml/min a 30°C y 540-546 psi. Para ello, se utilizó el procedimiento de calibración universal a partir de estándares de poliestireno de pesos moleculares, peso promedio Mw de 580-35,000 a las mismas condiciones. La Tabla 1 presenta los valores de los índices de dispersión obtenidos, así como los pesos moleculares de las muestras utilizadas en el estudio, cuyos valores (Mw) se tomaron como: 3500, 3550, 3900, 4400 y 4500.
Viscometría
En la determinación del tiempo de flujo de cada una de las disoluciones de PAE se utilizó la metodología que señalan los estándares ASTM D2857-87 [10] y D446-89a [11]. Se prepararon disoluciones con una concentración inicial de 1 g / dL, efectuando diluciones sucesivas, a 10 mL de solución, mediante la adición de 2.0 mL del disolvente puro en turno, para obtener valores de concentración de: 0.833; 0.714 y 0.625 g de PAE / dL de solución. Después de cada adición de disolvente, se permitió un tiempo de espera de 10 minutos para que la temperatura en el viscosímetro Ubbelhode, alcanzara el equilibrio (30 °C). En las determinaciones con tolueno, tetrahidrofurano, benceno, cloroformo y acetona como disolventes, se utilizó un viscosímetro Ubbelhode No. 0C, mientras que en las evaluaciones con 1,4 dioxano, se empleó un viscosímetro Ubbelhode No. 1, con diámetros de capilar de 0.36 mm y 0.58 mm ± 2 %, respectivamente. En todos los casos las determinaciones del tiempo de escurrimiento se ejecutaron por triplicado, utilizando un cronómetro eléctrico con una precisión de 0.01 segundos.
Tratamiento de los datos
Los datos de viscosidad como una función de la concentración se extrapolaron a dilución infinita aplicando la bien conocida ecuación de Huggins. Ec. (2), para obtener los valores de [η].

En la estimación de las constantes k y a, se utilizó la expresión de MHS en su forma logarítmica, Ec. (3), aplicada a las diferentes disoluciones de PAE a 30 °C, utilizando la combinación de valores de peso molecular determinados por crioscopía y de viscosidad intrínseca [η], obtenidos de la Ec. (2). Veáse Tabla 2.


Estimación de kϑ
El parámetro no perturbado, kϑ, es un factor configuracional muy importante y útil en la estimación de las dimensiones no perturbadas de las cadenas de polímero así como de la rigidez de las madejas poliméricas. Convencionalmente, este factor se determina mediante la medición de la viscosidad de una serie de disoluciones diluídas de polimeros, aplicando la ecuación de MHS, Ec. (4), a las condiciones ϑ, bajo las cuales el efecto de volumen excluido de los segmentos de polímero es despreciable, lo cual permite establecer que: a = 1/2 y k = kϑ.

Claramente, esta técnica resulta irrelevante si no se dispone del disolvente ϑ, este es desconocido, o las condiciones ϑ imposibilitan la medición, como generalmente ocurre. En vista de esto, un buen número de métodos gráficos, basados en alguno de los modelos que describen a las soluciones diluidas de polímeros, han sido desarrollados. Uno de ellos es el propuesto por Chee y colaboradores [3]; el cual tiene su fundamento en el modelo de Stockmayer & Fixman, SF, Ec. (5).
El método de Chee predice el valor del parámetro no perturbado a partir de mediciones de la viscosidad en disolventes no theta, con tal que los mismos sean buenos disolventes. Así:

En la que:

Donde:
NA = es el número de Avogadro
C1 = es una constante numérica evaluada teóricamente como 1.55 [4]
Φ0 = Cte. universal o cte. de Flory = 2.87 × 1023
Dividiendo ambos miembros de la Ec. (4) entre M1/2 y desarrollando el lado derecho de la ecuación mediante una serie de Taylor en potencias de M1/2, hasta la raíz cuadrada de un peso molecular de referencia denominado M0, se obtiene:

para M cercano a M0, el tercero y siguientes términos del lado derecho de la Ec. (6) pueden ignorarse para establecer:

El valor de M0 debe cumplir con las condiciones: (a) αη a M0, designado como αη0, no debe ser mayor de 1.5 ya que por encima de este valor la Ec. de SF pierde su linearidad [3] y (b) las Ecs. (5) y (7) son idénticas, de manera que:

Aplicando logaritmos a la Ec. (9) y reacomodando:

La Ec. (10) es útil en la estimación de los valores de kϑ y M0 en buenos disolventes, (donde a ≥ 0.6), ya que corresponde a la ecuación de una recta a la que podemos ajustar los valores de k y a de la ecuación MHS, para obtener de su pendiente el valor de M0 y de la ordenada al origen el valor de kϑ. Así:

Las dimensiones no perturbadas de la cadena se pueden obtener a partir de:

Donde:
A = Factor asociado con el impedimento estérico a la rotación interna libre de los elementos de la cadena [12].
〈R2〉0 = Distancia extremo-extremo, cuadrado promedio, en el estado no perturbado.
Cálculo del parámetro de interacción de flory, (χ) y del segundo coeficiente de virial, (A2)
χ es un parámetro de energía libre que contiene un término entrópico y un término entálpico. Para un sistema polímero-disolvente no-polar o ligeramente polar, χ esta dado por la expresión (14):

Donde:
χs es el término entrópico, igual a la inversa del número de primeros vecinos de una molécula o segmentos en solución, es una cantidad dependiente de la temperatura.
χH es el término entálpico dado por [4], [13]:

Donde:
V1 es el volumen molar del disolvente
R es la constante universal de los gases
T es la temperatura termodinámica, (°K)
δ1 y δ2 son los parámetros de solubilidad del disolvente y del polímero, respectivamente. También conocido como parámetro de Hildebrand.
Termodinámicamente, un valor pequeño de χ indica un buen disolvente, es decir, el criterio de solubilidad para un polímero es que χ ≤ 0.5 [14].
De acuerdo con el modelo hidrodinámico de Kirkwood-Riseman [15], el cubo del factor de expansión viscométrico (αη) de una cadena polimérica flexible puede expresarse mediante una serie de potencias del parámetro del volumen excluido, z:

Donde, C1, C2, ... son constantes numéricas evaluadas teóricamente y z es el parámetro de volumen excluido, estrechamente asociado con 〈R2〉0 y χ mediante:

En la que,

Donde, NA, νp y V1, corresponden al número de Avogadro, al volumen específico parcial del polímero y al volumen molar del disolvente, respectivamente. Despreciando el tercero y siguientes términos del lado derecho de la Ec. (16) para valores de z pequeños, la ecuación se transforma en la ecuación de SF, Ec. (5).
La ecuación de SF es aplicable a sistemas en la vecindad del estado theta o cuando se emplean fracciones de polímero de peso molecular relativamente bajo, si se utilizan buenos disolventes. Esta observación constituye la base de nuestro análisis.
Combinando las Ecs. (18) con (8), (10) y (12), se obtiene una expresión útil para el cálculo de c, una vez conocidos los valores para kϑ, M0 y a.

La expresión termodinámica del parámetro de interacción de Flory χ es:

Donde ρp es la densidad del polímero.
Si νp = 1/ ρp se deduce que:

Originalmente χ fue propuesto como una medida de las interacciones energéticas en las soluciones poliméricas; actualmente χ es considerado como una función de energía libre residual pero a menudo también es utilizado como un parámetro empírico que describe la calidad termodinámica de un disolvente para un polímero. Como tal, χ determina la conformación que adoptan las cadenas de polímeros en la solución debido a la interacción de las moléculas con el disolvente y por lo tanto afecta a la viscosidad.
Kok & Rudin [16], desarrollaron un modelo que muestra que el segundo coeficiente de virial puede calcularse a partir de:

[η] = Viscosidad intrínseca (mL / g)
[η]ϑ = Visc. intrínseca en cond. ϑ (mL / g)
c = Concentración del polímero en la solución (g / mL)
M = Peso molecular del polímero (g / mol)
NA = Núm. Avogadro = 6.025 × 1023 (mol−1)
D = 1 − (αη3)−1
χ, puede entonces calcularse a partir de las ecuaciones (22) y (20).
En la literatura [17], se encuentran reportados algunos valores de A2 para poliésteres similares al PAE, Poli(oxi-etilen-oxi-adipoil); tal es el caso del PTMA, Poli(oxi-tetrametilen-oxi-adipoil) y del PHMA (Poli(oxi-hexametilen-oxi-adipoil) que registran los siguientes valores para A2:

Cálculo del parámetro de solubilidad δ
Una vez conocido χ, Ec. (20), podemos estimar el valor de δ a partir de la Ec. (15), asumiendo que la contribución entrópica χs es despreciable. La Ec. (15) se resuelve para δ2, si se conocen los términos restantes.
Haciendo uso de los datos de [η] para el PAE y de los valores de δ1 para los disolventes, mismos que se reportan en la Tabla 2, se estimó también δ2 mediante el método experimental de la viscosidad intrínseca. La figura 1 muestra el resultado de este procedimiento. Adicionalmente se aplicó el procedimiento propuesto por Fedors [7] para el cálculo de δ2 mediante contribuciones de grupo, partiendo de la estructura:
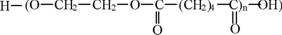

De acuerdo con la Ec. (23), se calculó el valor de δ2 = 10.06 (cal / cm3)1/2.

Resultados y discusión
Como un ejemplo, la Fig. 2 muestra la determinación de la [η], del PAE en 1,4 dioxano a 30 °C. La Tabla 3 presenta los valores de las constantes k y a de MHS así como los coeficientes de correlación obtenidos.

A partir de los valores de a, se puede afirmar que todos los disolventes utilizados son buenos disolventes para el PAE ya que en todos los casos a ≥ 0.6
La Fig. 3 corresponde a la representación gráfica de la ecuación (10) a partir de la cual se obtuvo kϑ = 0.0103786 (mL / g) y M0 = 1.178 × 103. Conocido el valor de kϑ y M0; mediante el uso de la Ec. (11), se calculó el valor de (αη0), que corresponde al factor de expansión viscométrico a un peso molecular M0. El parámetro (αη0), se reporta para cada uno de los disolventes en la Tabla 4. En esta misma tabla se resumen los valores de χ y A2 obtenidos mediante la teoría de los 2 parámetros y la constante a de MHS, ecuaciones (19 y 21), y los valores obtenidos según el modelo de Kok & Rudin y la expresión termodinámica para χ, Ecs. (20) y (22).

De estos valores, observamos que los obtenidos por el primer procedimiento no son consistentes con los reportados en la literatura; esto debido a que αη0 rebasa ligeramente el valor de 1.5 para todos los disolventes y la ecuación de SF, en la que se basa el análisis pierde su linearidad; lo que da lugar a desviaciones que hacen que el cálculo de χ basado en la Ec. (19) se tome con reserva. Por otro lado, A2 obtenido por el segundo procedimiento proporciona cantidades consistentes con los valores reportados para este parámetro en polímeros como PTMA y PHMA, que sólo difieren del PAE por el número de grupos metileno presentes en la cadena, por lo que era de esperarse que el valor de A2 fuera menor para el poliéster estudiado, en el caso del cloroformo, como efectivamente ocurrió (Tabla 4).
La Tabla 5 presenta los valores de (δ2) para el PAE. El valor obtenido para este concepto por el método experimental es de 9.9 (cal / cm3)1/2 que corresponde al (δ1) de la acetona; disolvente en el que el PAE registró el máximo valor de [η]. La Fig. 1 muestra este hecho. Este valor es el que consideraremos como el más adecuado. Las variaciones de los valores para δ2 estimados mediante contribuciones de grupo (Método de Fedors), y mediante la teoría termodinámica del parámetro de solubilidad, se muestran también en esta misma tabla. La Tabla 6 presenta algunos de los parámetros de los disolventes utilizados en la experimentación.

Conclusiones
De acuerdo con los resultados obtenidos en este estudio, se reconoce a la viscometría como una técnica de evaluación útil para las disoluciones poliméricas, a partir de la cual se obtiene información que combinada con la teoría adecuada nos permite estimar algunas cantidades hidrodinámicas de los polímeros en solución.
De acuerdo con los valores de χ calculados, el poder de disolución de los disolventes utilizados en el estudio se incrementa de acuerdo con el orden siguiente:
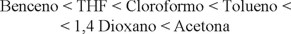
Conforme al valor del exponente a de la ecuación de MHS; el THF es el disolvente que más se aproxima al estado theta con una a de 0.797 y el 1,4 dioxano, el que más se aleja de él con un valor de a = 1.276.
Termodinámicamente, un valor pequeño de χ < 0.5 indica un buen disolvente, en ese sentido podemos mencionar que todos los disolventes utilizados son buenos disolventes ya que en todos los casos χ < 0.5.
Los valores obtenidos para δ2 mediante cálculo basado en su definición termodinámica Ec. (15), y el estimado a partir del método de contribuciones de grupo de Fedors, Ec. (23), respecto de los valores obtenidos mediante el método experimental de viscometría, no muestran una diferencia considerable por lo que podemos concluir que los valores obtenidos mediante cálculo son consistentes con los valores experimentales obtenidos por viscometría.
Referencias
1. Flory, P. J. J. Chem. Phys. 1942, 51. [ Links ]
2. Huggins, M. L.; Ann. N.Y. Acad. Sci. 1942, 43, 1. [ Links ]
3. Chee, K. K. Polymer Commun. 1986, 27, 135-137. [ Links ]
4. Chee, K. K. Polymer 1987, 28, 977. [ Links ]
5. Burrell, H; Immergut, B. Polymer Handbook, J. Brandrup and E. H. Immergut, Interscience Pub., New York, 1966, pp IV-341. [ Links ]
6. Elias H. G., Macromolecules Vol I, Plenum Press, pp. 205-210. [ Links ]
7. Fedors, R. F. Polymer Engineering and Science, 1974, 14, 147-154. [ Links ]
8. Allen, G.; Bevington, J.C., Comprehensive Polymer Science, Pergamon Press, N.Y. Vol. 5, Chapter 17, Polyesters, 1989, pp. 275-289. [ Links ]
9. Cecopieri G., M. L. Cálculo Teórico y Experimental del Parámetro de Solubilidad en los Polímeros, Poli (Adipato de Etileno), Tesis de Maestría, Facultad de Química, UNAM, 1998. [ Links ]
10. D 2857-87 (Oct 1987). Standard Practice for Diluted Solution Viscosity of Polymers, Annual Book of ASTM Standards, Vol. 08.01. [ Links ]
11. D446-89 a (Dec 1989). Standard Specifications And Operating Instructions For Glass Capillary Kinematic Viscometers, Annual Book of ASTM Standards, vol. 05.01. [ Links ]
12. Pethrick, R.A., Polymer Yearbook 3, Institute of Chemical Physics, USSR, Academy of Sciences, Moscow, Harwood Academy Publishers, 1986, pp 31-37, 69. [ Links ]
13. Barton, A. F. M. CRC Handbook of Polymer-Liquid Interaction Parameters and Solubility Parameters, CRC Press, Boca Raton, Flo., USA, 1990, pp. 525. [ Links ]
14. Rabek, J. F. Experimental Methods in Polymer Chemistry, Wiley-Interscience Publications, New York, 1980, pp 25-51. [ Links ]
15. Yamakawa, H. Modern Theory of Polymer Solutions, Chapter VI, Harper and Row, New York, 1971, pp. 300-302. [ Links ]
16. Meng K., C. and Rudin, A., J. Appl. Polym. Sci., 1982, 27, 353-362. [ Links ]
17. Brandrup, J.; Immergut, E. H. Polymer Handbook, [ Links ] Viscosity -Molecular Weight Relationships, M. Kurata, Y. Tsunashima, M. Iwama and K. Kamada, IV Solution Properties, John Wiley & Sons. N.Y. 1975, pp. 102-105. [ Links ]
18. The Sigma-Aldrich Library of Chemical Safety Data, 1988, Sigma-Aldrich Corporation, Milwaukee, Wisconsin, U.S.A., (Sigma: 314-771-5765; Aldrich: 414-273-3850). [ Links ]
19. Lide R. D., Editor, CRC Handbook of Chemistry and Physics, 74th Edition, CRC Press, Ann Arbor, Mich, U.S.A., 1993-1994. [ Links ]
20. Reid, R. C.; Prausnitz, J. M.; Poling B. E., The Properties of Gases and Liquids, 4th Edition, Mc. Graw Hill, Book Co. New York, 1987. [ Links ]
21. Chee K. K. Eur. Polym. J., 1995, 31, 155-159. [ Links ]














