Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.45 no.2 Ciudad de México abr./jun. 2001
Investigación
Erionita premodificada con K+ y zeolita 4A para la adsorción de propano y propileno
Gelacio Aguilar Armenta* y María Eugenia Patiño Iglesias
Centro de Investigación de la Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla, Blvd. 14 Sur y Av. San Claudio, Ciudad Universitaria, Puebla 72570, Pue., México. Fax: (2) 2 295 584. E-mail: geaguila@siu.buap.mx
Recibido el 20 de marzo del 2001.
Aceptado el 14 de junio del 2001.
Resumen
En este trabajo se informa de los resultados del estudio de la capacidad que presenta la zeolita natural ZAPS (erionita), así como la premodificada con K+ (ZAPS-K), de adsorber propano y propileno a t ≥ 20 °C. La medición de la cinética e isotermas de equilibrio de adsorción se realizó en un sistema volumétrico de alto vacío, construido en vidrio Pyrex y equipado con válvulas libres de grasa. Se estableció que en ZAPS, el C3H6 se adsorbe en mayores cantidades que el C3H8, debido a la contribución del enlace ϖ en la energía total de interacción. La muestra ZAPS-K presentó menor capacidad de adsorción que ZAPS y a diferencia de la ZAPS, la adsorción de ambos hidrocarburos y de C3H6 en 4A aumenta al aumentar la temperatura.
Palabras clave: Isoterma de adsorción, cinética de adsorción, erionita, propano, propileno.
Abstract
In this work, the adsorption uptake at t ≥ 20 °C of propane and propylene in natural zeolite ZAPS (erionite) and in K+-exchanged sample (ZAPS-K) was determined. Adsorption equilibrium isotherms and adsorption kinetics were carried out in a glass high-vacuum volumetric system, which was equipped with grease-free valves. It was established that the adsorption uptake of C3H6 in ZAPS sample was greater than that for C3H8, because of the contribution of ϖ-bonds to the total interaction energy. The adsorption capacity of ZAPS-K sample was lower than that of ZAPS. Unlike the ZAPS sample, the adsorption uptake of both hydrocarbons in ZAPS-K sample and for C3H6 in 4A increased with increasing temperature.
Keywords: Adsorption isotherm, adsorption kinetics, erionite, propane, propylene.
Introducción
El estudio de la adsorción de hidrocarburos puros en adsorbentes microporosos (zeolitas, carbones activados, etc.) es de gran importancia práctica, ya que a través del conocimiento del comportamiento de los procesos de equilibrio y cinético de adsorción de los hidrocarburos individuales se puede predecir la viabilidad del uso de estos sólidos microporosos en la separación de mezclas, por ejemplo, de propano (C3H8) y propileno (C3H6) y, por lo tanto, surge la posibilidad de sustituir el proceso de la destilación tradicional criogénica (−30 °C) fraccionada de estos hidrocarburos [1] por el método adsortivo a temperaturas cercanas a la del ambiente. Se ha informado [2] que el sistema AgNO3 / SiO2 y la zeolita 4A [3,4] presentan la propiedad de separar mezclas C3H8 / C3H6 por el mecanismo de la interacción específica de los enlaces ϖ con determinados centros de adsorción y por el de la diferencia en las velocidades de difusión, respectivamente. Sin embargo, hasta donde es de nuestro conocimiento no existe en la literatura ningún estudio de la adsorción de estos hidrocarburos en zeolitas naturales. En consecuencia, el objetivo de este trabajo consiste en el estudio del equilibrio y la cinética de adsorción de C3H8 y C3H6 en erionita natural (ZAPS) y premodificada con K+ (ZAPS-K) a t ≥ 20 °C y comparar los resultados con los que se obtengan en una muestra de zeolita sintética comercial 4A. Es también interesante hacer una comparación entre los resultados obtenidos por nosotros y los informados en la bibliografía para la zeolita 4A.
Metodología
La medición de la cinética y equilibrio de adsorción, a distintas temperaturas de los hidrocarburos puros se realizó en un sistema volumétrico de alto vacío, construido totalmente en vidrio Pyrex y equipado con válvulas libres de grasa. El alto vacío (< 10−4 Torr) fue creado por una bomba turbomolecular (Balzers) y las presiones se midieron con dos transductores de presión digitales (Balzers). La disminución drástica de la presión en el sistema, durante las mediciones cinéticas, se midió automáticamente con la ayuda de una tarjeta de adquisición de datos, capaz de registrar simultáneamente hasta 5 datos de presión por segundo. En todos los experimentos cinéticos, la presión inicial (Pin) fue igual a 600 mb. Las muestras (malla 30 / 40) se pretrataron a t ≥ 350 °C al alto vacío (10−4 Torr). La premodificación química de ZAPS se realizó de la siguiente manera: un gramo de muestra se colocó en una columna de vidrio con diámetro interno de 1.4 cm y 12 cm de longitud y se hizo pasar, por gravedad, a través del adsorbente durante una hora, una disolución de KCl a 0.05 N. Posteriormente, la muestra fue lavada con agua destilada hasta la eliminación total de cloruros. La cantidad de sustancia adsorbida (mmol / g) fue referida a un gramo de adsorbente deshidratado.
Resultados y discusión
a) Erionita natural (ZAPS)
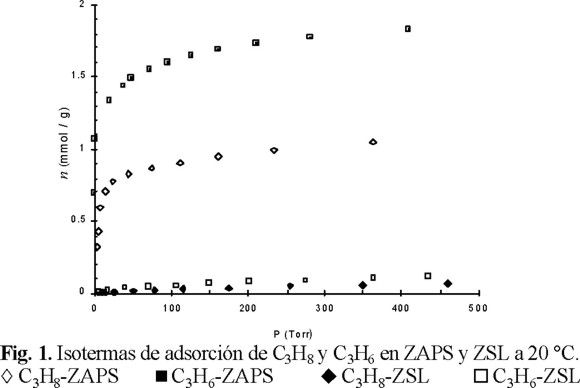
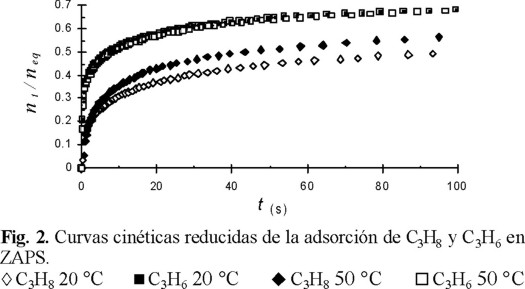
Las isotermas de adsorción (20 °C) de C3H6 y C3H8 en erionita natural, sin premodificación química, fueron de tipo I (Fig. 1) y se describieron por el modelo Langmuir con valores K de 0.1097 y 0.0727 (Torr−1), respectivamente. Por lo tanto, el C3H6 no sólo se adsorbe en mayores cantidades, sino que también interacciona más fuerte que el C3H8, debido a la contribución del enlace ϖ en la energía total de interacción con determinados centros de adsorción. Se midió la cinética de adsorción a 20 y 50 °C (Fig. 2), estableciéndose que las curvas cinéticas reducidas nt / neq = f(t), donde nt y neq es la adsorción en un tiempo t dado y en el estado de equilibrio, respectivamente, se comportan de distinta manera: hay adsorción activada de C3H8, mientras que para C3H6 ambas curvas cinéticas coinciden entre sí. Esto significa que la separación de estos hidrocarburos es favorecida a t ≤ 20 °C. En la figura 1, con fines de comparación, se incluyen también las isotermas de adsorción de estos hidrocarburos en clinoptilolita (ZSL), estableciéndose que en esta zeolita natural, ambos hidrocarburos se adsorben en cantidades despreciables y que se someten a la ecuación de Henry. Estos resultados probablemente obedezcan al impedimento estérico de penetración de las moléculas en los microporos de ZSL, cuyo diámetro es de 3.8 Å, por lo que la adsorción se lleva a cabo sólo en los mesoporos y/o en la superficie externa. La cinética de adsorción mostró que para esta zeolita la adsorción de los dos hidrocarburos es instantánea, confirmándose que la microporosidad no participa en el proceso de adsorción y, por lo tanto, mostrando muy baja selectividad de adsorción respecto al C3H6.
b) Erionita premodificada (ZAPS-K)
El objetivo de introducir los cationes grandes (1.33 Å) de K+ en la estructura cristalina de la erionita fue con el fin de mejorar, respecto a lo observado para la muestra (ZAPS), la separación de estos gases, buscando una difusión rápida de C3H6 y una difusión lenta de C3H8. Se encontró (Fig. 3) que la adsorción (20 °C) de ambos gases en ZAPS-K disminuyó drásticamente, en comparación con lo observado para la muestra sin premodificación (Fig. 1), conservándose aún una selectividad mayor para el C3H6, pero la diferencia entre ambas isotermas no es muy significativa.
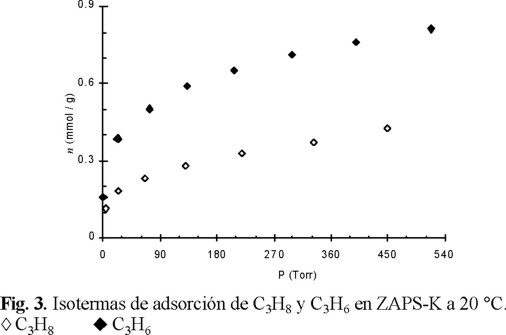
La isoterma de adsorción de C3H6 (Fig. 3) se describió por el modelo Langmuir con una constante de equilibrio K mucho menor que la registrada para la muestra original. Sin embargo, la isoterma de C3H8 sólo pudo ser descrita por la ecuación empírica de Freündlich: n = bPa , donde n es la cantidad de sustancia adsorbida, P es la presión de equilibrio, a y b son ciertas constantes empíricas. Esto significa que las interacciones adsorbente-adsorbato son más débiles en ZAPS-K, que en ZAPS, debido probablemente a la disminución de la basicidad y del grado de accesibilidad de los microporos al introducir K+ en la estructura del sólido.
En la figura 4 se encuentran las isotermas de adsorción de C3H8 y C3H6 a 20, 50, 80 y 111 °C. Los símbolos vacíos se refieren al C3H8, y los llenos al C3H6. Se observa que la cantidad de sustancia adsorbida de ambos hidrocarburos aumenta con el incremento de la temperatura, es decir, el proceso de adsorción es de tipo activado. Con la excepción del C3H8 a 20 °C, todas las isotermas de describieron por el modelo Langmuir, observándose una tendencia de aumento y disminución de K, respectivamente, para el C3H6 y C3H8 al aumentar la temperatura. Esto significa que en el intervalo de temperatura estudiado, el aumento de la temperatura provocó cada vez más una mayor interacción de C3H6 y una menor interacción de C3H8 con el adsorbente. Esto último sugiere que posiblemente la separación de estos gases se podría llevar a cabo con mayor eficiencia a temperaturas superiores a 20 °C. Se estableció (Fig. 4) que al aumentar la temperatura de 20 a 111 °C, la adsorción de ambos hidrocarburos aumentó en ≈ 2 veces.
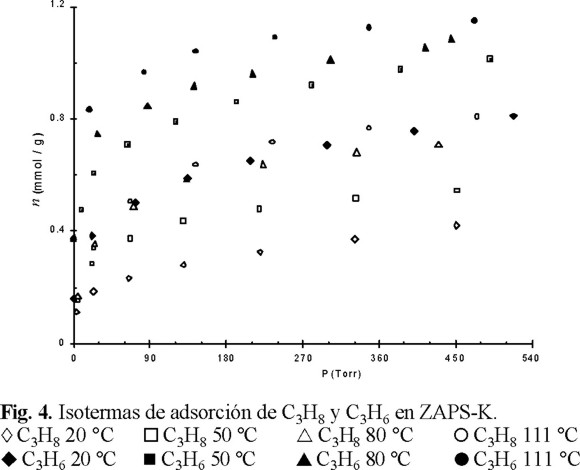
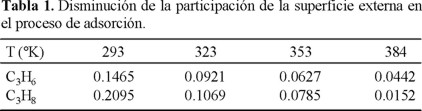
En virtud de los resultados de la figura 4, fue obligado estudiar el comportamiento cinético de la adsorción de C3H8 y C3H6 en esta muestra a distintas temperaturas. Los resultados de este estudio, los cuales se presentan en las figuras 5 y 6 para el C3H8 y C3H6, respectivamente, revelaron, como era de esperar, una concordancia con los resultados de la adsorción de equilibrio (Fig. 4). Sin embargo, el estudio cinético proporcionó información complementaria: la adsorción de ambos hidrocarburos en la superficie externa disminuyó con el aumento de la temperatura. Esto último se argumenta por la disminución del segmento en que las rectas at / aeq = f(t1/2) cortan al eje de las ordenadas (Tabla 1). En la Tabla 2 se dan los valores de los coeficientes de difusión (D) a las distintas temperaturas.
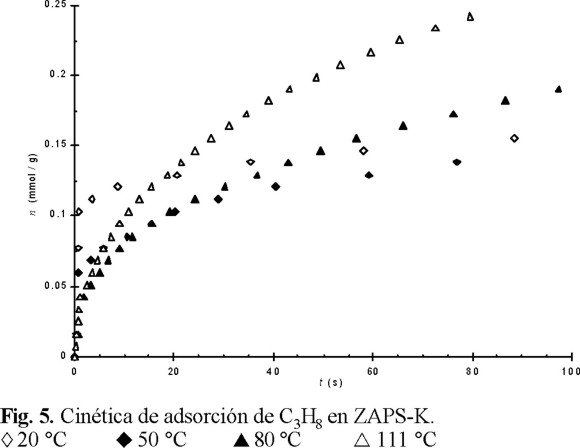


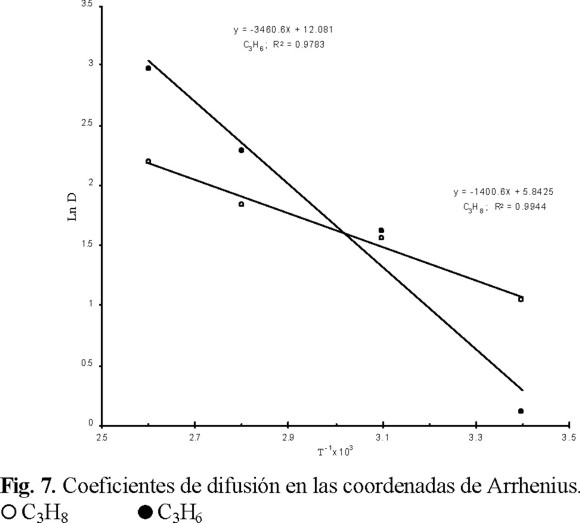
Como se puede observar, Tabla 2, el coeficiente de difusión del C3H6 aumenta en mayor proporción que el del C3H8; ésto significa que la energía de activación (E) del proceso de adsorción del C3H6 es mayor que la del C3H8. En la figura 7 se encuentra el trazo de los valores de los coeficientes de difusión (D) en función de la temperatura en las coordenadas de Arrhenius, encontrándose que los valores de energías de activación son 12 y 29 kJ / mol para C3H8 y C3H6, respectivamente.
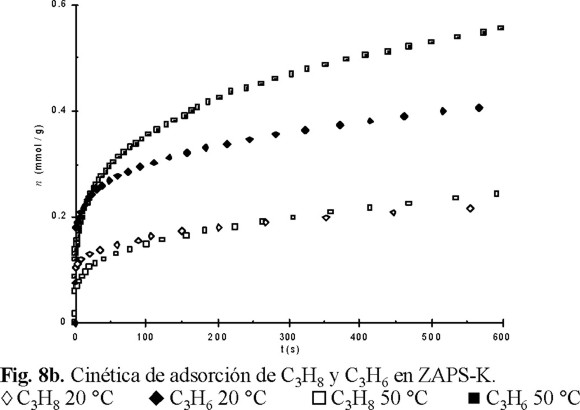
En la Figuras 8a y 8b se comparan las curvas cinéticas de adsorción de los hidrocarburos en estudio a 20 y 50 °C. Se observa que a tiempos de contacto t > 40 s (Fig. 8a), la separación a 50 °C podría mejorarse, respecto a la temperatura de 20 °C. De la Figura 8b se observa que para tiempos de contacto t ≈ 500 s, la adsorción de C3H8 a las dos temperaturas es muy similar, mientras que para el C3H6 hay una notable diferencia. Es decir, que la separación de estos gases podría llevarse a cabo con mayor eficiencia a la temperatura de 50 °C y a tiempos de contacto en el intervalo de 400 a 600 s. Este comportamiento está en correspondencia con el hecho de que la constante de equilibrio K de Langmuir haya aumentado y disminuido, respectivamente, para el C3H6 y C3H8 al aumentar la temperatura. Para las temperaturas de 80 y 111 °C, los resultados mostraron un comportamiento muy semejante al observado a 50 °C.

c) Zeolita 4A
La capacidad que presentó esta zeolita de adsorber C3H6 fue menor que la de ZAPS, pero mayor que la de ZSL. La isoterma de adsorción de C3H6 a 20 °C (Fig. 9) en 4A fue descrita sólo por la ecuación de Freünlich. El hecho de que la ecuación de Langmuir no haya descrito los puntos de la isoterma de adsorción de C3H6 significa que no hay una adsorción instantánea de este hidrocarburo en los microporos de 4A. Se observó, que el tiempo necesario para que se estableciera el equilibrio en cada punto de la isoterma (20 °C) fue demasiado grande, por lo que se midió la isoterma de adsorción a una temperatura mayor (70 °C). Fue establecido (Fig. 9) que el incremento de la temperatura provocó un aumento de la cantidad adsorbida de C3H6, es decir, el proceso de la adsorción de este gas es de tipo activado. Al comparar estos resultados con los publicados [3, 4] para una zeolita, también 4A, se observa una diferencia marcada entre la capacidades de adsorción. En la zeolita mencionada la isoterma es prácticamente rectangular (tipo I) y disminuye al aumentar la temperatura. Con la muestra 4A, estudiada en el presente trabajo, se obtuvo una isoterma tipo II o IV, que aumenta con el incremento de la temperatura.

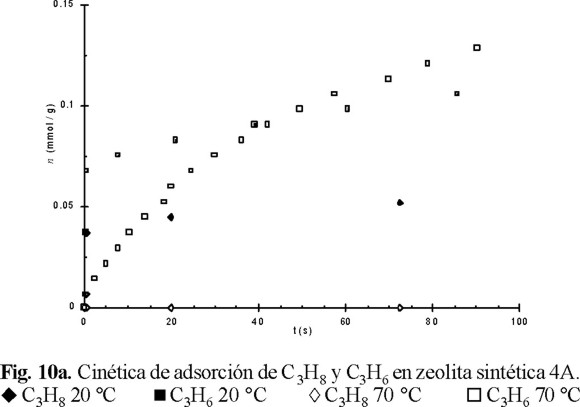
En virtud de los resultados obtenidos del comportamiento de la adsorción de equilibrio de C3H6 en 4A (Fig. 9), fue interesante estudiar la cinética de adsorción de este hidrocarburo a 20 y 70 °C. Los resultados obtenidos se presentan en las figuras 10a y 10b, para tiempos de contacto adsorbente-adsorbato bajos y altos, respectivamente. En estas figuras también se incluyen los resultados para el C3H8. Se observa que al incrementar la temperatura de 20 a 70 °C, la adsorción de C3H6 aumenta y la de C3H8 cae prácticamente hasta cero. Los datos de la figura 10a muestran claramente que al aumentar la temperatura, la adsorción en la superficie de mayor accesibilidad (mesoporos y/o superficie externa) del sólido disminuye, provocando un incremento de la participación de los microporos en el proceso de adsorción, ya que para tiempos de contacto pequeños (t < 50 s), la rapidez de adsorción de C3H6 a 20 °C es mayor que a 70 °C. Esta figura muestra también que para t > 50 s, el aumento de la temperatura condujo a una rapidez de adsorción mayor, es decir, que el factor temperatura facilitó la difusión de las moléculas de C3H6 en los microporos, mientras que para el C3H8 no se observa este fenómeno. Esto último significa que, por impedimentos estéricos, la molécula de C3H8 no logra entrar en los microporos de esta zeolita y la pequeña adsorción observada a 20 °C (Figura 10a), obedece a la participación sólo de la superficie de mayor accesibilidad.

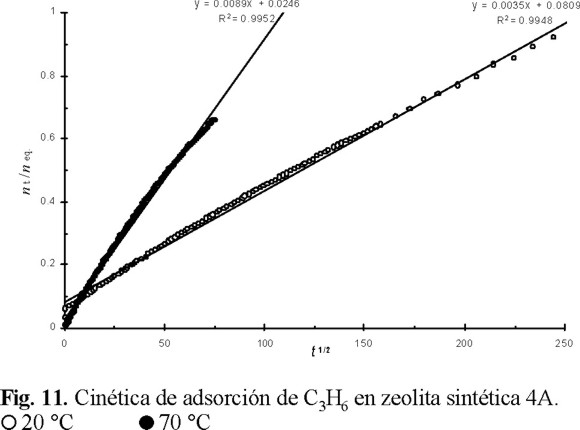
Con el fin de evaluar los coeficientes de difusión (D), así como la energía de activación (E) del proceso de adsorción de C3H6 en la zeolita 4A, las curvas cinéticas fueron graficadas en las coordenadas: nt / neq = f (t1/2). De la figura 11 se observa que los puntos experimentales se someten satisfactoriamente a una línea recta en estas coordenadas. Es importante hacer notar que todos los puntos de la curva a 20 °C, hasta el estado de equilibrio (19.5 h), fueron descritos por una línea recta, mientras que para la obtenida a 70 °C se observó una descripción hasta tiempos máximos de contacto de 1.5 h. Así, los valores de los coeficientes de difusión a 20 y 70 °C fueron 2.395 × 10−18 y 11.26 × 10−18 cm2 / s, respectivamente. Finalmente, la energía de activación (Arrhenius) fue de 26 kJ / mol.
Conclusiones
El estudio del equilibrio y de la cinética de adsorción del propano y del propileno reveló que la erionita presenta una capacidad alta de retención de estos hidrocarburos, así como una selectividad hacia el propileno, debido a las interacciones específicas del enlace ϖ con determinados centros de adsorción, los cuales están localizados en los microporos de la zeolita. Se estableció que la adsorción de C3H6 prácticamente no depende de la temperatura. En virtud de que la adsorción del propano aumenta levemente con la temperatura, la separación de estos hidrocarburos sería favorecida a temperaturas bajas (< 20 °C). Sin embargo, el hecho de que se hayan obtenido isotermas tipo I dificulta el uso de esta zeolita natural como fase activa para la separación de mezclas C3H8 / C3H6 por el método PSA. Lo ideal hubiera sido, para procesos de separación por PSA, que las isotermas de adsorción fueran más parecidas a la isoterma de Henry. La introducción de K+ se hizo precisamente con ese fin. Los resultados mostraron (Fig. 3), que con la muestra potásica (ZAPS-K) se obtiene una isoterma de adsorción de C3H6 menos parecida a la de tipo I, mientras que la de C3H8 fue totalmente distinta a este tipo. Sin embargo, a pesar de que se conservó la selectividad hacia el C3H6, la diferencia entre ambas isotermas no es muy significativa. El estudio cinético reveló que la adsorción de ambos hidrocarburos está controlada por la difusión activada, pero este efecto es mucho más marcado para el C3H6. Al parecer, una mejor separación podría llevarse a cabo a 50 °C con 400-600 s de tiempos de contacto mezcla-adsorbente (ZAPS-K). Los resultados obtenidos mostraron que el comportamiento de la adsorción en la zeolita sintética 4A de estos hidrocarburos no sólo no coinciden con los informados en la bibliografía [3, 4], sino que son contradictorios. La única coincidencia es que el C3H8 prácticamente no se adsorbe. Es probable, que la muestra de zeolita comercial 4A que nosotros estudiamos, pueda presentar mejor eficiencia de separación de mezclas de estos hidrocarburos, ya que, a diferencia con lo previamente publicado, no se obtuvo una isoterma de tipo I para C3H6.
Agradecimientos
Se agradece al Consejo Nacional de Ciencia y Tecnología (CONACyT) por haber apoyado a María Eugenia Patiño Iglesias con una beca (149990) para realizar estudios de Maestría en Ciencias Químicas (1999-2001).
Bibliografía
1. Keller, G. E.; Marcinkowsky, A. E.; Verma, S.K.; Williamson, K. D. Olefin Recovery and Purification via Silver Complexation. In: Separation and Purification Technology, Li, N. N., Calo, J. M., Eds., Marcel Dekker, New York, 1992. [ Links ]
2. Rege, S. U.; Padin, J.;Yang, R. T. AICH Journal, 1998, 44, 799-809. [ Links ]
3. Padin, J.; Rege, S. U.; Yang, R. T.; Cheng, L. S. Chem. Eng. Sci., 2000, 55, 4525-4535. [ Links ]
4. Da Silva, F. A.; Rodrigues, A. E. Ind. Eng. Chem. Res. 1999, 38, 2051-2057. [ Links ]














