Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.45 n.1 Ciudad de México Jan./Mar. 2001
Investigación
Obtención de la (R)- y (S)-6-acetiloxi-5-metil-2,3-hexanodiona, ópticamente puras
Jesús Sandoval-Ramírez,* Socorro Meza-Reyes, F. J. Meléndez y Guadalupe Hernández-Linares
Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla. Ciudad Universitaria, San Manuel, 72000 Puebla, Puebla, México. Tel.: (2) 229-55-00 Ext. 7382; Fax (2) 229-55-84. E-mail: jsandova@siu.buap.mx
Recibido el 2 de febrero del 2001.
Aceptado el 27 de marzo del 2001.
Resumen
Se describe la síntesis enantioselectiva del novedoso par enantiomérico de las α-dicetonas-γ-acetiladas 11 y 12 ópticamente puras, a partir de los compuestos (25S)-23-acetil-3β,26-diacetiloxi-5β-furost-22-eno (7) y (25R)-23-acetil-3β,26-diacetiloxi-5α-furost-22-en-12-ona (8), respectivamente, así como su caracterización espectroscópica.
Palabras clave: sarsasapogenina, hecogenina, síntesis enantioselectiva, α-dicetonas quirales.
Abstract
Herein we describe the enantioselective synthesis and spectroscopic characterization of the enantiomerically pure γ-acetyl-α-diketones 11 and 12, from compounds (25S)-23-acetyl-3β,26-diacetyloxy-5β-furost-22-ene (7) and (25R)-23-acetyl-3β,26-diacetyloxy-5α-furost-22-en-12-one (8), respectively.
Keywords: sarsasapogenin, hecogenin, enantioselective synthesis, chiral α-diketones.
Introducción
El esqueleto de la sarsasapogenina (1) encontró una gran aplicación en la investigación de nuevas fuentes de materias primas para la síntesis de hormonas sexuales masculinas y femeninas [1-3] y la hecogenina (2) en la obtención de análogos de corticosteroides [4]; sin embargo, no se ha hecho mención importante la utilidad de la parte hidrocarbonada (3) (Fig. 1) que es eliminada de la cadena lateral, a pesar de presentar una estereoquímica definida pues la quiralidad en C-25 no se altera durante las reacciones de oxidación.
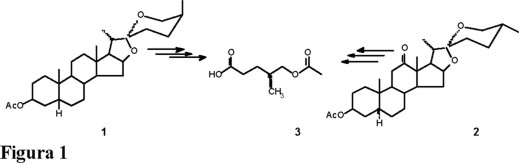
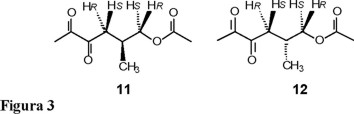
De los trabajos de Marker [5] y de otros investigadores [6-10], se llegó a obtener una buena metodología para preparar las estructuras furosténicas que contienen una doble ligadura entre C-20 y C-22, estructuras denominadas pseudosapogeninas, como la pseudosarsasapogenina (4) y la pseudohecogenina (5). Otro tipo de estructuras que podrían ser muy útiles en síntesis parcial de esteroides lo son los compuestos furost-22-énicos, también llamados isopseudosapogeninas, como la isopseudohecogenina (6); sin embargo, este último tipo de estructuras no han sido aisladas ni caracterizadas satisfactoriamente, pues son muy lábiles y conducen rápidamente al sistema espirocetálico característico de las sapogeninas. En nuestro laboratorio nos propusimos investigar nuevos caminos de síntesis de cadenas laterales esteroidales modificadas a partir de sapogeninas, mediante la preparación de los derivados furost-22-énicos estables 7 y 8, los cuales después de una oxidación conducirían a las γ-lactonas 23,24-bisnorcolánicas, 9, 10 (Fig. 2) y a los sintones 11, 12 (Fig. 3).
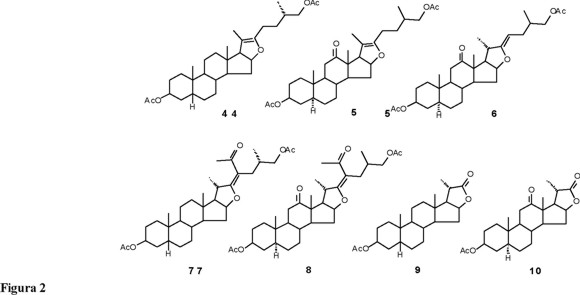
Este tipo de estructuras 23-acetil furost-22-énicas fueron reportadas con anterioridad por Cameron [7] y Zderic [11]. En el primer caso la estructura no pudo de ser caracterizada completamente debido a los bajos rendimientos obtenidos y en el segundo, el rendimiento mejoró a un 25 %.
La quiralidad de los diferentes centros estereogénicos presentes en las sapogeninas esteroidales naturales, sobre todo aquel correspondiente al C-25, ha sido ya informada [12, 13]; es así que se conoce que 1 pertenece a la serie 25S y que 2 es un compuesto con quiralidad R en C-25. Por tanto, la quiralidad de las fracciones hidrocarbonadas 11 y 12 generadas por la fisión del doble enlace en C-22 presente en 7 y 8 debe conservar la estereoquímica de la materia prima; es decir, la estereoquímica de las dicetonas 11 y 12 en C-5 deberá ser S y R respectivamente.
Las α-dicetonas son sintones muy importantes en síntesis química; se les ha utilizado como materias primas en la síntesis de α-diiminas quirales [14], formación de exo heterociclodienos [15], en la síntesis de dioles quirales[14], en la preparación de 1,6-dicetonas [17], en reacciones de ciclación tipo Mukaiyama-aldól [18].
Moléculas quirales como 11 y 12 son estructural y espectroscópicamente sencillas y como toda α-dicetona quiral puede ser útil en síntesis estereocontroladas.
El presente trabajo es una continuación de nuestra investigación acerca de las transformaciones de cadenas laterales de sapogeninas; en un reporte anterior describimos la obtención de un nuevo tipo de cadena lateral esteroidal: los derivados 23-acetil-22,26-epoxicolest-22-énicos [19].
Resultados y discusión
El tratamiento de sapogeninas, tanto de las series 25R como de la 25S, con anhidrido acético y trifluoruro de boro, a temperatura ambiente, condujo a los furostenos 7 y 8, estructuras del tipo isopseudosapogeninas. La nueva isopseudosapogenina 8 es muy estable, en medio ácido y básico, en comparación con la estabilidad de la isopseudosapogenina 6 lo que permitió su purificación por cromatografía en gel de sílice.
La doble ligadura del sistema cetónico α,β-insaturado de 7 y 8 fue oxidada con RuO4, generado in situ a partir de RuCl3 y NaIO4. La utilización del RuCl3 permite efectuar un proceso catalítico en el cual se recuperan totalmente las sales de rutenio una vez efectuada la oxidación. Este tipo de oxidación es muy rápida y permite aislar fácilmente las α-dicetonas ópticamente puras 11 y 12 con rendimientos cuantitativos. La caracterización estructural de los diferentes productos se llevó a cabo por métodos físicos y espectroscópicos (IR, masas, UV, RMN 1H y 13C). Los productos 11 y 12 presentan los mismos datos a excepción de aquel del signo del valor de la rotación óptica.
Así, el espectro de RMN de 1H de la (S)-6-acetiloxi-5-metil-2,3-hexanodiona (11) mostró en 2.34 y 2.03 ppm respectivamente, dos señales simples que corresponden a los metilos del acetilo y acetato, y en 0.98 ppm una señal doble para el metilo en C-5. Entre 4.03 y 2.63 aparecen 4 sistemas ABM correspondientes a los 4 protones diastereotópicos de los dos metilenos en C-4 y C-6; la asignación de los protones pro-quirales HS y HR se realizó en base a los valores de las constantes de acoplamiento. En 4.03 ppm una señal dd corresponde al protón H-6S (J6S,6R = 11.0 y J6S,5 = 5.5 Hz), en 3.85 ppm una señal para el protón H-6R (J6R,6S = 11.0 y J6R,5 = 7.0 Hz); en 2.82 ppm la señal dd para el protón H-4R (J4R,5 = 6.4 y J4R,4S = 17.3 Hz) y finalmente, en 2.63 ppm la señal dd para el protón H-4S (J4S,5 = 7.0 y J4R,4S = 17.3 Hz). Adicionalmente, en 2.39 ppm una señal ddddc para el protón en C-5 con J5,4S = 7.0, J5,6R = 7.0, J5,4R = 6.4, J5,6S = 5.5, J5,5 = 7.0 Hz debida a que el protón está acoplado con los 4 protones diastereotópicos de los metilenos en C-4, C-6 y con el metilo en C-5; El espectro de RMN de 13C muestra las 9 señales correspondientes a cada uno de los carbonos presentes en la molécula; las señales en 198.04, 197.25 y 170.91 ppm corresponden a los 3 carbonos de los 2 carbonilos de cetona y al carbonilo del éster, respectivamente. El espectro de correlación heteronuclear en dos dimensiones (HETCOR) permitió asignar inequívocamente cada una de las señales que presentan las α-dicetonas 11 y 12.
Para demostrar la pureza enantiomérica de 11; se llevó a cabo una reacción con la (S)-(−)-α-metilbencilamina. A 50 °C, se forma rápidamente la monoimina; esta reacción fue seguida por RMN. El análisis del espectro de RMN de 1H y 13C revelan que existe un solo producto. Así, el espectro de RMN 1H muestra en 4.76 una señal cuádruple que se asignó al metino en α de la imina. La señal de los protones en C-6 está ligeramente desplazada, de 4.03 y 3.85 a 3.98 y 3.92 ppm; por el contrario, la señal de los protones de C-4 sufre un mayor desplazamiento: de 2.82 y 2.63 ppm a 3.01 y 2.84 ppm; la señal del metilo C-1 aparece ahora en 1.96 ppm y la señal de metilo del acetato y del protón en C-5 no presentan una desplazamiento considerable, de 2.03 a 1.96, y de 2.39 a 2.40 ppm. Una señal doble en 0.96 ppm corresponde a los protones del metilo en C-5. La región donde aparece la señal doble del metilo a a la imina (1.47 ppm) y del metilo en C-5 (0.96 ppm) está libre de otras señales, corroborando la presencia de un único producto. En RMN 13C el espectro sólo nos muestra las 15 señales de la imina correspondiente, entre ellas las señales en 201.71, 171.11 y 163.82 corresponden a los carbonos de carbonilo de cetona, del éster y de la imina, respectivamente. Finalmente, el espectro de correlación heteronuclear en dos dimensiones (HETCOR) permitió asignar correctamente las señales presentes en la imina. Tanto los datos espectroscópicos arriba citados como cálculos ab-initio [20] de los orbitales moleculares frontera de 11, muestran que el grupo cetónico en C-2 es mucho más reactivo que el presente en C-3.
Parte experimental
Las rotaciones específicas, en soluciones clorofórmicas, se determinaron en un polarímetro Perkin Elmer Mod. 241, utilizando celdas de 1 dm, y una fuente de luz de sodio (línea D) a 25 °C. Los espectros de UV fueron obtenidos en un equipo BECKMANN DU-7000 empleando soluciones etanólicas al 98 %; las longitudes de onda se expresan en nm. Los espectros de IR se obtuvieron en un espectrofotómetro Nicolet Magna FT-IR 750, los datos se expresan en cm−1. Los espectros de RMN de 1H y 13C se realizaron en un espectrómetro JEOL eclipse a 400 y 100 MHz respectivamente, utilizando CDCl3 como disolvente y TMS como referencia interna. Los espectros de masas se determinaron a 70 eV en un espectrómetro Hewlett Packard 5989A, acoplado a un cromatógrafo de gases Hewlett Packard 5890 Serie II; los datos se expresan en como relación de m/z.
Método general de oxidación de los furostenos 7 y 8
En un matraz de 50 mL se disuelven 500 mg (0.9 mmol) del furosteno (25S)-3 o (25R)-4 en 6 mL de acetonitrilo. Posteriormente se adiciona una solución acuosa de NaIO4 (695 mg en 1 mL de H2O) y una cantidad catalítica de RuCl3; la solución se mantiene bajo agitación vigorosa y atmósfera inerte. La reacción es seguida por cromatografía en capa fina utilizando como eluyente una mezcla de acetato de etilo-éter de petróleo (3:7). Cuando ya no se observa materia prima (aproximadamente 15 min), la mezcla de reacción se pasa por una capa de sílica gel y se eluye con CH2Cl2; el filtrado se lava sucesivamente con una solución al 10 % de bisulfito de sodio, solución saturada de cloruro de sodio y finalmente con agua. La fase orgánica se seca con sulfato de sodio anhidro, se concentra en el rotavapor y se separa por cromatografía en columna de gel de sílice utilizando como eluyente acetato de etilo-éter de petróleo (3:7). La reacción es cuantitativa.
(E)-(25S)-23-acetil-3β,26-diacetiloxi-5β-furost-22-eno (7). Polvo amorfo: pf 118-120 °C; [α]D = + 45.12 (c 1.0, CHCl3); UV (EtOH) λmax (ε) 278.4 (16000); IR (KBr) νmax1733, 1659, 1260 cm−1; RMN 1H, δ (CDCl3, 400 MHz) 5.06 (1H, s-ancha, H-3), 4.95 (1H, m, H-16), 3.94 (1H, dd, J26a,25 = 5.1 J26a,26b = 8.6 Hz, H-26a), 3.90 (1H, dd, J26b,25 = 5.1 J26b,26a = 8.6 Hz, H-26b), 2.21 (3H, s, Me-23"), 2.06 (3H, s, Me-26"), 2.04 (3H, s, Me-3"), 1.17 (3H, d, J21,20 = 7.2 Hz, Me-21), 0.96 (3H, s, Me-19), 0.88 (3H, d, J = 7.2 Hz, Me-27), 0.55 (3H, s, CH3-18); RMN 13C, (CDCl3, 100 MHz) δ 198.69, 178.12, 171.33, 170.87, 107.37, 85.23, 70.67, 69.44, 62.52, 55.47, 41.79, 40.15, 38.46, 38.30, 37.29, 35.05, 35.04, 33.54, 33.10, 31.16, 30.78, 30.61, 29.24, 26.43, 26.34, 25.02, 23.88, 21.61, 21.09, 20.48, 19.87, 16.53, 13.36. EM-IE m/z (int. rel.): 542 (M+.) (30), 482 (35), 439 (50), 379, 315, 205 (90), 161 (100), 43 (22). Anal. C 72.74, H 9.26, O 17.72, calculado para C33H50O6, C 73.03, H 9.29, O 17.69.
(E)-(25R)-23-acetil-3β,26-diacetiloxi-5α-furost-22-en-12-ona (8). Agujas cristalinas: pf 144-145 °C; [α]D + 83.56 (c 1.0, CHCl3); UV (EtOH) λmax (ε) 277 (4949) nm; IR (KBr) νmax 1732, 1707, 1665, 1243 cm−1; RMN 1H, (CDCl3,400 MHz) δ 4.84 (1H, m, H-16), 4.61 (1H, m, H-3), 3.84 (2H, m, H-26), 2.14 (3H, s, Me-23"), 1.99 (3H, s, Me-26"), 1.96 (3H, s, Me-3"), 1.18 (3H, d, J21,20 = 7.0 Hz, Me-21), 0.88 (3H, d, J27,25 = 7.0 Hz, Me-27), 0.87 (3H, s, Me-19), 0.85 (3H, s, Me-18); RMN 13C, (CDCl3, 100 MHz) δ 212.46, 198.40, 177.85, 171.19, 170.60, 108.11, 84.21, 73.10, 68.93, 55.82, 55.60, 54.68, 54.08, 44.47, 38.87, 37.26, 36.29, 36.17, 34.21, 33.78, 33.28, 32.99, 31.42, 31.30, 29.20, 28.11, 27.21, 21.43, 21.02, 19.31, 17.27, 13.54, 11.88. EM-IE m/z (int. rel.): 556 (M+.) (24), 496 (30), 453 (52), 205 (48), 163 (33), 43 (100). Anal. C 71.22, H 8.63, O 20.14 calculado para C33H48O7, C 71.05, H 8.67, O 20.32.
(S)-6-acetiloxi-5-metil-2,3-hexanodiona (11). Líquido verde, aceitoso, peb 35 °C (45 mm Hg); [α]D-9.85 (c 1.4, CHCl3); UV (EtOH) λmax (ε) 418 (25) nm; IR (KBr) νmax 1735, 1716, 1238 cm−1; RMN 1H, (CDCl3, 400 MHz) δ 4.03 (1H, dd, J6S,6R = 11.0, J6S,5, = 5.5 Hz, H-6S), 3.85 (1H, dd, J6R,5 = 7.0 y J6R,6S = 11.0 Hz, H-6R), 2.82 (1H, dd, J4R,4S = 17.3, J4R,5 = 6.4 Hz, H-4R), 2.63 (1H, dd, J4S,4R = 17.3 J4S,5 = 7.0 Hz, H-4S), 2.39 (1H, ddddc, J5,4S = 7.0, J5,6R = 7.0, J5,4R = 6.4, J5,6S = 5.5, J5,5' = 7.0 Hz, H-5), 2.34 (3H, s, H-1), 2.03 (3H, s, Me-CO), 0.98 (3H, d, H5',5 = 7.0 Hz, Me-5); RMN 13C, (CDCl3, 100 MHz) δ 23.60 (C-1), 198.04 (C-2), 197.25 (C-3), 68.33 (C-4), 28.66 (C-5), 39.19 (C-6), 170.91 (Me-CO), 20.84 (CH3-CO), 16.98 (CH3-5); EM-IE m/z (int. rel.): 185 (M+-1), 143 (10), 101 (30), 83 (15), 59 (12), 55 (18), 43 (100). Anal. C 58.01, H 7.65, O 34.32, calculado para C9H14O4 C 58.05, H 7.58, O 34.37.
(R)-6-acetiloxi-5-metil-2,3-hexanodiona (12). Líquido verde, aceitoso, peb 35 °C (45 mm Hg); [α]D + 9.90 (c 1.4, CHCl3); RMN 1H, (CDCl3, 400 MHz) δ 4.03 (1H, dd, J6S,6R = 11.0, J6S,5 = 7.0 Hz, H-6S), 3.85 (1H, dd, J6R,5 = 5.5 y J6R,6S = 11.0 Hz, H-6R), 2.82 (1H, dd, J4R,4S = 17.3, J4R,5 = 7.0 Hz, H-4R), 2.63 (1H, dd, J4S,4R = 17.3 J4S,5 = 6.4 Hz, H-4S), 2.39 (1H, ddddc, J5,4S = 6.4, J5,6R = 5.5, J5,4R = 7.0, J5,6S = 7.0, J5,5' = 7.0 Hz, H-5), 2.34 (3H, s, H-1), 2.03 (3H, s, Me-CO), 0.98 (3H, d, H5',5 = 7.0 Hz, Me-5). Anal. C 57.99, H 7.66, O 34.39, calculado para C9H14O4 C 58.05, H 7.58, O 34.37.
(20S)-3β-acetoxi-5β-pregnan-20,16 β-carbolactona (9). Polvo amorfo: pf 183-185 °C; [α]D-31.38 (c 1.0, CHCl3); IR (pastillas de KBr) νmax 1768, 1757, 1734, 1254 cm−1; RMN 1H, (CDCl3, 400 MHz) δ 5.07 (1H, m, H-3), 4.94 (1H, m, H-16), 2.57 (1H, c, J20,21 = 7.3 Hz, H-20), 2.05 (3H, s, Me-3"), 1.31 (3H, d J21,20 = 7.3 Hz, Me-21), 0.99 (3H, s, Me-19), 0.74 (3H, s, Me-18); RMN 13C, (100 MHz, CDCl3) δ 181.37, 170.75, 82.88, 70.54, 59.18, 54.72, 41.91, 40.14, 38.55, 37.23, 36.12, 35.12, 35.04, 33.07, 30.78, 30.61, 26.39, 26.29, 25.02, 23.84, 21.55, 20.43, 18.03, 13.90; EM-IE m/z (int. rel.): 389 (M+.+1) (2), 328 (100), 313 ((75), 272 (20), 218 (10), 147 (20), 108 (46), 93 (28), 43 (CH3CO). Anal. C 74.45, H 9.41, O 16.76, calculado para C24H36O4, C 74.19, H 9.34, O 16.47.
(20S)-3β-acetoxi-12-oxo-5α-pregnan-20,16β-carbolactona (10). Polvo amorfo pf 224-226 °C; [α]D + 23.23 (c 1.0, CHCl3); IR (pastillas de KBr) νmax 1773, 1731, 1704, 1240 cm−1; RMN 1H, (CDCl3, 400 MHz) δ 4.90 (1H, m, H-16), 4.67 (1H, m, H-3), 2.59 (2H, m, H-17 y H-20), 2.02 (3H, s, Me-3"), 1.39 (3H, d, J21,20 = 7.3 Hz, Me-21), 1.07 (3H, s, Me-19), 0.93 (3H, s, CH3-18); RMN 13C, (100 MHz, CDCl3) δ 212.48, 180.86, 170.66, 80.93, 73.05, 55.77, 55.55, 53,96, 50.87, 44.43, 37.32, 36.73, 36.29, 36.18, 34.15, 33.74, 32.44, 31.38, 28.02, 27.19, 21.46, 17.32, 13.86, 11.91; EM-IE m/z (int. rel.): 402 (M+.), 342 (96), 288 (39), 283 (18), 246 (30), 173 (29), 147 (74), 107 (63), 93 (84) , 43(100). Anal. C 71.46, H 8.61, O 19.65, calculado para C24H34O5 C 71.61, H 8.51, O 19.87.
Agradecimientos
Este trabajo se realizó con el apoyo de CONACyT al proyecto (35235) y a S.M.R. y G.H.L. (Becastesis Nos. 144955 y 91278). Agradecemos a PROQUINA la donación de muestras de sarsasapogenina y al Institut de Chimie des Substances Naturelles por la determinación de los microanálisis.
Referencias
1. Marker, R. E.; Rohrmann, E. J. Am. Chem. Soc. 1940, 62, 518-520. [ Links ]
2. Marker, R. E.; Rohrmann, E.; Crooks, H. M.; Wittle, E.L.; Jones, E. M.; Turner, D.L. J. Am. Chem. Soc. 1940, 62, 525-527. [ Links ]
3. Marker, R. E.; Jones, E. M.; Krueger, J. J. Am. Chem. Soc. 1940, 62, 2532-2536. [ Links ]
4. Schmidlin, J.; Wettstein, A. Helv. Chim. Acta. 1953, 36, 1241-1251. [ Links ]
5. Marker, R. E. ; Tsukamoto, T.; Turner, D. L. J. Am. Chem. Soc. 1940, 62, 2525-2532 y referencias ahí [ Links ] citadas.
6. Gould, D. H.; Staudle, H.; Hershberg, E. B. J. Am. Chem. Soc. 1952, 74, 3685-3688. [ Links ]
7. Cameron, A. F. B., Evans, R. M.; Hamlet, J. C.; Hunt, J. S. J. Chem. Soc. 1955, 2807-2816. [ Links ]
8. Dauben, W. G.; Fonken, G. J. J. Am. Chem. Soc. 1954, 76, 4618-4619. [ Links ]
9. Micovic, I. V.; Ivanovic, M. D.; Piatak, D. M. Synthesis 1990, 591-592. [ Links ]
10. Wall, M. E.; Kenney, H. E.; Rothman, E. S. J. Am. Chem. Soc. 1955, 77, 5665-5668. [ Links ]
11. Zderick, J. A.; Cervantes, L.; Galvan, M. T. J. Am. Chem. Soc. 1962, 84, 102-106. [ Links ]
12. Fieser, L.; Fieser, M. Steroids. Reinhold, San Francisco, 1959. [ Links ]
13. Hill, R. A.; Kirk, D. N.; Makin, H. L. J.; Murphy, G. M. Eds., Dictionary of Steroids. Chapman & Hall, London, 1991. [ Links ]
14. Una nueva aplicación: Martínez-García, M.; Klimova, E.; Vázquez-García, R. A.; Gutiérrez-Pérez, R. Rev. Mex. Fís. 2000, 46 S2, 126-131. [ Links ]
15. Véase ejemplo reciente: Mandal, A. B.; Gómez, A.; Trujillo, G.; Méndez. F.; Jiménez, H. A.; Rosales, M. J.; Martínez, R.; Delgado, F.; Tamariz, J. J. Org. Chem. 1997, 62, 4105-4115. [ Links ]
16. Para una nueva metodología: Ravikumar, K. S.; Sinha, S.; Chandrasekaran, S. J. Org. Chem. 1999, 64, 5841-5844. [ Links ]
17. Méndez-Andino, J.; Paquette, L. A. Org. Lett. 2000, 2, 1263-1265. [ Links ]
18. Para un caso relevante ver: Larger, P.; Köhler, V. Org. Lett. 2000, 2, 1597-1599. [ Links ]
19. Sandoval-Ramírez, J.; Castro-Méndez, A.; Meza-Reyes, S.; Reyes-Vázquez, F.; Santillán, R.; Farfán, N. Tetrahedron Lett. 1999, 40, 5143-5146. [ Links ]
20. Los cálculos se llevaron a cabo empleando el método ab-initio Hartree-Fock con base 6-311+g** (base triple Z).














