Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.45 no.1 Ciudad de México ene./mar. 2001
Investigación
Catalizadores de Pd soportados en óxidos mixtos Al-Mg: síntesis, caracterización y actividad
C. Calderón,1 M. Rebollar1, M. A. Valenzuela1 y J. Salmones 2,3*
1 Instituto Politécnico Nacional. ESIQIE, Laboratorio de Catálisis y Materiales, UPALM-Zacatenco. México 07738, D. F.
2 Instituto Mexicano del Petróleo. Simulación Molecular. Eje Central Lázaro Cárdenas 152, México 07300, D. F.
3 Universidad Autónoma Metropolitana-Azcapotzalco. Av. San Pablo 180, México 02200, D. F. E-mail: jsalmone@www.imp.mx
Recibido el 21 de octubre del 2000.
Aceptado el 21 de febrero del 2001.
Resumen
Se prepararon soportes de óxidos mixtos Al-Mg con diferente composición empleando los métodos de coprecipitación y de sol-gel. La caracterización de estos materiales se llevó a cabo por absorción atómica, análisis térmico DTA / TGA, difracción de rayos-X y fisisorción de N2. Con los soportes calcinados a 600 °C se prepararon catalizadores de paladio (1 %) mediante impregnación, posteriormente se calcinaron y se redujeron a 500 °C. La evaluación de los catalizadores se efectuó en la deshidrogenación normal de propano a 500 °C y presión atmosférica. Por el método de sol-gel se obtuvieron sólidos con una mayor superficie específica y una mayor homogeneidad en la distribución porosa comparados con los de coprecipitación. A pesar de la baja temperatura de calcinación, los principales compuestos fueron la espinela de MgAl2O4 y fases libres de MgO y de Al2O3, dependiendo de la composición de los soportes.
Aparentemente, la mayor conversión se tiene cuando el paladio se soporta en estructuras estables (espinelas) y se tiene una baja interacción con el soporte, por tal motivo los catalizadores de Pd soportados en los óxidos mixtos coprecipitados fueron más activos que en los de sol-gel. La selectividad a propileno varió en el intervalo de 57-93 %, lo que se explicó en función de la acidez total. La mayor desactivación se observó con los catalizadores empleando soportes sol-gel.
Palabras clave: Catalizadores, paladio, óxidos mixtos, actividad catalítica, desactivación.
Abstract
Al-Mg mixed oxides supports with various compositions were synthezised by coprecipitation and sol-gel. The characterization was carried out by atomic absorption, thermal analysis (DTA/TGA), N2 physisorption, and X-ray diffraction (XRD).
These solids, after calcined at 600 °C were used as supports of monometallic Pd (1 %) catalysts prepared by impregnation. The catalytic properties were evaluated in a flow micro-reactor at 500 °C and atmospheric pressure. The highest specific surface area values and the major homogeneity in pore size distribution were obtained with the sol-gel preparations compared with the coprecipitated. In spite of low calcination temperature, the main compounds detected by XRD were MgAl2O4 spinel, and free phases of MgO and Al2O3, depending of Al2O3 / MgO molar ratios. The highest conversion levels were obtained with solids showing spinel structure (more stable) having a low metal-support interaction. By this reason, monometallic Pd catalysts supported on coprecipitated solids (mainly with spinel structure) were more active than those supported on sol-gel. The selectivity to propylene in both series of catalysts varied in the range of 57 to 93 %, which it was explained as a function of the surface acidity. A major deactivation was observed with Pd catalysts supported on sol-gel mixed oxides.
Keywords: Catalysts, palladium, mixed oxides, catalytic activity, deactivation.
Introducción
La deshidrogenación de parafinas es una reacción de creciente interés industrial. Basta mencionar el incremento en la demanda de etileno, propileno e isobutileno, para justificar el desarrollo de nuevos procesos [1].
Tradicionalmente las olefinas se han obtenido como subproductos de la desintegración térmica y catalítica de naftas y gasóleos. Sin embargo, la demanda no se logra cubrir totalmente por lo que se requiere la producción directa de las respectivas parafinas. Existen dos formas de llevar a cabo la deshidrogenación de parafinas: normal y oxidativa. En el primer caso se extrae el hidrógeno y en el segundo tiene lugar una combustión parcial del mismo. Indudablemente que la vía normal es la más interesante, ya que se obtiene hidrógeno como subproducto y en la segunda CO2 + H2O. Este trabajo, se enfocará hacia la deshidrogenación normal de propano para obtener propileno.
El propileno, al igual que el etileno, son las materias primas básicas en la producción de polímeros. La mayor parte de propileno que se consume en la industria petroquímica se utiliza en la producción de polipropileno y glicol.
El propileno se obtiene, sobre todo, por desintegración térmica del propano o nafta, o mediante la deshidrogenación catalítica del propano. En las investigaciones preliminares se usaron diversos catalizadores, pero desde 1930 se enfocaron hacia los de cromo [2]. Posteriormente se utilizaron catalizadores de Pt para la deshidrogenación del propano, y se han desarrollado en paralelo a los catalizadores para la reformación de naftas.
Los soportes deben exhibir una alta estabilidad térmica y gran capacidad para dispersar la fase metálica. La deshidrogenación de parafinas ligeras puede estar acompañada de reacciones indeseables como la desintegración o la hidrogenólisis y la formación de coque [3].
Actualmente se utilizan o están en vías de desarrollo cinco procesos catalíticos para la deshidrogenación de alcanos. La diferencia fundamental es el tipo de reactor o el tipo de catalizador utilizados, tal y como se muestra en la Tabla 1 [4].

La reacción de deshidrogenación requiere de altas temperaturas usualmente mayores de 800 K, por tanto, es necesario utilizar materiales altamente estables como la alúmina que tiene propiedades ácidas y gran área específica, sin embargo, promueve la formación de coque provocando la rápida desactivación del catalizador [5]. Es por eso que se requiere desarrollar procesos alternativos, donde se utilicen sistemas catalíticos neutros autorregenerativos y altamente selectivos.
Una de las alternativas es la aplicación de los óxidos metálicos como soportes, ya que son capaces de presentar una gran diversidad de propiedades estructurales, generándose sitios ácido-base con propiedades catalíticas. Algunos sistemas de óxidos mixtos reportados son TiO2-MgO, Al2O3-MgO, Al2O3-ZnO, Al2O3-CaO, TiO2-ZrO2 y SiO2-ZnO, en donde la adición de pequeñas cantidades de MgO, ZnO, CaO, contribuye a mejorar la actividad, selectividad o estabilidad de reacciones de hidrodesulfuración, deshidrogenación, hidrogenación y oxidación [6].
Son muy escasos los trabajos en los que se utilizan óxidos mixtos Al-Mg como soportes de metales nobles, sobre todo variando la relación atómica Al/Mg. Por tal motivo, en el presente trabajo exploratorio se estudió la síntesis y la caracterización de los óxidos mixtos Al-Mg, como soportes de catalizadores de Pd en la deshidrogenación directa de propano. Estos materiales tienen propiedades distintas que los soportes convencionales debido a la contribución de propiedades entre los dos extremos, Al2O3 y MgO, en cuanto a una mayor superficie específica, mayor estabilidad térmica y mecánica, propiedades requeridas debido a las elevadas temperaturas a las que se llevan a cabo las reacciones de deshidrogenación.
Parte experimental
Síntesis de los soportes
Método de coprecipitación. Se sintetizaron los óxidos mixtos (Al2O3-MgO), así como de los óxidos puros mediante la coprecipitación de los hidróxidos de aluminio y de magnesio a pH constante [7], mediante soluciones acuosas de los nitratos de magnesio y de aluminio (Mg(NO3)2·6 H2O, Al(NO3) 9 H2O). Se utilizó como agente precipitante una solución amoniacal al 50 % en volumen de NH4OH. Los geles se mantuvieron en reposo por 48 h. Posteriormente se realizaron lavados para eliminar el exceso de la solución amoniacal y subproductos. Los hidrogeles resultantes se filtraron y se secaron a 120 °C por 8 h. Finalmente se calcinaron a 600 °C durante 8 h obteniéndose los óxidos mixtos Al2O3-MgO. La composición de los óxidos Al2O3 / MgO, se muestra en la Tabla 2.
Método sol-gel. En un reactor de vidrio cerrado y con agitación magnética, se adicionó alcohol etílico y trisecbutóxido de aluminio [C 2H3CH(CH3)O]3Al (Aldrich 97 % en peso) relación molar alcohol / alcóxido = 60 [8], iniciándose la agitación vigorosa, manteniéndose en reflujo por 1 h. Posteriormente, se adicionó el étoxido de magnesio dejándose a reflujo nuevamente 1 h. Se preparó una mezcla de agua y ácido con una relación molar agua/alcóxido = 30 y ácido/ alcóxido = 0.2. Después de la agitación de los reactivos, se inició la hidrólisis, adicionando la mezcla de agua y ácido gota a gota, para finalmente dejarlo a reflujo por 1 h. Todas las muestras se dejaron en reposo por 48 h. La eliminación del alcohol y del agua se llevó a cabo por medio de filtración al vacío, los geles resultantes se secaron a 120 °C por 8 h para eliminar el exceso de alcohol. La calcinación de los precursores de los óxidos mixtos de aluminio y magnesio fue a 600 °C durante 8 h al aire. Los resultados se muestran en la Tabla 2.
Preparación de los catalizadores
Se prepararon catalizadores Pd / Al2O3-MgO en concentración de paladio al 1 % en peso a partir de los soportes sintetizados (coprecipitación, sol-gel). Los catalizadores se prepararon por impregnación incipiente, utilizando una solución de nitrato de paladio en medio ácido. Posteriormente los catalizadores se secaron a 120 °C durante 8 h, por último se llevó a cabo la calcinación a 500 °C por 8 h en al aire.
Caracterización
La composición química de soportes y de catalizadores se determinó por absorción atómica en un equipo Perkin Elmer-5000. La identificación de compuestos se realizó mediante difracción de rayos-X en un difractómetro Siemens D-5000 acoplado a un tubo con ánodo de cobre. La radiación se separó con un monocromador de haz difractado. Los patrones se identificaron utilizando los archivos JCPDS. El cálculo del área específica (método BET), volumen de poro, diámetro promedio de poro y la distribución de porosidad se efectuó con las isotermas de adsorción de nitrógeno a 77 K, obtenidas con un sortómetro Digisorb-2600. El análisis termogravimétrico se efectuó en un equipo Perkin Elmer, modelo TSG-2, en un intervalo de temperaturas que va desde la temperatura ambiente hasta 1000 °C, a una velocidad de calentamiento de 10 °C / min, bajo corriente de aire. El análisis termodiferencial se efectuó en un equipo Perkin Elmer ATD-1700 el cual emplea alfa-alúmina como materia de referencia, hasta 1000 °C, con una velocidad de calentamiento de 10 °C / min. La deshidrogenación del propano se realizó en una planta de microreacción automatizada (Xytel) [9]. La carga del reactor fue de 0.1 g, flujo de propano 40 mL / min, W / F = 5.29 g mol / h, relación molar hidrógeno/propano 1:1, temperatura de reacción 500 °C y presión atmosférica. El catalizador se activó in situ con hidrógeno. Los productos se analizaron en un cromatógrafo Perkin Elmer AutoSystem XL.
Resultados y discusión
Composición química
En la Tabla 3 se muestran los resultados de la composición química real de los óxidos mixtos (Al2O3-MgO), donde los soportes sintetizados por coprecipitación presentan una relación molar Al2O3 / MgO menor a la nominal. Esto se debe a que el precursor de aluminio forma hidróxidos que se disuelven en la solución evitando que precipite, no sucediendo así para el magnesio. En los soportes por sol-gel se presenta un valor mayor al nominal, esto es, los precursores de aluminio forman la mayor proporción por este método de síntesis, sin embargo, se puede concluir que los soportes por coprecipitación se ajustan mas a los valores nominales que los preparados por sol-gel.
Identificación de compuestos
En las figuras 1 y 2 se comparan los patrones de difracción de los soportes calcinados a 600 °C por coprecipitación y sol-gel, en ambos métodos de síntesis se observa que conforme aumenta el contenido de aluminio, los picos se ensanchan, pasando los sólidos de cristalinos a amorfos. Por otro lado, los difractogramas de los óxidos mixtos por sol-gel son más amorfos que los de coprecipitación por tanto los cristales son más pequeños, y por consiguiente se esperaría mayor área específica, como se verá mas adelante en los análisis de fisisorción de nitrógeno.


Textura
En general se observa que los soportes son función directa de la composición y del método de síntesis (Tabla 4). Por el método de sol-gel se obtuvieron las mayores áreas específicas. Por ambos métodos de síntesis, conforme aumenta el contenido de MgO, disminuye significativamente el área específica.
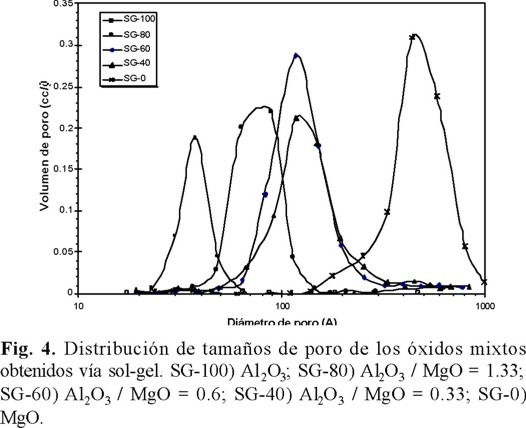
En cuanto a la distribución de porosidad de los soportes ésta fue unimodal por los dos métodos de síntesis (Figs. 3 y 4), sin embargo, por sol-gel se presentan curvas más estrechas que por coprecipitación. Además, con la adición del Mg se incrementa el tamaño de los poros reduciendo el volumen de poro y la superficie específica.

Estabilidad térmica
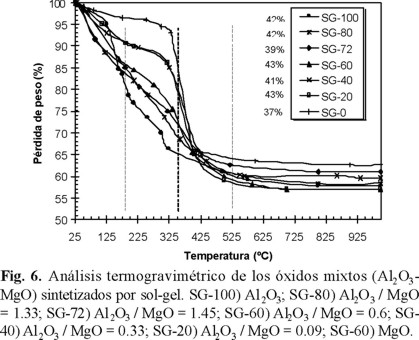
En las figuras 5 y 6 se presentan los análisis termogravimétricos por coprecipitación y sol-gel, donde independientemente del método de síntesis se observan 3 intervalos de temperatura de pérdida de peso: la primera de 28-175 °C atribuida a la eliminación de agua y alcohol superficial, la segunda zona 175-350 °C debido a la descomposición de nitratos residuales e hidróxidos así como de materia orgánica (alcóxidos) residuales, la tercera etapa entre 350-525 °C correspondiente a la eliminación de agua de cristalización o deshidroxilación, esto es, la formación de los óxidos mixtos.

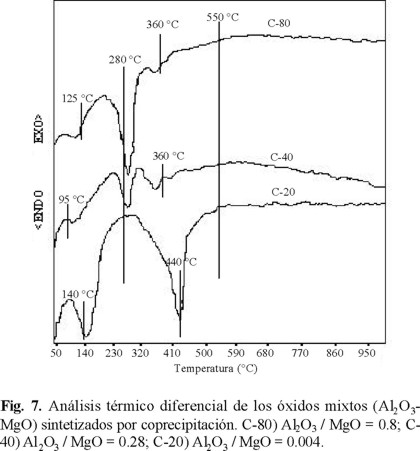
El efecto de la temperatura sobre los soportes se determinó por medio del análisis térmico diferencial (Fig. 7 y 8), en donde se observa que los picos endotérmicos corresponden a las zonas de pérdida de peso del análisis termogravimétrico. Se muestran los primeros picos endotérmicos entre 50-140 °C correspondientes al agua y alcohol fisisorbido. El siguiente pico endotérmico se presenta entre 140-280 °C (coprecipitación) a excepción de C-20 que solo presenta un gran pico hasta los 440 °C. Esto puede ser por el contenido de Mg presente en el sólido y 140-350 °C (sol-gel) debido a la eliminación de nitratos y alcóxidos. El último pico endotérmico 280-440 °C (coprecipitación), 350-500 °C (sol-gel), atribuido a la eliminación del agua de cristalización.

Evaluación catalítica en la deshidrogenación de propano
En la Tabla 5 se presentan los resultados de conversión y de actividad específica (TOF) [10] de los catalizadores Pd / Al2O3-MgO, donde se observa que la conversión de propano disminuye al aumentar el contenido de MgO en el soporte, a excepción de los catalizadores soportados en los óxidos puros (Al2O3 y MgO); aparentemente los catalizadores preparados por coprecipitación son ligeramente más activos que los catalizadores obtenidos por sol-gel. En ambos casos, con la adición de pequeñas cantidades de MgO (relación molar Al2O3 / MgO entre 0.8 coprecipitado y 1.33 sol-gel) se obtienen los catalizadores más activos.

Se observa que la selectividad hacia propileno es relativamente baja (~ 80 %) sin tener relación con el contenido MgO en el soporte y por otro lado en la dispersión del catalizador (Tabla 6). Los subproductos obtenidos fueron: metano, etano, etileno, y productos pesados lo que supone que éste tipo de reacción favorece también a las reacciones de hidrogenólisis.

Conclusiones
Por el método sol-gel se obtuvieron sólidos mejor consolidados que por el método de coprecipitación, teniendo valores de composición química más aproximados a los nominales. Al efectuar la calcinación (600 °C), se tiene una estructura con la característica de que al aumentar el contenido de Mg disminuye el área específica (coprecipitación). Por el contrario, mediante sol-gel, los poros son más pequeños obteniéndose una mayor área específica. La formación de la fase estable de la espinela MgAl2O4, fue independiente del método de síntesis empleado.
En cuanto a la actividad catalítica de las muestras se refiere, la mayor conversión se ha obtenido cuando el paladio se soporta en estructuras estables "tipo espinela" y se tiene una baja interacción con el soporte. Los catalizadores coprecipitados fueron más activos que los sintetizados por sol-gel. La selectividad a propileno varió en el intervalo de 57 a 93 %. La mayor desactivación se obtuvo con los catalizadores sintetizados mediante sol-gel.
Referencias
1. Jackson, S. D.; Grenfell, J.; Matheson, I. M.; Munro, S.; Raval, R.; Webb, G. Catalyst Deactivation, 7th International Symposium, México, 1997, Vol. 111, 167-174. [ Links ]
2. Kearby, K. K., "Catalytic Dehydrogenation", from Catalysis (Ed. P. H. Emmett), 1995, Vol. III, Ch. 10, 453. [ Links ]
3. Padró, C. L.; Castro, M. A.; Scelza, O. A., Catalyst. Deactivation, 7th International Symposium, México, Vol. 111, 1997, 191-198. [ Links ]
4. Vatcha, S. R.; Trifiró, F.; Cavani, in "Oxidative Dehydrogenation and Alternative Dehydrogenation Process", Catalytica, Ed. D. Helius, 1993, No. 4992 OD. [ Links ]
5. Osvaldo F.; Gorriz, F.; Vicente C. C.; José L. G. Ind. Eng. Chem. Res. 1992, 31, 2670-2674. [ Links ]
6. Maezawa, A.; Okamoto, Y.; Imanaka T. J. Chem. Soc., 1987, 64, 665-674. [ Links ]
7. Halstedt, B. J. Am. Ceram. Soc. 1992, 75, 1407-1507. [ Links ]
8. Gates, B. C.; Katzer, J. R.; Schuit, G. C. H. Chemistry of Catalytic Processes, McGraw-Hill, 1978. [ Links ]
9. Calderón C., Tesis de Maestría, IPN-ESIQIE, 1999.
10. Aguilar-Ríos, G.; Salas, P.; Valenzuela, M. A.; Wang, J. A.; Salmones, J. Catalysis Letters 1999, 60, 21-25. [ Links ]














