Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química de México
versão impressa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.4 Ciudad de México Out./Dez. 2000
Investigación
Preparación de hidrotalcitas mediante radiación de microondas. Evaluación de la actividad catalítica
Guillermo Negrón,1* Lídice Soto,1 Adriana Guerra,1 Leticia Lomas2 y Juan Méndez2
1 UAM-Azcapotzalco, Área de Química Aplicada, Av. San Pablo No 180, México 02200, D.F. E-mail: gns@correo.azc.uam.mx
2 UAM-Iztapalapa. Departamento de Química. Po. Box. 55-534. México 09340, D. F.
Recibido el 27 de junio del 2000.
Aceptado el 9 de octubre del 2000.
Resumen
Se prepararon las hidrotalcitas Mg-Al-CO3, Ni-Al-CO3, Co-Al-CO3 y Cu- Mg-Al-CO3, mediante métodos convencionales y por radiación de microondas. Se efectuó la evaluación de la actividad catalítica de las hidrotalcitas calcinadas en reacciones de apertura nucleofílica del óxido de estireno usando cianuro de trimetilsilano y pirrolidina.
Palabras clave: Hidrotalcitas, radiación, microondas, catálisis.
Abstract
The hydrotalcites Mg-Al-CO3, Ni-Al-CO3, Co-Al-CO3 y Cu-Mg-Al-CO3 were prepared by classical methods and microwave irradiation. The evaluation of the catalytic activity of calcined hydrotalcites in ring opening of styrene oxide using trimethylsilyl cyanide and pyrrolidine was performed.
Keywords: Hydrotalcites, irradiation, microwave, catalysis.
En memoria del Dr. Raúl Cetina Rosado
Introducción
Las hidrotalcitas son hidroxicarbonatos de magnesio y aluminio que pertenecen al grupo de las arcillas anionicas de estructura laminar tipo brucita [1]. Las hidrotalcitas calcinadas generan óxidos mixtos deshidratados y deshidroxilados, que se usan como catalizadores en: condensacion aldólica [2], reformación de hidrocarburos con agua [3], reacciones de hidrogenación [4], reacciones de oxidación [5] y soportes para catalizadores Ziegler-Natta [6].
Se encuentran descritos en la literatura varios procedimientos para preparar catalizadores a partir de hidrotalcitas [7]. La activación catalítica de estos sólidos se debe a que los sitios fuertemente básicos se producen por evacuación a altas temperaturas de aniones oxigenados con números de coordinación bajos. Los procedimientos de activación de estos materiales se orientan a la formación de estos sitios, los cuales corresponden a sitios básicos de Lewis [8].
Por ser una de las técnicas más fiables y reproducibles para la preparación de catalizadores, se usó la técnica de co-precipitación. La aplicación de radiación de microondas en la síntesis de sólidos con éste tipo de estructura resulta atractiva ya que se evita el calentamiento a alta temperatura, los tiempos de reacción son más cortos y en muchos de los casos la cristalinidad de los materiales preparados por este método es conservada [9]. El tamaño de los cristales de la hidrotalcita MgAlCO3 obtenida por radiación de microondas es más pequeño que el obtenido por el método convencional [10].
La hidrotalcita calcinada MgAlCO3 preparada por tratamiento térmico convencional, cataliza la cianolización de compuestos carbonílicos y la apertura nucleofílica de oxiranos [11] (Fig. 1).

Las reacciones de apertura de epóxidos con compuestos nitrogenados, normalmente se llevan a cabo en condiciones de reflujo, éstas son utilizadas en la síntesis de β-aminoalcoholes, productos intermediarios en la obtención de inhibidores de proteasa [12]. La apertura de óxido de estireno con pirrolidina se lleva a cabo en etanol y a reflujo [13] (Fig. 2).

Con el objeto de generalizar el método de radiación de microondas en la obtención de hidrotalcitas, se prepararon una serie de estos materiales mediante el tratamiento térmico por ésta vía y se compararon sus propiedades de cristalinidad, área superficial y estabilidad térmica, con las de hidrotalcitas obtenidas por tratamiento térmico clásico. La búsqueda de condiciones más suaves de reacción de aminación de epóxidos nos motiva a estudiar las propiedades catalíticas básicas de estos sólidos. Las hidrotalcitas fueron calcinadas y evaluadas como catalizadores en la apertura nucleofílica de óxido de estireno; algunas de ellas con cianotrimetilsilano, otras con pirrolidina.
Resultados y discusión
Caracterización de hidrotalcitas
Difracción de rayos X. En las figuras 3 y 4 se muestra el patrón de difracción de rayos X para las muestras obtenidas por el método convencional. Se observan picos finos y simétricos para los planos (003), (006), (110) y (113); picos anchos y asimétricos para los planos (102), (105) y (108), característicos de arcillas minerales con estructura laminar (Fig. 3).

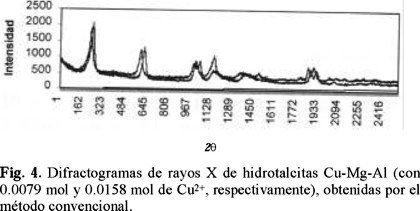
En los difractogramas, se puede observar que el compuesto más cristalino es el que contiene Mg-Al, seguido de los compuestos de Cu-Mg-Al dado que las reflexiones que presentan, están más definidas con respecto a las de aquellos que contienen Ni-Al y Co-Al. Se puede observar también, que en los compuestos de Cu-Mg-Al existen diferencias de cristalinidad, siendo más cristalino el compuesto con menor cantidad de Cu2+, que corresponde al difractograma que se muestra en la parte inferior de la figura 4.
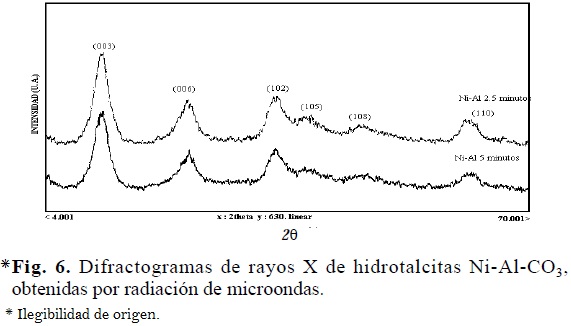
Al comparar los difractogramas de las hidrotalcitas preparadas por radiación de microondas, con los correspondientes a los obtenidos de la preparación por tratamiento térmico convencional, se observa que la cristalinidad de los precursores tipo hidrotalcita: Al-Mg y Cu-Mg-Al es independiente del método usado para su obtención. Por el contrario, en los compuestos Ni-Al, se observó una disminución de la cristalinidad, al incrementar el tiempo de exposición a la radiación; éste mismo efecto ocurre en el caso de los compuestos Co-Al pero de manera más significativa (Figs. 5, 6, 7 y 8).
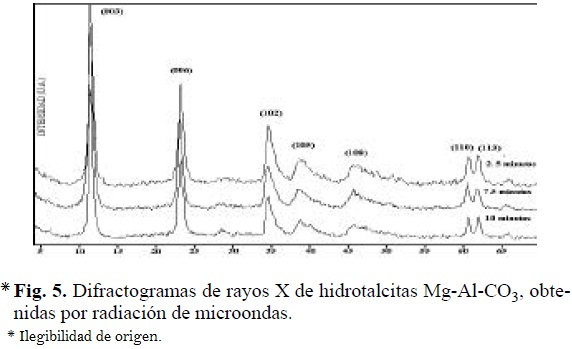

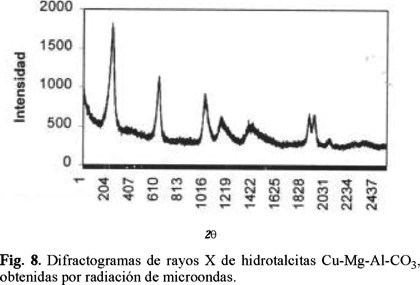
En los compuestos de Cu-Mg-Al (0.0079 mol y 0.0158 mol de Cu2+) sintetizados por microondas, los difractogramas resultaron prácticamente idénticos, siguiendo ambos compuestos el patrón correspondiente a compuestos laminares de estructura tipo hidrotalcita.
Se determinaron los parámetros de red a y c de la celda unitaria de las hidrotalcitas Mg-Al-CO3 obtenidas por radiación de microondas a partir de las reflexiones (110) y (006), respectivamente, utilizando α-alúmina como patrón interno. Los resultados se presentan en la Tabla 1.

Los resultados obtenidos para los parámetros de red corresponden a los reportados en la referencia 22-700, para la hidrotalcita sintética de acuerdo al patrón del JCPDS (Joint Committee on Powder Diffraction Standards).
Espectroscopía IR. Debido a que todas las hidrotalcitas sintetizadas presentan el mismo comportamiento frente a la radiación infrarroja, a manera de ejemplo (Fig. 9) se muestran los espectros de absorción infrarroja de los compuestos de Mg-Al, obtenidos tanto por el método convencional, como por el de microondas.
Se puede observar la presencia de las bandas de absorción características de compuestos tipo hidrotalcita:
— Alrededor de 3450 cm−1 atribuida al estiramiento de los grupos OH presentes en las láminas tipo brucita.
— Alrededor de 1640 cm−1 atribuida al modo de torsión de los grupos OH.
— Alrededor de 1370 cm−1 atribuida al estiramiento del CO32−, localizado en la región interlaminar.
En la región correspondiente a 800-400 cm−1 se observan vibraciones de estiramiento y flexión de red tipo M(II)-O-M(III); y de estiramiento M-O.
A medida que se incrementa el tiempo de irradiación se observa más definida la absorción débil alrededor de 3050 cm−1 atribuida al enlace de hidrógeno entre las moléculas de agua de la región laminar y los iones carbonato.
Análisis termogravimétrico. En todos los casos la estabilidad térmica de las hidrotalcitas presenta el mismo comportamiento, independientemente del método utilizado en su preparación, a manera de ejemplo se muestran los termogramas de la hidrotalcita Ni-Al-CO3 preparada por el método convencional y por radiación de microondas (Figs. 10, 11, 12).
Se observan dos pérdidas de peso, la primera debida a la eliminación de agua interlaminar y la segunda corresponde a la deshidroxilación de las láminas tipo brucita así como a la descomposición del carbonato en forma de CO2.
BET. Al analizar los valores de área superficial se observa que en los compuestos Mg-Al obtenidos por el método convencional, el valor de éste parámetro es mayor que el de los correspondientes a compuestos sintetizados por radiación de microondas, el tamaño de cristal se incrementa al aumentar el tiempo de radiación y se observa una disminución en el valor del área superficial, Tabla 2.

Actividad catalítica. Las hidrotalcitas fueron calcinadas con el objeto de obtener los sistemas, cuya actividad se evaluó primeramente en la reacción de apertura del óxido de estireno con cianuro de trimetilsilano (TMSCN).
La reacción de apertura del óxido de estireno con TMSCN primeramente se lleva a cabo sin catalizador durante 4 h, al cabo de éste tiempo, el cromatograma con los correspondientes espectros de masas de cada uno de los picos del producto de reacción, indica solamente la presencia de materia prima sin reaccionar, [MH+] = 191, que corresponde al óxido de estireno. Cuando la reacción se lleva a cabo en presencia de la hidrotalcita calcinada de Al-Mg (preparada ya sea por el método clásico o por microondas), se observa que la reacción es completa después de 4 h. En el cromatograma de gases, se observa la ausencia del pico correspondiente al óxido de estireno, y la aparición de un nuevo pico que corresponde al compuesto 3 (la reacción es regioselectiva), [M+41]+ = 260, [MH+] = 220, [M-CH3]+ = 204, [M-CH2CN]+ = 179; alcanzando un rendimiento de aproximadamente 70 % de éste producto.
En base a estos resultados, que indicaban una mayor actividad de las hidrotalcitas de Mg-Al y Cu-Mg-Al (Tabla 3), y a los obtenidos de la caracterización de las mismas, se optó por utilizar el sistema (Mg-Al) en la reacción de apertura del mismo epóxido, pero ahora con pirrolidina; es importante mencionar que ambas reacciones se realizaron a temperatura ambiente.

En el caso de la reacción de óxido de estireno con pirrolidina, se evaluó el producto de reacción por RMN1H; la reacción fué incompleta, se observan las señales características del producto de partida, óxido de estireno 1 δ 2.8 (dd, 1H, CHAHBO) y de los dos regioisómeros obtenidos: δ 4.65 (1H, dd, J=3.3, 10.6 Hz, PhCHOH) para 4 y δ 3.44 (1H, t, J=5.9 Hz, PhCHN) para 5. La relación de productos (70:30) es la misma que se obtiene cuando se lleva a cabo la reacción en metanol y a reflujo [13]. Esto significa que cuando se utiliza la hidrotalcita calcinada Mg-Al, ésta no actúa como catalizador, sino como adsorbente de impurezas, ya que la reacción es más limpia.
Parte experimental
Caracterización de hidrotalcitas. RX: La identificación de la estructura cristalina de los compuestos obtenidos fue realizada mediante análisis de difracción de rayos X (método de polvos) utilizando un difractómetro marca Siemens con radiación monocromática CuKα en un intervalo de 2ϑ de 4 a 70°. IR: La obtención de los espectros de infrarrojo fue a partir de pastillas que contenían 1 % en peso del compuesto en KBr. Los espectros se obtuvieron en un espectrofotómetro Nicolet Magna 750 con transformada de Fourier (FT-IR). BET: La determinación de las áreas superficiales se realizó a una temperatura de 75.25 K en un equipo volumétrico de adsorción Micromeritics ASAP 2000. TG: Los análisis termogravimétricos se hicieron en una termobalanza 951 Dupont utilizando He como gas de arrastre y una velocidad de calentamiento de 10 °C/min.
Síntesis de hidrotalcitas
Procedimiento general para la preparación de las hidrotalcitas por el método convencional. Varias hidrotalcitas fueron preparados siguiendo el método empleado por Riechle37. Un ejemplo típico es la preparación de la hidrotalcita Mg-Al-CO3. Una solución de 25.6 g de Mg(NO3)2.6H2O (0.1 mol) y 18.75 g de Al(NO3)3.9H2O (0.05 mol) en 70 mL de agua destilada fue adicionada a una solución acuosa de 28 g, 50% peso de NaOH (0.35 mol) y 10g de Na2CO3 anhidro (0.0943 mol) en 100 mL de agua destilada. La adición se efectuó en un matraz con agitación magnética, mediante un embudo de adición y en un baño de aceite. La adición se realizó en 4 h con agitación vigorosa. La temperatura se mantuvo a 35 °C. Al término de la adición, se obtiene un gel blanco, el contenido del matraz es tratado de la siguiente manera: para el tratamiento térmico es colocado en un autoclave a 65 °C por 18 h con agitación a presión autógena, esto permite que el precipitado amorfo se cristalice. Al término del calentamiento, se deja enfriar hasta temperatura ambiente, se efectúan lavados con H2O destilada hasta pH ≈ 9. El compuesto se seca a 100 °C durante la noche, se obtiene un polvo de color blanco.
En la síntesis de los compuestos Ni-Al, se emplearon 0.1 mol de Ni(NO3)2.6H2O, al final del secado se obtuvo un sólido verde; en la síntesis de los compuestos Co-Al, se emplearon 0.1 mol de Co(NO3)2.6H2O, al final del secado se obtuvo un sólido de color rosa; en la síntesis de los compuestos Cu-Mg-Al se emplearon: a) 0.0079 mol de Cu(NO3)2.2.5H2O, 0.1 mol de Mg(NO3)2.6H2O y 0.04 mol de Al(NO3)3. 9H2O, al final del secado se obtuvo un sólido de color azul; b) 0.0158 mol de Cu(NO3)2.2.5H2O, 0.1mol de Mg(NO3)2.6H2O y 0.02 mol de Al(NO3)3 .9H20, al final del secado se obtuvo un sólido de color azul intenso. La cantidad de Al(NO3)3.9H20 utilizada para la preparación de los compuestos NI-Al y Co-Al fue la misma que para el compuesto Mg-Al; en todos los casos, se usaron las mismas cantidades de NaOH y Na2CO3. A diferencia de los compuestos Mg-Al, el proceso de coprecipitación de éstos compuestos se efectuó a temperatura ambiente, pero las condiciones de tratamiento térmico, pH y secado fueron las mismas.
Procedimiento general para la preparación de hidrotalcitas por radiación de microondas. Las hidrotalcitas obtenidas por el método tradicional, fueron ahora preparadas por radiación de microondas. Se colocaron 50 mL del gel obtenido mediante la coprecipitación, en un tubo con tapa de rosca y se procede a su iradiación en un horno de microondas doméstico. Se prepararon cuatro muestras, se irradiaron durante 2,5, 5, 7.5 y 10 minutos respectivamente a 90 W de potencia, en un horno de microondas SHARP doméstico a 2.45 GHz. Se dejan enfriar las muestras y se lavan con H2O destilada hasta pH ≈ 9. Los compuestos se secan a 100 °C durante una noche, se obtienen sólidos con coloraciones iguales a los obtenidos por el método convencional.
Activación de las hidrotalcitas
Obtención de catalizadores. Los catalizadores se obtuvieron por calcinación de las hidrotalcitas. Se colocó 1 g del precursor en el horno, a una velocidad de calentamiento de 2 °C / min hasta una temperatura de 500 °C, ésta temperatura se mantiene por 2 h bajo un flujo de aire de 200 mL / min. En los compuestos de Mg-Al-CO3 después de la calcinación se obtiene un sólido blanco; en los compuestos de Ni-Al-CO3 después de la calcinación se obtiene un sólido verde obscuro; después de la calcinación de los compuestos de Co-Al-CO3 se obtienen sólidos negros y en los compuestos de Cu-Mg-Al-CO3 (0.0079 mol de Cu2+) después de la calcinación se obtiene un sólido verde, mientras que para los compuestos de Cu-Mg-Al-CO3 (0.0158 mol de Cu2+) después de la calcinación, la coloración de los sólidos obtenidos es verde y en algunos casos gris obscuro.
Evaluación de la actividad catalítica
Para evaluar la actividad catalítica de las hidrotalcitas en las reacciones del óxido de estireno con cianotrimetilsilano, se empleó un cromatógrafo Hewlett Packard 5890 con detector de masas 5972 y en las reacciones con pirrolidina un espectrofotómetro de resonancia magnética nuclear de protones analítico Varian Gemini FT-200A a 200 MHz y Varian Unity a 300 MHz, usando tetrametilsilano (TMS) como referencia interna. El desplazamiento químico (δ) esta dado en ppm. La terminología empleada es la siguiente: s, señal simple; d, señal doble; t, señal triple; c, señal cuádruple; dd, señal doble de doble, cd, señal cuádruple doble; m, multiplete. El disolvente empleado fué cloroformo deuterado (CDCl3).
Evaluación de la actividad catalítica de la hidrotalcita en la reacción del óxido de estireno con cianotrimetilsilano. En una matraz de bola se colocaron 200 mg de hidrotalcita calcinada de (previamente secada bajo vacío a 120 °C, durante 1 hora), 5 mL de n-heptano anhidro, 255 µL de óxido de estireno (120 g / mol, 0.1 mol) y 400 µL de cianotrimetilsilano (TMSCN) (99 g / mol, 0.15 mol) a temperatura ambiente en atmósfera inerte. El crudo de reacción se analizó mediante cromatografía de gases con detector de masas (ionización química).
Evaluación de la actividad catalítica de la hidrotalcita en la reacción del óxido de estireno con pirrolidina. En un matraz de bola se colocaron 100 mg de hidrotalcita calcinada de Mg-Al (previamente secada en vacío a 120 °C, durante 1 h) y 1 mL de acetonitrilo, posteriormente se adicionaron 0.23 mL de óxido de estireno (2 mmol) y 0.17 mL de pirrolidina (2 mmol). La reacción se agita durante 4 h a temperatura ambiente bajo atmósfera inerte. El sólido se separa por filtración, y el filtrado se evapora a sequedad a presión reducida. El crudo de la reacción se analizó mediante RMN1H.
Conclusiones
1. De los espectros de infrarrojo y de los análisis de rayos X, se demostró que los compuestos preparados por el método convencional y el de microondas poseen estructura laminar tipo hidrotalcita.
2. Se observó que los compuestos de Mg-Al-CO3 y los de Cu-Mg-Al-CO3 obtenidos por el método de radiación de microondas, presentan características similares a los compuestos de igual composición obtenidos por el método convencional.
3. Los compuestos Mg-Al-CO3 presentan mayor cristalinidad que las otras hidrotalcitas preparadas, esto ocurre tanto en compuestos obtenidos por el método convencional, como en los sintetizados por radiación de microondas.
4. Aunque el compuesto Mg-Al-CO3 preparado convencionalmente presenta área superficial ligeramente menor a la de la hidrotalcita obtenida por microondas (2.5 min), es importante resaltar la similitud de ambos compuestos, considerando la ventaja del corto tiempo de síntesis que proporciona la técnica de microondas. Por otra parte, la comparación de las hidrotalcitas sintetizadas por microondas, demuestra que ocurre una disminución del área superficial al incrementar el tiempo de radiación, debido al aumento del tamaño de cristal.
5. La estabilidad térmica de los compuestos obtenidos por ambas metodologías, son similares.
6. Los resultados de la actividad catalítica de los compuestos de Mg-Al, sintetizados por ambas metodologías, indican que la conversión del epóxido en la reacción de apertura del óxido de estireno con cianotrimetilsilano, es la misma en ambos casos (100%). Los compuestos de Cu-Mg-Al con baja concentración de Cu2+, obtenidos por el método convencional y por irradiación de microondas durante 2.5 minutos también presentaron la máxima conversión del epóxido, pero una selectividad menor a la de los compuestos de Mg-Al. Estos compuestos (Mg-Al y Cu-Mg-Al) poseen las características de basicidad adecuadas, que favorecen a la obtención de los productos de la reacción de cianosililación del óxido de estireno.
7. Los precursores catalíticos de Mg-Al obtenidos por el método convencional o por radiación de microondas, previa calcinación, no aceleran significativamente la velocidad de reacción de la pirrolidina con el óxido de estireno, aunque es importante mencionar que la reacción es mucho más limpia, lo cual demuestra claramente, que las hidrotalcitas actúan como adsorbentes de impurezas.
8. Los resultados obtenidos fueron alentadores, por tanto nos inducen a continuar la investigación sobre el comportamiento catalítico de compuestos tipo hidrotalcita preparados por el método de microondas, ya que la síntesis de hidrotalcitas por ésta vía, reduce el tiempo y condiciones de temperatura de calentamiento en la síntesis.
Agradecimientos
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (Proyecto E9506-0608) por su apoyo financiero, al Dr. Antonio de Ita de la Torre y a la Ing. Liz Georgina Flores Díaz por su colaboración en la realización de los análisis DRX.
Referencias
1. Manasse, E.; Toscana A. Nat. Proc. Verb. 1915, 24, 92-93. [ Links ]
2. a) Craven, E. G. J. Appl. Chem. 1963, 13; 71-72. [ Links ] b) Climent, M. J.; Corma, A.; Iborra, S.; Primo, J. J. Catal. 1995, 151, 60-66. [ Links ] c) Tichit, D.; Lhouty, M. H.; Guida, A.; Cliché, B.; Figueras, F.; Bartalini, A.; Garrone, E. J. Cat. 1995, 151, 50-59. [ Links ] d) Guida, A.; Lhouty, M. H.; Tichit, D.; Figueras, F.; Geneste, P. Appl. Catal. 1997, 164, 251-264. [ Links ]
3. Rocker, W.; Dethlefse, W.; Kaempfer, L.; Marosi, M.; Scharzmann, B.; Zirker, G. German Patent 2,255,990 1972, to BASF AG. [ Links ]
4. a) Monzón, A.; Romeo, E.; Arroyo, C.; Trujillano, R.; Labajos, F. M.; Rives, V. Appl. Cat. 1999, 185, 53-63. [ Links ] b) Kaizheng, Z.; Chibiao, L.; Xingkai, Y.; Yue, Wu. Appl. Cat. A: General, 1998, 168, 365-372. [ Links ]
5. a) Kazuya, Y.; Kohki, E.; Kiyotomi, K. J. Org. Chem. 1999, 64, 2966-2968. [ Links ] b) Ueno, S.; Yamaguchi, K.; Yoshida, K.; Ebitani, K.; Kaneda, K. Chem. Commun. 1998, 295-296. [ Links ] c) Kaneda, K.; Yamashita, T.; Matsuhita, T.; Ebitani, K. J. Org. Chem. 1998, 63, 1750-1751. [ Links ] d) Yumin, L.Shetian, L.; Kaisheng, Z.; Xingkai, Y.; Yue, W. Appl. Cat. A: General, 1998, 169, 127-135. [ Links ]
6. Mullre-Tamn, H.; Frielingsdorf, H.; Scheweier, G.; Reuter, L. German Patent 2, 163, 851-852 1973, to BASG AG. [ Links ]
7. a) Reichle, W. T.; Kang, S. Y.; Everhardt, D. S. J. Cat., 1986 , 101, 352-359. [ Links ] b) Drezdson, M. A. Inorg. Chem. 1988, 27, 4628. [ Links ] c) Cavani, F.; Trifiró, F.; Vaccari, A. Catal. Today. 1991, 11, 173-301. [ Links ]
8. Figueras, F.; Tichit, D.; Bennani, M.; Ruiz, R. Catalysis of Organic Reactions. Edited by Frank E. Henkes. 1998, 37-49. [ Links ]
9. Lomas, L.; Azcue, L.; Negrón, G; Flores, J.; Clément. R. Rev. Soc. Quím. Méx., 2000, 112-115. [ Links ]
10. Fetter, G.; Hernández, F.; Maubert, A. M.; Lara, V. H., Bosh, P. Journal of Porous Materials, 1997, 4, 27-30. [ Links ]
11. Choudary, B. M.; Narender, N.; Bhuma, V. Synth. Commun. 1995, 25(18), 2829-2836. [ Links ]
12. Beaulieu, P.; Anderson, P.; Cameron, D.; Croteau, G.; Gorys, V.; Grand-Mâitre, C.; Lamarre, D.; Liard, F.; Paris, W.; Plamondon, J.; Soucy, F.; Thibeault, D. J. Med. Chem. 2000, 43, 1094-1108 y referencias citadas. [ Links ]
13. O'Brien, P.; Poumellec, P. Tet. Lett. 1996, 37, 5619-5622. [ Links ]














