Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química de México
versão impressa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.3 Ciudad de México Jul./Set. 2000
Comunicación Técnica
Efecto de iones y otros factores físicos sobre la germinación de semillas
Ruth Román Palacios
Departamento de Bioquímica, Facultad de Química, Edificio E, Universidad Nacional Autónoma de México, Ciudad Universitaria, México 04510, D.F. Tel: (52)5622-5335.
Recibido el 15 de marzo de 2000.
Aceptado el 26 de abril del 2000.
Resumen
El bioensayo de germinación se ha convertido en una herramienta útil para el estudio de otros parámetros en Bioquímica Vegetal, por lo cual debe ser optimizado cuidadosamente. Algunas sales producen efectos inhibitorios en la germinación por ello sus cantidades deben controlarse cuidadosamente. Otros factores que influyen para la germinación como volumen, luz, tiempo de imbibición, tamaño de las semillas, varían conforme a la especie de semilla elegida. Se describen las condiciones óptimas de germinación para maíz, trigo y ajonjolí.
Palabras clave: Bioensayo, germinación, semillas, sales.
Abstract
Germination bioassay has become a useful tool for study of other parameters in Plant Biochemistry research. This bioassay must be carefully optimized before its use in plant research. Some salts are inhibitors of germination and the exact amount of them must be controlled. Other factors like volume, light, imbibition time and seed size are different for each kind of seed. Optimal conditions for best germination of maize, wheat and sesame seeds were determinated.
Key words: Bioessay, germination, seeds, salts.
Introducción
La germinación de semillas empieza con la toma de agua por la semilla (imbibición) y finaliza con el inicio de la elongación del eje embrionario, principalmente la radícula.
Diferentes fisiólogos vegetales están de acuerdo en que una semilla ha germinado cuando la radícula [1,2] protruye a través de su cubierta exterior [1]. Por lo tanto incluye numerosos eventos, por ejemplo, hidratación de proteínas, cambios de estructuras subcelulares, respiración, síntesis de macromoléculas y alargamiento de células, ninguno de los cuales por sí mismo determina la germinación. Pero sus efectos combinados transforman un embrión en reposo y deshidratado, con metabolismo apenas detectable, en uno que tiene un metabolismo vigoroso que culmina en el crecimiento. La germinación no incluye el crecimiento de la plántula el cual comienza cuando la germinación finaliza [1].
El primer proceso que ocurre en la germinación es la toma de agua por la semilla lo que se denomina imbibición [1b, 3].
La cantidad total de agua y/o solutos tomada durante la imbibición es generalmente muy pequeña y no puede exceder de dos a tres veces el peso seco de la semilla. La imbibición depende de varios factores como el movimiento del agua hacia la semilla, en donde el potencial de agua y la permeabilidad de la cubierta de la semilla son factores de mayor importancia [9].
Estos dos procesos (germinación e imbibición) pueden ser separados fisiológicamente, porque en el primer proceso (lo que es propiamente germinación) la semilla puede ser desechada y sobrevive, en cambio durante el segundo proceso (posgerminación o protrucción de la radícula) si la semilla es deshidratada muere [2].
El potencial de agua (ψ) es una expresión del estado de energía del agua. La difusión neta del agua ocurre bajo un gradiente de energía de un potencial alto a uno bajo (por ejemplo: desde el agua pura hacia el agua que contiene solutos)
El agua no es la única substancia que puede entrar a la semilla durante la imbibición; bajo condiciones experimentales (o en el suelo) las semillas pueden ser expuestas a una solución más que a agua pura. Los solutos entran a la semilla así como el agua [3,9].
Otros factores que pueden jugar un papel importante en la imbibición son la estructura y composición de la semilla los cuales van a determinar la permeabilidad de la cubierta de la semilla y la disponibilidad de agua en forma líquida o vapor en el medio ambiente [1b, 2 y 4].
El principal componente que imbibe agua es la proteína. Sin embargo, otros componentes también contribuyen al hinchamiento así como parte de la celulosa y sustancias pécticas. El almidón contribuye en menor medida al hinchamiento total de la semilla aún cuando grandes cantidades de él estén presentes [7,10,11].
Resumiendo hay varios factores que afectan la imbibición y consecuentemente la germinación: agua, gases, iones, temperatura, luz e inhibidores.
En este trabajo se estudia, en primer término, el efecto de sales en la germinación de semillas. Asimismo se determinarán el volumen óptimo de solución requerido, la proporción idónea entre el número de semillas y el recipiente que las contenga, las condiciones adecuadas de luz y tiempo de imbibición para lograr el más alto porcentaje de germinación en semillas de diferente tamaño y especie: maíz, trigo y ajonjolí.
Resultados
Lo que primero se determinó fueron las condiciones primarias para el bioensayo de germinación. Se varió el volumen, número de semillas por contenedor así como el número de horas de imbibición necesarias para tener el más alto porcentaje de germinación. El control fue agua destilada y desionizada.
Se eligieron semillas de tres especies con diferente tamaño, y se determinaron, primero, las condiciones para maíz como se muestra en la Tabla 1 y posteriormente estos resultados se aplicaron a las otras semillas.
El control dio 93% de germinación para maíz usando una caja Petri de 9 cm de diámetro, 10 semillas con un volumen y tiempo fijos (de 10 ml y 72 h respectivamente).
En la Tabla 1 se puede observar que 100 mM de KOAc o 100 mM de KCl bajan el porcentaje de germinación a 89 y 83% respectivamente. Se hicieron mezclas de estas dos soluciones para determinar cuál era más inhibitoria si la de acetato o la de cloruro. La solución 50-50 mantuvo baja la germinación en un nivel intermedio 86% por lo que se buscó una relación de sales con un contenido más alto de acetato. La solución 70-30 (KOAc y KCl) resultó igual que la anterior mientras que la relación 80-20 (más acetato que cloruro) dio 92% de germinación. La relación 0-20 bajó, como se esperaba, el porcentaje de germinación (70%). De estos experimentos se concluye que el ión cloruro es más inhibitorio que el acetato.
En este bioensayo la presencia de las 2 sales y una molaridad mínima de 100 mM entre las dos propició una buena germinación (92%).
Se decidió aumentar el número de semillas a 25 por caja Petri (y cuatro cajas por ensayo) manteniendo el volumen (10 mL), y la relación 80-20 mM dando el 92% de germinación.
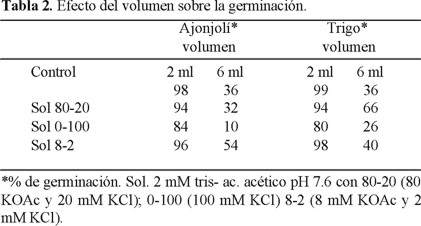
Como se observa en la tabla 1 se probaron semillas de trigo y ajonjolí, las cuales, como se sabe, son más pequeñas. Se colocaron 25 semillas de cada especie en un volumen de solución menor de acuerdo al contenedor (se usó un recipiente de aproximadamente 5 cm de diámetro (frasco Gerber) con 2 mL de solución y 6 mL cuando se utilizó caja Petri). La relación de sales 80-20 y 2 ml de volumen dieron para trigo 92 y para ajonjolí 94% de germinación. En este ensayo el tiempo para germinar de 96 h resultó demasiado, mientras que 48 h fueron suficientes. Trigo (Tabla 1) solución 80-20 y 2 ml de volumen dio 92% mientras que ajonjolí 94% contra controles de 98 y 99%, respectivamente.
Como el volumen de imbibición para las semillas pequeñas no había sido determinado con precisión se compararon nuevamente 2 mL y 6 mL, en frasco Gerber como se puede ver en la tabla 2, con las soluciones más favorables para la germinación, cuyos valores se mostraron en la tabla 1. El control con 2 mL dio 98 y 99% de germinación para ajonjolí y trigo respectivamente. Cuando se adicionaron 6 mL de volumen resultó muy alto, ya que las semillas prácticamente eran cubiertas por completo evitando su respiración y bajando notablemente la germinación (36%) para ambas semillas. Mientras que 2 mL de la solución 80-20 dio un 94% de germinación para ambas semillas, la solución 0-100 (KCl) mostró nuevamente que inhibe 84 y 80% siendo más Notable con 6 mL dando 10 y 26% respectivamente para ajonjolí y trigo. La solución 8-2, 2 mL de volumen y 25 semillas, se comporta como el control dando 96 y 98% de germinación. Se concluye que para las necesidades del bioensayo la relación 80-20, 2 mL de volumen y 25 semillas son condiciones adecuadas para ajonjolí y trigo.
En la Tabla 3 se observa la variación del tiempo de germinación y se encontró, como ya se mencionó, que 48 h eran mejores para las semillas pequeñas. Pero como no se conocía si estas semillas germinasen en lapsos más cortos, se escogieron 24 y 48 h para el bioensayo de ajonjolí y trigo y para el maíz se programaron períodos de 48 y 72 h, manteniendo 25 semillas en cada caso, 2 mL para ajonjolí y trigo y 10 mL para maíz.
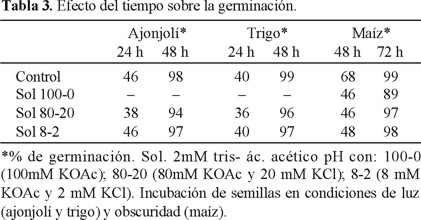
El porcentaje de germinación en agua (control) para ajonjolí y trigo fue de 98 y 99% a las 48 h mismo que se redujo aproximadamente a la mitad a las 24 h. La solución 80-20 dio 94 y 96% de germinación para ajonjolí y trigo. Maíz por el contrario dio el máximo de germinación a las 72 h: 99% el control y solución 80-20 97%.
En este experimento las semillas de maíz se destaparon y taparon, por lo que se diseñó un experimento que evitara esta variación y los resultados se pueden ver en la en la Tabla 4. Esta Tabla también presenta el efecto de la luz en las semillas de ajonjolí y trigo para las cuales se encontró que dieron buena germinación en 48 h con periodos de oscuridad ó luz, la diferencia es poca o nula. En cambio, el maíz baja su porcentaje de germinación con luz continua, por lo que requiere 72 h de oscuridad continua y en esas condiciones alcanza 97% de germinación en presencia de sales (80-20).
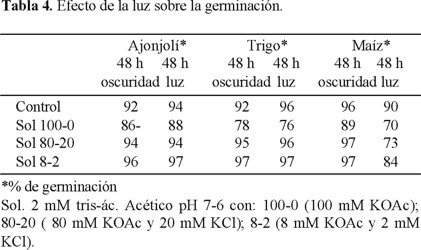
Todos estos datos corresponden para el lote de semillas que teníamos en ese tiempo. Cada experimento de 25 semillas es el promedio de 4 cajas Petri o 4 frascos Gerber. Es decir, 25 semillas da un total de 100 semillas en cada ensayo.
Resumen de resultados
Los iones cloruros resultaron más inhibitorios que los iones acetatos. Sin embargo la mezcla de ellos en proporción favorable a los acetatos puede ser usada para un bioensayo. Aunque la molaridad sea tan alta como 100 mM.
Semillas de maíz. Soluciones 80-20 y 8-2 dieron 92 y 93% de germinación con un total óptimo de volumen de 10 mL en caja Petri (25 semillas) y 72 h de oscuridad.
Semillas de trigo. Soluciones 80-20 y 8-2 dieron 92 y 97% de germinación, con un óptimo de volumen de 2 mL, en frasco Gerber (25 semillas) y periodos de luz y oscuridad durante 48 h.
Semillas de ajonjolí. soluciones 80-20 y 8-2 dieron 94 y 97% de germinación, con un óptimo de volumen de 2 mL, en frasco Gerber (25 semillas) ) y periodos de luz y oscuridad durante 48 h. Todos los experimentos representan el promedio de 100 semillas.
Discusión
El efecto de los iones, tiempo, volumen y luz sobre la germinación de semillas así como su tamaño deben ser tomados en cuenta si se está preparando un bioensayo de germinación para probar otros parámetros experimentales.
En este bioensayo se buscaron las condiciones de 80 mM de acetato de potasio y 20 mM de cloruro de potasio con 2 mM tris pH 7.6 porque estábamos por probar un inhibidor de la germinación natural y soluble bajo esas condiciones.
Otros parámetros experimentales que podrían ser medidos por este bioensayo son inhibidores de la germinación de compuestos sintéticos y/o naturales. Inhibidores conocidos como el ácido abscísico [3] ácido lunulárico [8] ácido jasmónico [10] y batatasina I [5] entre otros. Mientras que citocininas [3] giberelinas [3] que son conocidos activadores se miden en bioensayos ya establecidos.
Al jasmonato de metilo no sólo se le conoce como inhibidor presente en la dormancia sino que puede inducir la expresión de genes de enzimas involucradas en la producción de etileno en cuyo caso actuaría indirectamente como acti-vador [12].
El hecho de que los iones cloruros sean más inhibitorios que los acetatos sobre la germinación de semillas, recuerda el que generalmente procesos in vitro de plantas como es la síntesis de proteínas también es más activa en presencia de iones acetatos siendo los cloruros tremendamente inhibitorios [4]. Sin embargo, la síntesis de proteínas in vitro de sistemas de animales no muestran tanta inhibición [5].
Es recomendable determinar el efecto iónico sobre el bioensayo que se trabaje ya que aunque sea la misma semilla puede cambiar de lote a lote o bien cambiar por el almacenamiento, siendo necesario optimizar el bioensayo cuando se vaya a utilizar de acuerdo a los parámetros mencionados.
Parte experimental
Bioensayo con diferentes semillas.
Prueba de germinación para semillas de maíz (Zea mays).
Las semillas de maíz se lavan con una solución de cloralex al 5% v/v durante 10 min. Después se lavan con agua desionizada estéril 4 veces (500 ml en cada ocasión). Se secan con papel estéril. Se colocan 25 semillas sobre papel filtro estéril dentro de una caja de Petri de 9 cm de diámetro previamente esterilizada. Se agregan 10 mL de la solución a probar el efecto sobre la germinación y se comparan contra un control de agua pura desionizada. El criterio de germinación utilizado fue la protución de radícula de la semilla de maíz.
Prueba de germinación para semillas de trigo (Triticum aestivum) y semillas de ajonjolí (Sesamun indicum). Las semillas de trigo y ajonjolí se lavan con agua desionizada estéril 2 veces (250 mL en cada ocasión). Se secan con papel estéril y se distribuyen sobre papel estéril alrededor de 10 min cerca del mechero Bunsen con el fin de secarlas.
Se colocan 25 semillas sobre un papel filtro seco estéril colocado en el fondo de un frasco Gerber también estéril, se cuida que las semillas queden separadas unas de otras. Se agregan 2 mL de la solución a probar el efecto sobre la germinación y se tapan con papel aluminio estéril. Después de 48 h bajo condiciones de: luz 12 h seguidas de 12 h en oscuridad a temperatura de 26 ºC, se cuenta el número de semillas germinadas contra un control de agua teniendo como criterio la protución de la radícula.
Las soluciones que se probaron y que proporcionan los iones fueron las siguientes:
100-0 (100 mM KOAc)
0-100 (100 mM KCl)
50-50 (50 mM KOAc y 50 mM KCl)
70-30 (70 mM KOAc y 30 mM KCl)
0-20 (20 mM KCl)
80-20 (80 mM KOAc y 20 mM KCl
8-2 (8 mM KOAc y 2 mM KCl)
Todas las soluciones contenían además 2 mM Tris-acetato pH 7.6 para mantener el mismo pH. Todos los experimentos representan el promedio de 100 semillas en cada caso.
Referencias
1. (a) Bewley, J. D.; Black, M. Seed Physiology of Development and Germination. In: Germination Structure and Composition, Ed. Plenum Press, New York, 1985,1-27; [ Links ] (b) Storage, Imbibition and Germination, 1985, 89-133. [ Links ]
2. Berrie, A.M.M. Germination and Dormancy. In: Advanced Plant Physiology, Ed. Wilkins. M. B. , Great Britain, 1984, 440-468. [ Links ]
3. (a) Clarkson, D.T. Ionic relations. In: Advanced Plant Physiology, Ed. Malcolm B. Wilkins Pitman Publishing Inc., Great Britain, 1984, 319-353. [ Links ] (b) Ibid. Abscisic Acid, 1984, 78-9. (c) Ibid. Cytokinins 1984, 53-75. (d) Ibid. Gibberelins 1984, 2152.
4. Giesen, M.; Román, R.; Seal, S.N.; Marcus, A. J. Biol. Chem. 1976, 251, 6075-6081. [ Links ]
5. Letcher, R.M. Phytochemistry 1973, 12, 2789-2790. [ Links ]
6. Levin, D.H.; Kyner, D.; Acs, G. J. Biol. Chem., 1973, 248, 6416-6419. [ Links ]
7. Mayer, A.M.; Polja Koff-Mayber, A. The Germination of Seed, Ed. Pergamon Press, Oxford 1975, 21-45. [ Links ]
8. Pryce, R. J. N. Planta, 1976, 97, 354-357 [ Links ]
9. Simon, E.U. Early Events in Germination, en Seed Physiology Vol. III , Germination and Reserve Movilization, Ed. Morray, D.R. Academia Press, New York, 1984, 77-115. [ Links ]
10. Tran, V.N.; Cavanagh, A.K, Structural Aspects of Dormancy, In: Seed Physiology Vol II Germinations, and Reserve Movilization, Ed. Murray, D.R., Academic Press, New York. 1984, 1-43. [ Links ]
11. Veda, J.; Kato, J. Plant Physiol. 1980, 66, 246-249. [ Links ]
12. Watanabe T.; Sakai, S. Planta 1998, 206, 570-57. [ Links ]














