Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.3 Ciudad de México jul./sep. 2000
Investigación
Producción de vitamina B12 por Methanosarcina sp. utilizando metanol y acetato como fuente de carbono
Facundo J. Márquez Rocha
Centro de Investigación Científica y de Educación Superior de Ensenada, AP 2732, Ensenada 22830, B.C., México. Tel. (61) 745050; Fax: (61) 750534. E-mail: fmarquez@cicese.mx
Recibido el 8 de febrero del 2000.
Aceptado el 22 de junio del 2000.
Resumen
Se aislaron 2 cepas del género Methanosarcina con la capacidad de utilizar simultáneamente metanol y acetato como fuente de carbono. La velocidad máxima de producción de CH4 fue de 1.43 (cepa C1) y 1.30 mmol h−1 (cepa C2), a una concentración de acetato de 100 y 200 mM, respectivamente. La cepa C2 fue más resistente a concentraciones mayores de acetato (> 150 mM). Los rendimientos de CH4 para las cepas C1 y C2 fueron de 0.45 y 0.46 mmolCH4 mmolMOH−1, respectivamente. Ambas cepas rinden mayor producción de vitamina B12 extracelular a una concentración de acetato de 50-150 mM, aunque la cantidad en C2 (9 mg L−1h−1 ) es 1.8 veces más que en C1 (5 mg L−1 h−1).
Palabras clave: Vitamina B12, Methanosarcina, fuentes de carbono.
Abstract
Two strains of the genus Methanosarcina were isolated, both with the ability to utilize simultaneously acetate and methanol as carbon source. The maximum production rate of CH4 was 1.43 (strain C1) and 1.30 mmol h−1 (strain C2), under a concentration of 100 and 200 mM acetate, respectively. Strain C2 shown better resistance to high acetate concentration (> 150 mM). The yields of CH4 were 0.45 and 0.46 mmolCH4 mmolMOH−1, for the strains C1 and C2, respectively. The higher extra cellular production of vitamin B12 was achieved to an acetate concentration of 50-150 mM in both strains, but vitamin B12 amount was 1.8 times in C2 (9 mg L−1h−1) to that produced by C1 (5 mg L−1 h−1).
Key words: Vitamin B12, Methanosarcina, carbon source.
Introducción
La vitamina B12 no es sintetizada por los animales, por lo que dependen de la producción microbiana de su propia flora intestinal o de su presencia en la dieta. Esta vitamina, primeramente fue aislada del hígado de animales y después de biomasa de una digestión anaeróbica de desechos. La vitamina B12 pertenece a un grupo de estructuras similares al sistema porfirina, que solo cambia el tipo de metal unido. A todas estas estructuras se les conoce como tetrapirroles [1].
En la actualidad la vitamina B12 se produce extra e intracelularmente por fermentación, en procesos en lote y lote alimentado, ya que la síntesis química es muy difícil. Propionibacterium ha sido utilizado para la producción intracelular de esta vitamina; Sin embargo, éste microorganismo durante su fermentación excreta ácido acético y propiónico al medio de cultivo, lo que resulta en la inhibición de la ésta [2]. Para resolver este problema se puede usar un módulo de filtrado que elimine los ácidos del caldo de cultivo [3]. Sin embargo, no se ha tenido el éxito esperado al recircular el medio agotado a través de estos filtros [4].
Entre los metanógenos, el género Methanosarcina tiene la mayor versatilidad metabólica, es capaz de usar H2 / CO2, metanol, metilaminas y acetato como fuente de carbono [5]. Varios investigadores, como Krzycki y col. [6] han encontrado que cuando Methanosarcina se cultiva en un medio que contiene metanol y acetato, el metano génesis aumenta en comparación a cuando es cultivado con solo metanol.
M. barkeri variedad Fusaro cultivada en metanol como única fuente de carbono es un potente productor de vitamina B12 [7, 8] con algunas ventajas sobre los productores tradicionales, tales como, Propionibacterium sp. y Pseudomonas denitrificans [3]. Además, con la adición de acetato al medio con metanol, M. barkeri probablemente aumente su velocidad de crecimiento y consecuentemente pueda aumentar la productividad de B12. En comparación con las bacterias utilizadas comercialmente M. barkeri tiene algunas ventajas: I) es fácil de mantener en metanol, II) la vitamina B12 es excretada al medio, III) el metano no inhibe el crecimiento, IV) el metanol es relativamente barato [7]. Sin embargo, aún existen dudas respecto a la utilización de Methanosarcina, ya que aunque la vitamina B12 se excrete al medio, la excreción no es del 100%. Esto depende de las condiciones de cultivo, especialmente la fuente de carbono o las diferentes combinaciones del medio de cultivo [9]. Por eso es importante obtener nuevas cepas con mayor resistencia a altas concentraciones de acetato y un mayor rendimiento en la excreción de B12 al medio, utilizando metanol y acetato como fuente de carbono.
Material y métodos
Aislamiento, identificación y mantenimiento de microorganismo. Algunas cepas metano génicas fueron aisladas de un digestor anaerobio, alimentado con efluentes domésticos. La identificación a nivel de género fue realizada utilizando diferentes fuentes de carbono para la producción de metano [10]. Las cepas aisladas fueron mantenidas por transferencias frecuentes en medio basal con metanol (MeOH), como única fuente de carbono. El medio y los cultivos fueron manipulados en una atmósfera libre de oxígeno, utilizando nitrógeno gaseoso (pureza 99.999% v/v).
Medio de cultivo. La composición del medio de cultivo fue la siguiente (L−1 de agua desionizada): K2HPO4, 1.4 g; KH2PO4, 0.9 g; NH4CI, 0.5 g; MgSO4-7H2O, 1.0 g; CaCl-2H2O, 0.75 g; FeSO4-7H2O, 5.0 mg; NiCl2-6H2O, 0.17 mg; CoCl2-6H2O, 0.17 mg; cisteína-HCl-H2O, 0.3 g; solución de vitaminas, 5.0 ml; solución de elementos traza 18.0 ml y metanol, 8.0 g [7]. Los cultivos fueron crecidos en frascos para suero de 125 ml, con 60 ml de medio de cultivo (pH 6.0 ± 1). Los frascos fueron incubados a 37 °C sin agitación, inoculados con 5% (v/v) de la fase logarítmica tardía del crecimiento en medio mínimo con metanol.
Determinación de vitamina B12. La vitamina B12 extra e intracelular fue extraída con una solución amortiguadora de fosfatos 0.1 mmol l−1, KCN 0.01 %, pH 6.0. El extracto se pasa por una columna de Amberlita XAD-2 (2 × 20 cm). La vitamina fue eluida con metanol y KCN 0.01% (peso/volumen). La vitamina parcialmente purificada se paso por HPLC usando una columna Finepak SIL C18, Jasco. La elución se lleva a cabo con una mezcla de amortiguador (fosfatos 0.1 mmol l−1, ácido tartárico 0.04 mmol l−1): metanol: KCN (1%) (37:62:1), y su concentración se mido utilizando un detector UV a 365 nm. Para determinar la concentración en su forma diciano fue usado su coeficiente de extinción molar ε365 = 30.4 × 103 M−1 cm−1 [11]. Para la extracción de vitamina B12 intracelular, los microorganismos fueron tratados térmicamente en un amortiguador 0.1 N de fosfatos, 0.01 % KCN, pH 5.5 por 20 min a 100 °C [7].
Determinación de rendimientos y velocidades. Los valores obtenidos para las tasas de producción de metano, consumo de acetato y metanol fueron las medias de tres réplicas (con duplicados c/u). Los rendimientos de metano y células fueron la media de tres réplicas con sus respectivos duplicados de experimentos a 72 h de cultivo. Las velocidades de producción de CH4 y consumo de MOH fueron obtenidas por regresión logarítmica y el análisis estadístico utilizado fue un análisis de varianza ANVA en un programa estadístico SIGMA STAT 1.01.
Determinaciones analíticas. La concentración de CH4 fue determinada por un sistema de desplazamiento de líquido [7], después de pasar el gas producido por una solución saturada de cloruro de sodio. La composición del gas fue analizada por cromatografía de gases [12]. La concentración de acetato [AcO] fue medida utilizando una columna PEG 6000 (3.2 mm × 3.1 m) en un cromatógrafo de gases Shimazu GC-14A, equipado con un detector FID. La concentración de metanol [MeOH] fue medida utilizando una columna Poraopak QS (2.6 mm × 1.5 m) en un cromatógrafo de gases Shimazu GC-8A, equipado con un detector FID. El peso seco celular fue calculado a partir del contenido de proteína por el método de Bradford [13], después de la ruptura celular con 1 M NaOH [14], del cual fue obtenido un valor de 60 +/− 2% (g de proteína / g de biomasa en peso seco).
Resultados y discusión
Aislamiento e identificación de cepas. Las cepas aisladas y seleccionadas fueron clasificadas de acuerdo a su capacidad para producir metano (CH4) en diferentes fuentes de carbono [5]. Inicialmente fueron obtenidas 21 cepas metano génicas, de las cuales solo cinco resultaron puras. En la Tabla 1 se muestran las características cualitativas de utilización de la fuente de carbono para la producción de metano de las 5 cepas aisladas y seleccionadas, dos de las cuales fueron clasificadas en el género de Methanosarcina y se denominaron como C1 y C2. Estas cepas tienen la capacidad de utilizar H2 / CO2, metanol y acetato como fuente de carbono y energía. Aunque falto la prueba de la utilización de metilaminas, es altamente probable que realmente se trate del género Methanosarcina, ya que ningún otro género hasta ahora descrito utiliza estas fuentes de carbono [10]. La cepa C4 puede pertenecer a los géneros Methanobacterium, Methanobrevibacter, Methanoplanus, Methanococcus, Methanospirillum, Methanocorpusculum, Methanogenium. Sin embargo, por su crecimiento óptimo arriba de 60 °C puede pertenecer al género Methanococcus, esto podría quedar confirmado utilizando análisis de secuenciación de su rRNA 16S para identificación de género y especie [15]. Las C3 y C5 claramente pueden pertenecer al género Methanotrix sp. Este género utiliza principalmente acetato y algunas especies utilizan H2 / CO2 como fuente de carbono y energía. La presencia de metanógenos es muy importante en la digestión anaerobia debido a que previenen la acumulación de ácido acético en el medio. Los metanógenos son anaerobios obligados y requieren un potencial redox menor a −300 mV, razón por la cual su aislamiento se dificulta ya que se deben de tener condiciones completamente libres de oxígeno. Para el resto del trabajo las cepas C1 y C2 del género Methanosarcina fueron utilizadas.

Efecto de la adición de acetato como fuente simultánea de carbono en la producción de metano. Se midió la producción de metano a una concentración fija de metanol (250 mM) y concentraciones de 0, 50, 100, 150, 200 y 250 mM de acetato [AcO]. En la Fig. 1 se muestra la producción de metano para las cepas C1 y C2. En la Fig. 1a se observa que la producción mayor de CH4 para C1 fue a 100 mM de [AcO], mientras que para C2 fue entre 100-200 mM (Fig. 1b). Concentraciones mayores de 200 mM [AcO] causan inhibición de la fermentación en ambas cepas. La velocidad máxima de producción de CH4 calculada fue de 1.43 (C1) y 1.30 mmoles h−1 (C2), en presencia de 100 y 200 mM de [AcO], respectivamente. La producción de metano disminuye un 75% para C1 y aproximadamente un 50% para C2 a una concentración de 250 mM [AcO]. Los datos graficados son la media de tres réplicas sin diferencia significativa entre estas en todos los casos para cada una de las [AcO] (p < 0.05). La producción de metano en C1 fue significativamente mayor cuando fueron agregados 100 mM de [AcO] que para el resto de los ensayos. En cambio para C2 la producción máxima de metano fue al agregar entre 150-200 mM de [AcO] y significativamente diferente que para el resto de las concentraciones agregadas. El metano fue producido rápidamente por ambas cepas, con diferentes velocidades de producción a diferentes [AcO]. La velocidad más baja de producción de CH4 correspondió a 250 mM de [AcO] para ambas cepas. La importancia de los metanógenos puede radicar en su distribución en muchos sistemas naturales donde contribuyen en gran medida al metabolismo de compuestos orgánicos de 1 y 2 carbones como el CO2, formato y acetato [15]. En reactores anaerobios pueden en parte regular la fermentación al disminuir la acumulación de ácido acético, importante compuesto intermediario en la fermentación anaerobia.
Consumo de metanol a diferentes concentraciones de acetato. El metanol fue utilizado a diferentes velocidades, según la concentración de acetato. La cepa C1 consumió mayor cantidad de metanol a 100 mM de [AcO], (Fig. 2a) y C2 consumió mayor concentración de metanol entre 100 y 200 mM de [AcO] (Fig. 2b). La velocidad mayor de consumo de metanol para C1 fue de 3.68 mmol h−1, a 100 mM [AcO] y para C2 fue de 3.45 mmol h−1, a 150 mM [AcO], estos valores no representan diferencia significativa. Para C1 la velocidad de consumo de metanol a una [AcO] 100 mM fue significativamente mayor que para el resto de las concentraciones, mientras que para C2 la velocidad de consumo de metanol no fue significativamente diferente entre concentraciones de 100 - 200 mM [AcO]. Claramente se puede observar que las dos fuentes de carbono fueron utilizadas simultáneamente. Esto puede sugerir que la utilización de metanol y acetato tenga vías metabólicas comunes, lo cual concuerda con el proceso de metano génesis descrito por Nagai y Nishio [5].
Consumo de acetato. La utilización de [AcO] siguió el mismo patrón para ambos casos. C1 consumió mayor [AcO] a una concentración de este mismo de 100 mM (Fig. 3a), mientras que C2 hace lo mismo, sólo que a una [AcO] de 150 mM, (Fig. 3b), significativamente mayor que para el resto de las concentraciones [AcO]. Para ambas cepas se observa inhibición de la fermentación a una [AcO] de 250 mM. La cepa C2 es visiblemente más resistente a mayores [AcO]. Este fenómeno se debe únicamente a la fuente de carbono ya que, el pH se mantuvo constante. Grosskopf y col., [15] han caracterizado y aislado especies del género Methanosarcina utilizando acetato como fuente de carbono, para un medio selectivo.
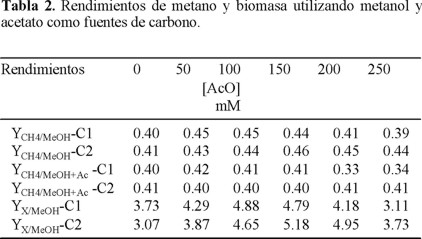
Rendimiento de biomasa y metano. El rendimiento de CH4 utilizando metanol y acetato como fuente de carbono (YCH4/(MeOH+AcO) ) fue de 0.40 ± 0.02 mmolCH4 mmol MeOH+AcO−1 para ambas cepas (Tabla 2). La diferencia en el rendimiento de CH4 no fue significativa para ninguna de las concentraciones de acetato probadas, excepto a una [AcO] de 200-250 mM para C1 y una concentración de 250 mM para C2, lo cual se atribuye a la inhibición de la fermentación. El mejor rendimiento de biomasa (YX/MeOH) para C1 alcanza 4.88 mg mmol−1 y para C2 fue de 5.18 mg mmol−1, a concentraciones de acetato de 100 y 150 mM respectivamente. El rendimiento de biomasa para C1 no fue significativamente diferente para [AcO] de 100-150 mM pero sí para el resto de las concentraciones. El rendimiento de biomasa para C2 no fue significativamente diferente para [AcO] de 150-200 mM pero sí para las otras concentraciones probadas, especialmente en ausencia de acetato (Cuadro 2). Estos resultados pueden sugerir que la formación de biomasa es aditiva cuando se utilizan dos fuentes de carbono que son simultáneamente asimiladas, hasta la concentración donde se empezó a observar la inhibición de la fermentación.
Producción de vitamina B12. La concentración de vitamina B12 se determinó en los cultivos con C1 y C2 a 72 h de cultivo, (Fig. 4). La concentración total mayor para C1 fue de 11 mg/g peso seco (Fig. 4a) y para C2 de 13 mg/g peso seco (Fig. 4b), utilizando metanol como única fuente de carbono, en ambas cepas. Al aumentar la concentración de acetato, la excreción en ambas cepas aumentó, aunque para C2 el aumento es significativamente mayor con respecto a C1. El aumento en la excreción se mantuvo proporcional en C2 aunque la concentración total disminuyo ligeramente al aumentar la concentración de acetato en el medio (Fig. 4b). Los cambios morfológicos observados pueden tener relación en la concentración extra e intracelular de la vitamina B12 posiblemente alterando la permeabilidad de la membrana. Fukuzaki y Nishio [18], sugieren que el metanol es convertido directamente en metano por Methanosarcina sp., y que estos metanógenos contiene cantidades considerables de corrinoide metiltransferasas y 5-hidroxibenzimidazolil cobamida (factor III), sugiriendo que por esta razón en presencia de otra fuente de carbono como acetato, Metahosarcina sp utilice más eficientemente esta vía y producir mayor cantidad de B12. En ambas cepas la concentración de vitamina B12 fue 2.5 veces mayor que la reportada en Acetobacterium [19] y 1.5 veces mayor que en vitamina B12 que en Methanosarsina sp. [9].
Aunque se ha mencionado que el carbono proveniente del acetato puede incorporarse a la biomasa [9], probablemente Methanosarcina sp. prefiere utilizar él [AcO] para la formación de CO2 y CH4, ya que tiene una DG°' de −37.0 kJ mol−1 de [Ac], mientras que la utilización de metanol para producir CO2 y CH4 tiene un rendimiento energético DG°' de −79.9 kJ mol−1 de metanol; ésta diferencia (42.9 kJ mol−1) entre las dos fuentes de carbono es utilizada por Methanosarcina preferentemente en la síntesis de biomasa. Lo anterior se puede afirmar ya que el rendimiento de CH4 no tubo diferencias significativas entre las concentraciones de acetato probadas (Cuadro 2), mientras que YX/MeOH es mayor en presencia de [Ac]. Lo anterior puede confirmarse ya que se conoce las vías de reducción del metanol y de oxidación del acetato para M. barkeri (Fig. 5): i) M. barkeri tiene una capacidad limitada de reducir acetato (ruta 3, 4, 5), ii) los electrones generados por la oxidación de metanol y acetato (ruta 6 y 7) se acoplan para la reducción de metanol (ruta 2, 3) para la formación de metano, iii) el metanol y el acetato son incorporados a la biomasa por la ruta B, la cual tiene como intermediario a CH3CO-CoA, iv) la cantidad de metanol que no es reducido por los electrones producidos por la oxidación del acetato, siguen las rutas 6, 7 para la formación de CO2 y las rutas 1, 2 y A para la síntesis de metano y biomasa, respectivamente [5, 16, 17].
Referencias
1. Fukusaki, S. (1988). MSc-Thesis. Dept. Fermentation Technology, Faculty of Engineering, Hiroshima University, Japan.
2. Namba, A.; Nukada, R; Nagai, S. J. Ferment. Technol. 1983 61, 551-556. [ Links ]
3. Hatanaka, H.; Wang, E.; Taniguchi, M.; Iijima, S.; Kobayashi, T. Appl. Microbiol. Biotechnol. 1988, 27,470-473. [ Links ]
4. Ye Kaiming, Y.; Shijo, M.; Jin Sha; Shimizu, K. J. Ferment. Bioeng. 1996, 82, 484-491. [ Links ]
5. Nagai, S.; Nishio, N. 1989. Handbook of heat and mass transfer. Cheremisinoff (ed), Gulf Publishing Co., Houston, London, Paris, Tokyo, Vol. 3, chapter 18, 701-751. [ Links ]
6. Krzycki, J. A;, Wolkin, R. H.; Zeikus, J. G. J. Bacteriol. 1982, 149; 247-254. [ Links ]
7. Mazumder, T. K.; Nishio, N.; Fukusaki, S.; Nagai, S. Appl. Microbiol. Biotechnol. 1987, 65, 511-516. [ Links ]
8. Mazumder, T. K.; Nishio, N.; Hayashi, M.; Nagai, S. Biotechnol. Lett. 1987 8, 843-848. [ Links ]
9. Gaiger-Silveira, R.; Nishio, N.; Nagai, S. J. Ferment. Bioeng. 1991, 71, 28-34. [ Links ]
10. Adachi, K. FEMS Microbiol. Lett. 1999, 30, 77-85. [ Links ]
11. Gianotti, C. 1982. In: Dolphin D. (Ed). Vitamin B12, vol. 1, John & Sons Pu., New York. [ Links ]
12. Nishio, N.; Kitamura, S.; Nagai, S. J. Ferment. Technol. 1982, 60, 423-429. [ Links ]
13. Bradford, M. M. Anal. Biochem. 1976, 72; 248-254. [ Links ]
14. Fenton, W. A; Rosenberg, L. E. Anal. Biochem. 1978, 90, 119-125. [ Links ]
15. Grosskopf, R.; Janssen, P. H.; Liesack, W. Appl. Environ. Microbiol. 1998, 64, 960-969. [ Links ]
16. Thauer, R. K.; Moller-Zinkan, D.; Spormann, A. M. Annu. Rev. Microbiol. 1989, 43, 43-67. [ Links ]
17. Bainotti, A. E. ; Yamaguchi, K. ; Nakashimada, Y, ; Nishio, N. J. Ferment. Bioeng. 1998, 85, 223-229. [ Links ]
18. Fukuzaki, S.; Nishio, N. J. Ferment. Bioeng. 1997, 84, 382-385. [ Links ]
19. Bainotti, A. E.; Estebanez, B.; Nagadomi, H; Nishio N. Biotechnol. Lett. 2000, 22, 503-508. [ Links ]














