Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química de México
versão impressa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.3 Ciudad de México Jul./Set. 2000
Investigación
Obtención, caracterización y estudio de la estabilidad térmica de arcillas pilarizadas de aluminio
Sofía Arrellano,1 Tzayhrí Gallardo1* y Guillermo Osorio2
1 Escuela Nacional de Ciencias Biológicas (ENCB-IPN); Depto. de Biofísica. Plan de Ayala y Carpio s/n, Col. Santo Tomás. México 11340, D.F., Tel. (52) 5729-6000, Ext. 62305. Fax y Tel. (52) 5341-23 35. E-mail: tgallard@bios.encb.ipn.mx
2 Centro Interdisciplinario de Investigación y Estudios sobre Medio Ambiente y Desarrollo (CIIEMAD-IPN).
Recibido el 25 de octubre de 1999.
Aceptado el 21 de junio del 2000.
Resumen
En el presente trabajo se estudiaron las propiedades de estabilidad de tres arcillas pilarizadas de aluminio (Al-PILCs) sintetizadas a partir de una bentonita, variando algunos parámetros en su preparación. Los estudios de hinchamiento y de difracción de rayos X mostraron que se requiere una relación mayor de 1.5 mmol de Al/g de arcilla, para efectuar la pilarización, siendo la relación de 6.0 mmol Al/g la que propició un producto con mejor acomodamiento cara-cara. Las Al-PILCs fueron estables hasta una temperatura de 400 °C, siendo la PILC con tratamiento a 200 °C la que presentó una estructura más definida. En el intervalo de 500 a 700 °C, la estructura pilarizada fue destruyéndose gradualmente.
Palabras clave: bentonita, arcillas pilarizadas de aluminio, Al-PILC, estabilidad térmica de PILCs.
Abstract
This paper reports on some aspects of the structural stability of aluminum Pillared Clays (Al-PILCs). Three Al-PILCs were prepared from a Mexican bentonite varying some preparation parameters. X-ray diffraction and swelling studies showed that a ratio higher than 1.5 mmol Al/g of clay, was needed to ensure pillaring. A ratio of 6.0 mmol Al/g, resulted in an Al-PILC which had a face-face distribution of the structural layers of the clay. The Al-PILCs were stable up to 400 °C, being 200 °C the temperature in which the Al-PILC exhibited a better defined structure. In the range 500-700 °C the pillared structure was gradually destroyed.
Key words: bentonite, alumina pillared clay, Al-PILC, PILC´s thermal stability.
Introducción
Las zeolitas se han utilizado tradicionalmente como catalizadores comerciales en los procesos de refinamiento del petróleo. Sin embargo, presentan un tamaño de poro relativamente pequeño (2-8 Å), lo que ha limitado su empleo en el procesamiento de los hidrocarburos de alto peso molecular. A finales de los años 70 por la necesidad de contar con materiales con mayores dimensiones de poro, se desarrollaron las arcillas químicamente modificadas denominadas arcillas pilarizadas interlaminares: PILCs (Pillared Interlayered Clays) o también CLS (Cross-Linked Smectites) [1].
Las PILCs usualmente se preparan mediante el intercambio iónico de los cationes interlaminares (principalmente Ca2+, Na+, K+, Mg2+) presentes en las arcillas naturales (generalmente del grupo de las esmectitas), por polihidroxicationes de Al, Zr, Fe, Cr o Ti. Los materiales resultantes después de someterlos a calcinación, presentan una galería de pilares de composición óxido/hidróxido, que mantienen expuesta la región interlaminar de la arcilla, obteniéndose un producto rígido y poroso (Fig. 1), cuyas dimensiones de poro son mayores que las de las zeolitas [1].
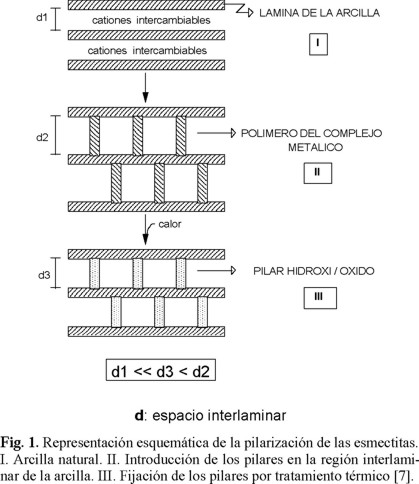
Las arcillas pilarizadas de aluminio han sido extensamente estudiadas debido a que poseen mayor área superficial que las obtenidas con otros policationes y una notable termoestabilidad. De esta manera, numerosos investigadores han preparado Al-PILCS y han estudiado sus propiedades catalíticas [1-8], de adsorción [7-11], de tamiz molecular [12-14] y su capacidad de intercambio iónico dependiente del pH [15-19].
En estos trabajos se resalta la importancia de garantizar la estabilidad de los materiales pilarizados, lo cual es función entre otros factores, del proceso de preparación. Continuando en esta línea de investigación, en el presente trabajo se estudia el efecto de la temperatura y de la concentración de Al, en las propiedades fisicoquímicas de Al-PILCS preparadas a partir de una arcilla natural mexicana.
Parte experimental
Arcillas. Las arcillas que se utilizaron en este trabajo fueron Al-PILCS preparadas a partir de una bentonita mexicana suministrada por la Compañía Filtrantes e Inertes de Mexico, D.F.
Agente pilarizante. La solución de hidróxido de aluminio se preparó de acuerdo con el procedimiento descrito por Tokarz y Shabtai [13]. Se adicionó lentamente una solución 0.2N de NaOH a una solución 0.2 N de Al(OH)3·6H2O hasta obtener un pH de 4.35, que corresponde a una relación OH/Al de 1.85.
La solución se reflujó durante 6 h. Estas condiciones propician la formación mayoritaria del policatión de aluminio Al13 denominado ion Keggin [Al13O4(OH)24(H2O)12]7+ [7].
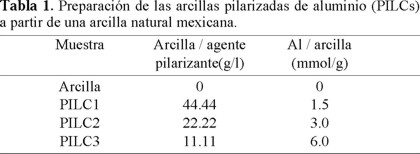
Arcillas pilarizadas de aluminio. Las PILCS se prepararon mediante el procedimiento descrito por Tokarz y Shabtai [13], variando las proporciones Al/Arcilla, como se presenta en la Tabla 1. Las mezclas resultantes se dejaron reposar durante 15 h. Los productos se filtraron y se lavaron con agua desionizada hasta prueba negativa de cloruros. La PILC3 se trató durante 4 h a temperaturas de 200, 400, 500, 600 y 700 °C.
Análisis químico.
Las arcillas empleadas se analizaron mediante métodos químicos, utilizando la técnica de fusión con carbonato de sodio y potasio. Los componentes fueron identificados por espectroscopía de absorción atómica (EAA) y por gravimetría. La capacidad de intercambio catiónica (CIC) se determinó por el método del acetato de amonio. La capacidad de hinchamiento se obtuvo midiendo el incremento del volumen (%) en un tiempo de 48 h, por la inmersión de la muestra en agua [20]. Los análisis de difracción de rayos X (XRD) se obtuvieron utilizando un difractómetro Siemens D-500 con filtro de níquel y con una radiación CuKα. Los valores de la primera reflexión d (001) se determinaron mediante la ecuación de Bragg y restando de éstos el espesor de las láminas de silicato (9.5 Å) se calcularon las distancias interlaminares (Δd) correspondientes [21]. Las áreas superficiales se determinaron mediante un analizador automático C.I. Electronics LTD Mark 2. Las isotermas de adsorción-desorción de N2 se obtuvieron a −196 °C y se analizaron por el modelo de BET.
Resultados y discusión
Las fórmulas estructurales obtenidas del análisis químico de las tres arcillas se presentan en la Tabla 2. Las propiedades fisicoquímicas se muestran en la Tabla 3.

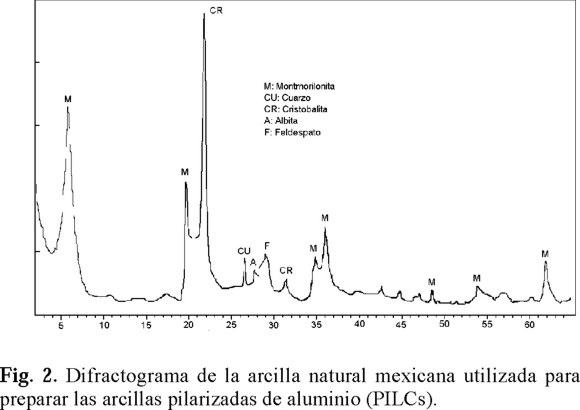
A partir de estos resultados, la arcilla natural utilizada se clasificó como una bentonita dioctaédrica, ya que su fórmula estructural, su CIC y el perfil de XRD (Fig. 2), fueron típicos de montmorilonitas dioctaédricas con pequeñas cantidades de impureza [21].
Las evidencias de la pilarización se observan en la Tabla 3. Las PILCS presentaron menor CIC que la arcilla natural, debido al desplazamiento de los cationes originales por la introducción de los policationes de Al; una capacidad de hinchamiento baja o nula, dado que los pilares de aluminio mantienen unidas las láminas de silicato, formando una estructura rígida; una expansión del espacio interlaminar (Δd) que se reflejó en el incremento de los valores de la reflexión de primer orden d (001) con respecto a la arcilla original (Fig. 3) y un aumento del área superficial debido a la exposición de las regiones internas de la arcilla y de las superficies de los pilares de Al intercalados [5, 7, 13].

La pilarización de la arcilla fue función de la relación Al/Arcilla (mmol/g) establecida durante la preparación. La PILC1 (Tabla 1) obtenida con una relación de 1.5 mmol/g, presentó una pilarización parcial en la que aparentemente el ion Keggin no fue la especie intercalada, dado que presentó capacidad de hinchamiento (Tabla 3), una carga efectiva por átomo de Al de 0.74 mayor que la que se atribuye al ion Al13 de 0.54 [20] y una distancia interlaminar (6.8 Å) menor a la esperada por la introducción del ion Keggin que se reporta en el intervalo de 8-10 Å [7, 22, 23].
Las PILCs 2 y 3 obtenidas mediante las relaciones Al/Arcilla de 3.0 y 6.0 mmol/g, respectivamente, presentaron una carga efectiva por átomo de Al de 0.66 (Tabla 3) y una distancia interlaminar de 8.3 Å, compatibles con la introducción del ion Keggin. La relación de 6.0 mmol/g, propició un acomodamiento más definido cara-cara, del producto pilarizado, como se deduce de la mayor agudeza e intensidad de la señal d (001) de la PILC3 (Fig. 3).
Por otra parte, el área superficial de la PILC3 aumentó 321.3% con respecto a la arcilla original. El valor del área superficial obtenido de 240 m2/g (Tabla 3) se encuentra dentro del intervalo reportado por diferentes autores [3, 7, 23] para Al-PILCs pilarizadas con Al13, en el intervalo de 200-500 m2/g.
Estos resultados son equiparables a los que reportan Tokarz y Shabtai [13] quienes encontraron que la cantidad mínima necesaria para una pilarización exitosa de montmorillonitas con Al13 fue de 2 mmol Al/g de arcilla.
Debido a lo anterior, se seleccionó la PILC3 para estudiar el efecto del tratamiento térmico, en la estabilidad de la estructura pilarizada.
En la Fig. 4 se observan los picos de las señales d(001) de la PILC3 sometida a diferentes temperaturas y en la Tabla 4 se reportan los valores de las distancias interlaminares correspondientes. La PILC3 sometida a 400 °C, presentó la misma distancia interlaminar que la PILC3 sometida a 200 °C, en tanto que la intensidad de la señal disminuyó ligeramente. A partir de los 500 °C, la distancia interlaminar disminuyó hasta un valor de 7.9 Å, que permaneció constante hasta los 700 °C. Sin embargo, la intensidad y agudeza del pico disminuyeron paulatinamente al incrementarse la temperatura (Fig. 4).


De acuerdo con Vaughan y Lussier [7] la acidez protónica puede ser la causa de la inestabilidad de los pilares a temperaturas elevadas. Estos autores propusieron la generación de protones mediante la siguiente ecuación:
A temperaturas elevadas los protones generados pueden lixiviar el aluminio de los pilares [3]. Durante el transcurso de esta reacción, primero disminuyen las dimensiones de los pilares y si continúa la remoción del aluminio, sobreviene el colapso total de la estructura.
De acuerdo con lo anterior, se puede considerar que a 400 °C los pilares se comenzaron a transformar de hidróxidos en óxidos, pero a temperaturas mayores, el aumento de la concentración de protones provocó la degradación gradual de los pilares de aluminio, por lo que no obstante que la distancia interlaminar promedio permaneció constante, la estructura del material fue cada vez menos definida (Fig. 4).
A partir de 600 °C, las láminas de silicato estructurales de la arcilla se distorsionaron, como se deduce del ensanchamiento y la disminución significativa de la intensidad de la señal d (001) (Fig. 4).
Los resultados obtenidos indican que la arcilla pilarizada fue estable hasta una temperatura de 400 °C. Este valor es comparable con aquellos que se reportan en la literatura; por ejemplo, Occelli et al. [3] obtuvieron montmorilonitas pilarizadas de aluminio estables hasta una temperatura de 540 °C. Por otra parte, Lahav et al. [12] prepararon Al-PILCs que fueron estables a temperaturas dentro del intervalo de 220-480 °C, dependiendo de los métodos de preparación y de secado.
Conclusiones
Las características fisicoquímicas de los productos pilarizados, fueron función de la relación Al/Arcilla utilizada en la preparación.
La relación Al/Arcilla de 1.5 mmol/g propició una pilarización incompleta. Por otra parte, mediante la relación de 3.0 mmol/g se obtuvo una Al-PILC que desarrolló una distancia interlaminar y un grado de polimerización del pilar compatibles con la incorporación mayoritaria del ion Al13.
El incremento en el contenido de aluminio (6.0 mmol/g) no influyó en las características antes mencionadas, pero propició un acomodamiento cristalino más definido cara-cara, como se evidenció mediante el análisis de rayos X.
Las Al-PILCs fueron estables hasta una temperatura de 400 °C, siendo la PILC con tratamiento a 200 °C la que presentó la estructura más definida. En el intervalo de 500-700 °C la estructura pilarizada fue degradándose gradualmente.
Agradecimientos
Los autores desean agradecer al Dr. Jesús Palacios Gómez, jefe de la Sección de Estudios de Posgrado e Investigación de la Escuela Superior de Física y Matemáticas del IPN. por su apoyo en la obtención de los difractogramas de RX publicados en este trabajo.
Referencias
1. Pinnavaia, T. J., in: Constrained Systems, Setton, R., Ed., Elsevier Sci. Publishers, Amsterdam, 1986, 151-164. [ Links ]
2. Guida, S.; Fushan, Y.; Dehai, S.; Zhonghui, L., in: Pillared Clays, Rees, L. C. V., Ed., Elsevier Sci. Publishers, Amsterdam, 1987, 113-121. [ Links ]
3. Occelli, M. L.; Tindwa, R. M. Clays and Clay Minerals 1983, 31, 22-28. [ Links ]
4. Occelli, M. L. Proc. Int. Conf., Denver. The Clay Minerals Soc. 1987, 22, 319-323. [ Links ]
5. Tichit, D.; Fajula, F.; Figueras, F. Clays and Clay Minerals 1988, 23, 369-375. [ Links ]
6. Vaughan, D. E. W.; Lussier, R. J.; Magee, J.S. U. S. Patent 176-090, 1979. [ Links ]
7. Vaughan, D.E.W.; Lussier, R.J., in: Proc. of the Fifth Int. Symp. on Zeolite, Rees, L.V.C., Ed., Hrydenson, Naples, 1980, 94-101. [ Links ]
8. Danis, T. G.; Triantafyllos, A. A.; Petrakis, D. E.; Pomonis, P. J. Wat. Res. 1998, 32, 295-302. [ Links ]
9. Raiender, S.; Naicker, V.; Naicker K. Tet. Lett. 1998, 39, 2915-2918. [ Links ]
10. Keeran, R. Clays and Clay Minerals 1990, 38, 277-286. [ Links ]
11. Malla, P. B.; Komarneni, S. Clays and Clay Minerals 1990, 38, 363-372. [ Links ]
12. Lahav, N.; Shani, U.; Shabtai, J. Clays and Clay Minerals 1978, 26, 107-115. [ Links ]
13. Tokarz, M.; Shabtai, J. Clays and Clay Minerals 1985, 33, 89-98. [ Links ]
14. Dyer, A.; Gallardo, T.; Roberts, C.W., in: Zeolites: Facts, Figures, Future. 49ª, Jacobsand, P. A.; Van Santen, R. A., Ed., Elsevier Applied Science, London, 1989, 389-398. [ Links ]
15. Bergaoui, L.; Lambert, J. F.; Suquet, H.; Che, M. J. Phys. Chem. 1995, 99, 2155-2161. [ Links ]
16. Dyer, A.; Gallardo, V.T., in: Recent Developments in Ion Exchange, Williams, P. A.; Hudson, M. J., Ed., Elsevier Applied Science, London, 1990, 75-84. [ Links ]
17. Helmy, A. K.; Ferreiro, E. A.; De Bussetti, S. G. Clays and Clay Minerals 1994, 42, 444-450. [ Links ]
18. Sridharan, A.; Satyamurty, P. V. Clays and Clays Minerals 1996, 44, 479-484. [ Links ]
19. Bandosz, T. J.; Jagiello, J.; Putyera, K.; Scharz, J. A. J. Chem. Soc. Faraday Trans. 1994, 90, 3573-3578. [ Links ]
20. Jeffery, P. G.; Hutchison, D. Chemical Methods of Rock Analysis. Pergamon Press, New York, 1981. [ Links ]
21. Bailey, S. W., in: Mineralogical Soc. Brindley, G. W.; Brown, G., Ed., Pergamon Press, London, 1980, 112-120. [ Links ]
22. Schoonheydt, R. A.; Van Den Eynde, J.; Tubbax, H. Clays and Clay Minerals 1993, 41, 598-507. [ Links ]
23. Sterte, J. P.; Otterstedt, J. E., in: New Catalytic Materials, Vol. 7, Dixon, J. B., Ed., Elsevier Sci. Publishers, USA, 1987, 631-646. [ Links ]














