Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.3 Ciudad de México jul./sep. 2000
Investigación
Evaluación de los polvos de acetona de hígado animal en la hidrólisis enantioselectiva del éster metílico del ácido 2,3-dihidro-6-metoxibenzofuran-2-carboxílico
Mauro A. Villanueva-Lendechy,1 Raúl Cortés-García,1 Ricardo Tovar-Miranda1 y Héctor Luna2,*
1 Instituto de Ciencias Básicas, Universidad Veracruzana. Av. Dr. Luis Castelazo A. s/n (antes Dos Vistas). Apartado Postal 575, Xalapa 91190 Ver., México.
2 Departamento de Sistemas Biológicos. Universidad Autónoma Metropolitana, Unidad Xochimilco. Apartado Postal 23-181. Fax: 5483-7237. E-mail: lchm1964@cueyatl.uam.mx
Recibido el 17 de febrero del 2000.
Aceptado el 16 de mayo del 2000.
Resumen
Se describe el estudio de la resolución del ácido 2,3-dihidro-6-metoxibenzofuran-2-carboxílico (1) mediante la hidrólisis enzimática de su éster metílico 2, utilizando en la biotransformación las hidrolasas presentes en el hígado de bovino, cerdo, pollo, rata y conejo. Se variaron en la biocatálisis los parámetros de temperatura, pH, co-disolventes, tiempo de reacción y el concentrado enzimático en su soporte natural.
Palabras clave: Hidrólisis enzimática, biotransformación, hidrolasas, hígado animal.
Abstract
It is described a study of the 2,3-dihydro-6-methoxybenzo-furan-2-carboxylic acid (1) resolution by enzymatic hydrolysis of its methyl ester 2, through the biotransformation with the enzymes present in the liver of bovine, pig, chicken, rat, and rabbit. Moreover, the parameters studied were temperature, pH, solvents, reaction time and the enzymatic source on its natural support.
Key words: Enzymatic hydrolysis, biotransformation, hyxdrolases, animal liver.
Introducción
Se encuentran descritos en la literatura compuestos cuya estructura presenta un anillo de dihidrobenzofurano similar al de 1, y poseen importante actividad farmacológica como agentes analgésicos, neurolépticos [1,2], diuréticos, saluréticos [3] y uricosúricos [4]. Debido a lo anterior, resulta por demás interesante establecer una metodología que permita obtener el benzofurano 1 en forma enantioméricamente pura, pues éste podría ser utilizado en la preparación de compuestos similares a los arriba descritos y ser utilizados como fármacos. En éste trabajo se presentan los resultados obtenidos de la reacción de hidrólisis del éster metílico 2 con las hidrolasas presentes en los hígados de bovino, cerdo, pollo, rata y conejo, empleando para ello el polvo de acetona del hígado correspondiente [5].
Resultados y discusión
El ácido 2,3-dihidro-6-metoxibenzofuran 2-carboxílico (1) y su éster metílico 2 fueron preparados en cantidad suficiente utilizando los métodos descritos en la literatura [6,7], sus estructuras se determinaron con base en sus espectros de RMN protónica y los datos obtenidos coincidieron con los reportados [8].
En un ensayo preliminar se consideró la hidrólisis catalizada por las enzimas presentes en los hígados de bovino y cerdo, empleando como co-disolvente al éter etílico, en buffer de fosfatos (pH 7.5), pues se sabe que los procesos que involucran a estas hidrolasas dan productos con altos excesos enantioméricos [4,9], obteniéndose para estas reacciones rendimientos de 41.8 y 30.6%, respectivamente, a temperatura ambiente (Tabla 1).

La pureza óptica de los productos de hidrólisis, para todas las reacciones, fue monitoreada en base a los valores de rotación específica tanto del producto de hidrólisis como del éster que no reaccionó, y comparados con los valores reportados [10]; +75.5° del ácido con configuración "R" y +52.6° del éster con la misma configuración. Como es posible observar, los valores obtenidos no fueron satisfactorios. Así que se decidió incluir en este estudio los polvos de acetona de los hígados de pollo, rata y conejo como fuentes enzimáticas, los cuales fueron utilizados sin ningún procedimiento de aislamiento o purificación. Las reacciones se llevaron a cabo variando el tiempo y temperatura de reacción.
De los resultados obtenidos se observa claramente (Tabla 2), que el tiempo y, consecuentemente, el porcentaje de reacción afectan directamente a la rotación óptica del ácido 1 obtenido, indicando que se trata de un proceso de resolución cinética.
También es interesante notar que los polvos de acetona de hígado de, bovino, pollo y rata muestran una preferencia hacia la hidrólisis del éster de configuración S. Por lo contrario el material proveniente de los hígados de conejo y cerdo mostraron la enatioselectividad opuesta. Lo anterior nos brinda la oportunidad de poder obtener cualquiera de los enantiómeros del ácido 1, con solo variar la fuente de biocatalizador.
Con relación al efecto del co-disolvente se observó que tiene influencia sobre la velocidad de la reacción y la enantioselectividad, siendo el DMSO el que en general proporcionó una mayor enantioselectividad. Además, para el caso de hígado de pollo es notorio que la adición de 1,4-dioxano invirtió la enantioselectividad de la reacción, aunque con menor grado de pureza óptica. Por lo anterior se decidió continuar utilizando DMSO al 30% como co-disolvente, pero bajo estas condiciones no fue posible aumentar la estereoselectividad, aunque para algunas reacciones se obtuvieron rendimientos hasta del 98%. En nuestro interés por mejorar la enantioselectividad obtenida se realizaron experimentos cambiando el co-disolvente y utilizando únicamente la fuente enzimática donde se había observado la mejor selectividad, los co-disolventes utilizados fueron: dimetilformamida (DMF), dimetilsulfóxido (DMSO), y 1,4-dioxano. Los resultados se encuentran resumidos en la Tabla 2.
De estos datos es posible observar que los co-disolventes donde se obtuvo la mayor selectividad fueron DMSO y 1,4-dioxano. También se llevaron a cabo reacciones utilizando mayor concentración, esto es 50% del co-disolvente y modificando la parte esterificante por una de mayor volumen como n-butilo, pero los valores de rotación óptica obtenidos no fueron satisfactorios, puesto que en el mejor de los casos se obtuvieron valores de rotación óptica de −4.7º para el ácido y de +3.2º para el éster.
Posteriormente se efectuó un estudio del efecto del pH utilizando solamente los hígados de rata y conejo con el co-disolvente en el cual se obtuvo la mejor estereoselectividad; los resultados se encuentran resumidos en las Tablas 3 y 4, de donde es claro que el hígado de conejo a pH de 6.5 y a tiempo de reacción de 2 h en 1,4-dioxano muestra valores de rotación óptica altos tanto para el ácido como para el éster que no reacciona.
Una vez establecida la fuente enzimática y las condiciones de reacción, en las cuales los valores de rotación eran mayores, se realizaron pruebas para determinar el tiempo óptimo para obtener la mayor estereoselectividad. Los resultados de este estudio se encuentran en la Tabla 5, en la que se observa que a 30 min se obtiene el valor mas alto de rotación específica, +39.1º, con un rendimiento de 35%, es claro que a medida que la reacción avanza la estereoselectividad disminuye, lo cual esta acorde con una resolución cinética.
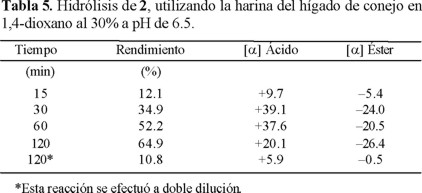
El exceso enantiomérico de esta reacción se determinó por cromatografía de gases utilizando una columna quiral de α-ciclodextrina, y de acuerdo a los datos del cromatograma se estableció que el éster que no reaccionó se obtuvo con 27% ee, mientras que el ácido producto de la hidrólisis, el cual fue esterificado para su análisis [10], se obtuvo en 67% ee.
Finalmente, de los hígados objeto de estudio como fuente enzimática para la hidrólisis selectiva del éster metílico 2, sólo el de conejo mostró tener mayor afinidad por uno de los enantiómeros, en este caso por el éster de configuración absoluta R. Además, en varias reacciones se observó que los hígados pueden ser una excelente alternativa en la hidrólisis de ésteres pues se obtuvieron reacciones hasta con 98% de rendimiento, del producto puro y en condiciones suaves. Además las fuentes enzimáticas son sumamente accesibles, baratas y conservan su actividad por más de tres años de almacenamiento en refrigeración.
Parte experimental
Las rotaciones específicas se determinaron en un polarímetro Perkin-Elmer, Mod 241, utilizando microceldas de 0.1 dm, a 589 nm y 25°C, en cloroformo. Los espectros de RMN 1H se obtuvieron en un espectrómetro Varian XL-300GS a 300 MHz utilizando CDCl3 como disolvente y TMS como referencia interna. Los excesos enantioméricos se determinaron en un cromatógrafo de gases Hewlett Packard 6890 utilizando una columna capilar de 30 m de longitud y como fase estacionaria quiral a-ciclodextrina, con un flujo de 0.5 ml/min. Las purificaciones cromatográficas se llevaron a cabo en gel de sílice Merck (230-400 Mallas).
Preparación de la fuente enzimática. El hígado correspondiente se desengrasó por licuefacción con acetona, se filtró y el residuo fue licuado nuevamente con acetona para obtener una pasta homogénea, la operación se repitió una vez mas, después de la cual la pasta resultante se dejó secar al aire y a temperatura ambiente, para obtener un polvo café, donde las enzimas se encuentra en un soporte natural.
Hidrólisis enzimática. 100 mg de la harina se suspendieron en 7 mL de buffer de fosfatos, a esta suspensión, con agitación, se agregaron 100 mg del éster metílico 2 disueltos en 3 mL de 1,4-dioxano. La mezcla se continuó agitando a temperatura ambiente por 30 min, después la reacción se extrajo con éter etílico y la fase orgánica se lavó con una solución fría de NaOH al 3% (3 × 50 ml). La fase acuosa se aciduló con HCl al 20% y se extrajo con éter etílico, la fase orgánica se lava, se seca y evapora para obtener el ácido 1.
Referencias
1. Huebner, C. F. Chemical Abstracts 1972, 77:126636v. [ Links ]
2. Chaudhuri, N. K.; Ball, T. J.; Finch, N. Experientia 1977, 33, 575-577. [ Links ]
3. Habicht, E.; Libis, B.; Zergenyi, J. Chemical Abstracts 1973, 79:31847s. [ Links ]
4. Hoffman, W. F.; Woltersdorf, O. W.; Novello, F. C.; Cragol, E.J.; Springer, J. P.; Waltson, L.S.; Fanelli, G. M. J. Med. Chem. 1981, 24, 865-873. [ Links ]
5. Zandbergen, P.; van der Linden, J.; Brussee, J.; van der Gen, A. Synth. Commun. 1991, 21, 1387. [ Links ]
6. Fuson, R.; Kneisley, J.W.; Kaiser, E. W. Organic Syntheses Coll. Vol 3, 209-211(1955). [ Links ]
7. Witiak, D. T.; Feller, D. R.; Stratford, E. S.; Hackney, R. E.; Nazareth, R.; Wagner, G. J. Med. Chem. 1971, 14, 754-757. [ Links ]
8. Birch, A. J.; Maung, M.; Pelter, A. Austr. J. Chem. 1969, 22, 1923-1932. [ Links ] Will, W.; Beck, P. Ber. Dt. Chem. Get. 1886, 19, 1783. [ Links ]
9. a) Morhr, P.; Waespe-Sarcevic, N.; Tamm, C.; Gawronska, K.; Gawronski, J. Helv. Chim. Acta 1983, 66, 2501-2511. [ Links ] b) Bowen, D. M.; De Graw, J. L.; Shah, V. R.; Bonner, W.A. J. Med. Chem. 1963, 6, 315-319. [ Links ]
10. Tovar-Miranda, R.; Cortés-García, R.; Trinidad-Nino, L. R.; Joseph-Nathan, P. J. Nat. Prod. 1999, 62, 1085-1087. [ Links ]














