Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.3 Ciudad de México jul./sep. 2000
Investigación
Electroforesis capilar en el estudio de la oxidación radiolítica del benceno en solución acuosa
Guadalupe Albarrán*
Radiation Laboratory, University of Notre Dame, Notre Dame, Indiana, USA.
Recibido el 10 marzo del 2000.
Aceptado 16 de mayo del 2000.
Resumen
En este trabajo se compara la electroforesis capilar de alta resolución con la cromatografía líquida de alta presión como métodos analíticos para la determinación del rendimiento radiolítico (valor G)† del fenol, producido en la oxidación de benceno en soluciones acuosas. El fenol es el principal producto de la oxidación de los radicales hidroxiciclohexadienilo producidos inicialmente por la adición de los radicales •OH al benceno. A partir de soluciones acuosas saturadas con benceno y N2O, también conteniendo ferricianuro como oxidante, el fenol es producido con un valor G de 5.94 moléculas por cada 100 eV de energía absorbidas. Este rendimiento indica que las reacciones de oxidación son esencialmente cuantitativas.
Además se encontró que, en general, la separaciones son mejor por electroforesis capilar que por cromatografía de líquidos, aunque la resolución es muy buena en ambos métodos. La electroforesis capilar tiene la ventaja de ser considerablemente más rápida que la cromatografía líquida de alta presión. Este hecho permite tener información detallada con mayor facilidad sobre las reacciones en estudios de química de radiaciones de solutos orgánicos mediante la electroforesis capilar.
Palabras clave: oxidación, radiólisis, benceno, fenol, análisis comparativo, electroforesis capilar, cromatografía de líquidos.
Abstract
In this paper high performance capillary electrophoresis is compared with high performance liquid chromatography as an analytical method to determine the radiolytic yield (G value) of phenol produced in the radiolytic oxidation of benzene in aqueous solutions. Phenol is the principal product of the oxidation of the hydroxycyclohexadienyl radicals initially produced by addition of •OH radicals to benzene. For solutions saturated with benzene and N2O, also containing ferricyanide as the radical oxidant, phenol is produced with a G value of 5.94 molecules per 100 eV of absorbed energy. This yield indicates that the oxidation reactions are essentially quantitative.
It is found that, in general, separations are better by capillary electrophoresis than by liquid chromatography, although the resolution is good in both methods. Capillary electrophoresis has the advantage of being considerably more rapid than HPLC. As a result one can more readily obtain detailed information on the radiation chemical reactions of organic solutes from capillary electrophoretic studies.
Key words: oxidation, radiolysis, benzene, phenol, comparative analysis, capillary electrophoresis, liquid chromatography.
Introducción
La radiólisis del benceno en solución acuosa ha sido ampliamente estudiada [1], el Prof. Dr. Schuler publicó varios trabajos sobre la radiólisis de este compuesto, utilizando como fuente de radiación cobalto-60 [2] o radiólisis de pulsos [3], analizando los productos radiolíticos por diferentes métodos. Sin embargo, existe considerable interés en la obtención de los productos de degradación de compuestos aromáticos y principalmente del benceno por su carácter cancerígeno, ya que este es un producto frecuentemente usado en diferentes industrias por lo cual siempre es importante conocer más sobre la oxidación de este tipo de compuestos.
Por otro lado, el reciente desarrollo de la técnica analítica de electroforesis capilar [4, 5] (EC) acoplada a detectores modernos tales como el ultravioleta con arreglo de diodos nos permite medir concentraciones muy bajas en muestras diminutas (µL) de diversas clases de compuestos. Esta técnica desafía la sensibilidad y la selectividad, teniendo la ventaja sobre la cromatografía de líquidos de alta presión (CLAP) su alta eficiencia en la separación de compuestos similares.
En este trabajo se hizo una comparación entre la cromatografía líquida de alta presión, que es la metodología analítica más usada en Química de Radiaciones, con la electroforesis capilar que es un método prácticamente no utilizado, hasta ahora, en Química de Radiaciones. En este caso, la electroforesis capilar permite explorar con más detalle el aspecto cuantitativo de la oxidación del radical hidroxiciclohexadienilo, producido en la radiólisis del benceno, para formar el fenol.
Parte experimental
Materiales y preparación de las muestras. El agua utilizada fue purificada en un sistema Millipore Milli Q, el benceno fue de calidad espectroscópica (Fisher Scientific) y el fenol (Aldrich), usado como estándar, fue purificado por cristalización.
Radiólisis gamma. Una alícuota de 3 mL de una solución acuosa de 1 mmol L−1 o 2 mmol L−1 de K3Fe(CN)6 fue purgada con oxígeno y saturada con N2O en un celda de vidrio, a esta solución se le inyectó 10 mL de benceno (concentración ~22.7 mmol L−1), la muestra se agitó y posteriormente se irradió por intervalos de 5 a 60 min con una fuente de cobalto-60 tipo Gammacell (Shepherd, de 24,000 Ci de actividad nominal) con una intensidad de dosis de 3.04 × 1017 eV g−1 min−1. Las dosis usadas estuvieron dentro del intervalo de 0 y 182 eV g−1. El rendimiento absoluto se determinó por comparación con el dosímetro de Fricke usando los siguientes valores para las constantes: G(Fe3+) = 15.45, e(Fe3+) = 2197 L mol−1 cm−1 en 304 nm y 25 C(6).
Las soluciones de benceno se analizaron inmediatamente después de la irradiación utilizando el método de fase reversa para la cromatografía de líquidos de alta presión y el modo llamado cromatografía capilar por electrocinética micelar para la electroforesis capilar de alta resolución.
Radiólisis de pulsos. La solución acuosa saturada de benceno (conteniendo N2O-26.5 mmol L−1) recién preparada fue irradiada mediante pulsos de electrones de 2 ns provenientes de un acelerador lineal de 8 MeV (LINAC), del "Radiation Laboratory" de la Universidad de Notre Dame. Los datos de cada experimento individual se normalizaron a un nivel de luz incidente medido por un circuito digital y convertidos a valores proporcionales a la absorbancia óptica y normalizados a la dosis.
Sistemas de análisis. El equipo de electroforesis capilar utilizado fue Hewlett Packard modelo G1600-3D CE, se usó una columna capilar de 75 cm × 75 µm, un detector de ultravioleta con arreglo de diodos de alta sensibilidad y con un camino óptico de 1.2 mm, se aplicó un alto voltaje de 30,000 voltios y se uso una solución buffer 10 mmol L−1 de fosfato con 50 mmol L−1 de dodecil sulfato de sodio a pH 7.
En la cromatografía de alta presión se utilizó un equipo Waters modelo 990 con un detector con ultravioleta de arreglo de diodos. La columna usada fue Luna C8(2), de Phenomenex, 5 µm, producto no. OOF-4249-EO, con dimensiones de 150 × 4.60 mm y para la fase móvil se utilizó un programa tipo gradiente de una mezcla agua al 0.1% de ácido fórmico y metanol.
La sensibilidad de los equipos fue calibrada con soluciones de diferentes concentraciones del fenol (10-6-10-8 mol L−1), las cuales se prepararon y se analizaron en ambos sistemas el mismo día que las muestras irradiadas.
Resultados y discusión
En la radiólisis del agua se obtiene el radical •OH como se muestra en la reacción 1.

Además, la solución se saturó con N2O (concentración 0.0265 mol L−1) porque es bien conocido que la adición del N2O a soluciones acuosas al ser irradiadas este óxido atrapa a los electrones solvatados y los convierte en radicales •OH, incrementando así el rendimiento radiolítico de este radical, según las siguientes reacciones [7, 8]:

de esta manera se obtuvo un sistema que es predominantemente oxidante y permitió estudiar con mayor simplicidad este tipo de fenómeno en química de radiaciones.
Además, se adicionó el ion ferricianuro, porque es bien conocido que en concentraciones tan bajas como 10−4 mol L−1, éste ion oxida cuantitativamente al radical hidroxiciclohexadienilo, produciendo así al fenol [3] (ver la reacción 4).

Se ha establecido [1] en Química de Radiaciones por radiólisis de pulsos [3] y por estudios de resonancia paramagnética electrónica [9] que el radical •OH formado en la radiólisis de soluciones acuosas de benceno (C6H6) ataca al anillo aromático formando el radical hidroxiciclohexadienilo (OHC6H6)• según la siguiente reacción:
La figura 1 muestra el espectro observado después de la radiólisis de pulsos del radical (OHC6H6)• o, el cual presenta un solo máximo a 313 nm. El sistema conjugado y la electronegatividad del grupo OH adyacente al electrón desapareado determinan la intensidad del espectro. La escala del coeficiente de extinción fue basada en la dosimetría usando tiocianato con un rendimiento radiolítico del radical (SCN)− = 6.00 y un coeficiente de extinción para este radical de 7,600 L mol−1s−1. Este espectro obtenido en estos experimentos es idéntico al mostrado por Dorfman y colaboradores [10] y por Chen y Schuler [11].

El electroferograma (Fig. 2) y el cromatograma (Fig.3) muestran la separación entre el fenol y el benceno de una solución acuosa irradiada saturada con benceno y N2O, la cual contenía 2 mmol L−1 de ferricianuro de potasio. Ambos resultados muestran una muy buena separación de los dos compuestos. Además, se obtienen los parámetros de separación entre el benceno y el fenol, los cuales se presentan en la Tabla 1.

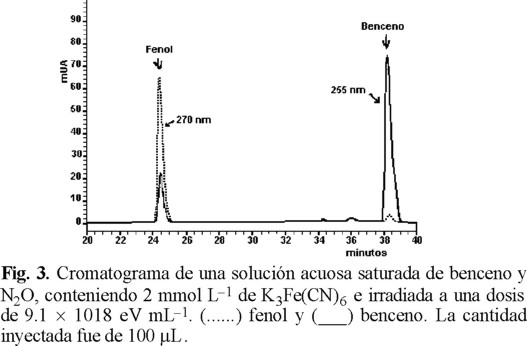
Comparando los parámetros de separación de los 2 compuestos de interés por electroforesis capilar y cromatografía de líquidos, podemos decir que el análisis por electroforesis capilar se realizó en un tiempo mucho más corto, presenta mayor eficiencia y selectividad que el de la cromatografía de líquidos aunque en ambos métodos se tiene muy buena resolución. Además, cabe comparar en este estudio el tamaño de la muestra de inyección que fue de ~ 1 µL para la electroforesis capilar y de 100 µL para la cromatografía de líquidos, también la cantidad de fase móvil de 20 mL por análisis en la cromatografía de líquidos contra < 5 mL de solución buffer por día (más de 30 análisis) para la electroforesis capilar. Sin embargo, como se ve en las figuras 4 y 5, las gráficas de contorno de la señal del electroferograma y del cromatograma respectivamente de la solución saturada de benceno en estudio, muestran que no hay interferencias de impurezas o de compuestos secundarios en el análisis, ya que los 2 picos de absorción son simétricos en ambos métodos analíticos, aunque existen otros pequeños picos, en muy baja concentración, que están muy bien resueltos.


La figura 6 muestra los espectros de absorción ultravioleta del fenol y del benceno obtenidos directamente de la figura 5 a los tiempos de retención de 24.56 min (fenol) y de 38.42 min (benceno). Esto fue posible por el uso del detector de ultra violeta con arreglo de diodos, lo cual nos permitió seleccionar los máximos de absorción del fenol (270 nm) y del benceno (254 nm) y así se pudo cuantificar la formación del fenol, como principal producto de la radiólisis del benceno en solución acuosa, en función de la dosis (Fig. 7) así como también se pudo observar la desaparición del benceno en función de la dosis de radiación absorbida por la solución.


De la figura 7 se puede ver claro que la concentración del ion ferricianuro, utilizado como oxidante del radical hidroxiciclohexadienilo, no muestra dependencia en este intervalo de concentración, ya que los resultados del rendimiento radiolítico del fenol fueron similares. Además de que es conocido que concentraciones tan bajas como 0.1 mmol L−1 de este ion oxidan al radical hidroxiciclohexadienilo [3].
Análisis cinético y el rendimiento inicial del fenol
La adición de los radicales •OH, producidos por la radiólisis del agua, al benceno para formar el radical hidroxiciclohexadienilo y su posterior oxidación a fenol conlleva una cinética de reacción, que mediante su estudio detallado nos permite extraer el rendimiento inicial del fenol, ya que es claro que la curva obtenida (Fig. 7) al hacer la gráfica de la concentración del fenol en función de la dosis nos indica un decrecimiento del rendimiento del fenol afectando la cinética de la reacción por procesos secundarios según las siguientes reacciones:

Donde P denota a los productos radiolíticos primarios, los cuales podrían reaccionar con el radical •OH y producir nuevos productos secundarios con una diferente velocidad de formación:

Así que podemos hacer una corrección mediante las siguientes ecuaciones:

Donde G0 y GD son el rendimiento radiolítico a una dosis cero y a una determinada dosis respectivamente y [B] es la concentración del benceno. Arreglando la ecuación 7 se tiene:

Si asumimos que la concentración de los productos es proporcional a la dosis, [P] = (Rp)D tenemos que Kp[P] = kp[(Rp)D] y substituyendo en la ecuación tendremos:

Podemos observar que

es una constante, entonces la ecuación se reduce a la siguiente expresión:

Integrando ésta entre los límites de cero a una dosis determinada se tiene

resolviendo la integral se obtiene la siguiente expresión:

Con la ecuación (12) pudimos calcular el rendimiento inicial corregido del fenol. Esta corrección se representa en la figura 8, en donde es muy clara la dependencia de la dosis sobre la formación del fenol a partir de la solución acuosa de benceno irradiada. Aquí, se pudo observar que el rendimiento del fenol decrece con el incremento de la dosis, esto es debido a que la dosis es suficiente para convertir al fenol en otros productos secundarios como se indicó en la ecuación 6. De tal forma que a una dosis de 1.82 × 1019 eV mL−1 se destruye un 18.5 % del fenol.

Usando estas ecuaciones y los resultados experimentales, que fueron similares para los dos métodos analíticos, se obtuvo que el comportamiento de la cinética de reacción presenta la forma de una reacción de pseudo primer orden.
El rendimiento radiolítico corregido del fenol determinado fue de 5.94, el cual es ligeramente menor al encontrado en la literatura [2], (G = 6.0), ya que en estas condiciones no se espera otro producto radiolítico primario diferente al fenol [12], sin embargo, a dosis de 9.1 × 1018 eV mL−1 se presentan picos de absorción en el análisis de electroforesis y cromatografía que corresponden a productos radiolíticos secundarios en muy baja concentración (Figs. 4 y 5). El valor G obtenido, después del tratamiento matemático de los datos experimentales, usando detectores modernos como el de ultravioleta con arreglo de diodos en ambos análisis, lleva a la conclusión que este valor de G determinado es igual al informado por métodos tan sensibles como los radioquímicos.
Por otro lado, la electroforesis capilar de alta resolución es una técnica alternativa y complementaria de la cromatografía de líquidos de alta presión y representa una magnífica opción para ser aplicada en estudios de Química de Radiaciones en el análisis de una diversidad de productos radiolíticos, con la ventaja de que, dependiendo del modo que se use, se pueden analizar compuestos polares y no polares, ionizados y no ionizados, pequeñas y grandes moléculas como proteínas y ácidos nucleicos. La desventaja es que dependiendo del detector usado, se podría perder sensibilidad, porque la celda para el análisis es muy pequeña. Como una observación se tiene que para obtener una alta reproducibilidad se requiere del control del flujo electro-osmótico.
Conclusiones
Tanto la electroforesis capilar de alta resolución como la cromatografía de líquidos de alta presión separaron muy bien al fenol del benceno con una muy alta resolución
Usando el mismo tipo de detector de ultravioleta con arreglo de diodos en ambos métodos analíticos, se consiguieron resultados similares.
Se observaron otros productos radiolíticos en muy baja concentración gracias al tipo de detector usado.
La electroforesis capilar de alta resolución resultó más fácil de usar, se pudieron realizar un número mayor de análisis por día, fue más económico y los parámetros de separación fueron mejores que para la cromatografía de líquidos.
Con este método es posible realizar trabajos sistemáticos del análisis de benceno y su principal producto de oxidación, el fenol.
El rendimiento radiolítico corregido del fenol fue de 5.94 en ambos métodos analíticos.
Se muestra que la electroforesis capilar de alta resolución es perfectamente aplicable en estudios sistemáticos de química de radiaciones, siendo ésta es una nueva herramienta.
El tratamiento matemático de los datos corrige el efecto de la dosis en función de la concentración del fenol (Fig. 8).
Agradecimientos
El trabajo que aquí se describe fue financiado por la "Office of Basic Energy Sciences of U.S. Department of Energy". Esta es la contribución No. NDRL-4207 del "Notre Dame Radiation Laboratory".
Doy las gracias al Dr. Guillermo Ferraudi y a la Dra. Carol H. Collins por la revisión de este manuscrito y de manera muy especial, agradezco la dirección de este trabajo al Prof. Robert H. Schuler.
Referencias
1. Bhatia, K. Radiat. Res. 1974, 59, 537-555. [ Links ]
2. Bhatia, K.; Schuler, R.H. J. Phys. Chem. 1974, 78, 2335-2338. [ Links ]
3. Madhavan, V.; Schuler, R.H. Radiat. Phys. Chem. 1980, 16, 139-143. [ Links ]
4. Baker, D.R. Capillary Electrophoresis, Wiley - Interscience, N.Y. USA. 1995. [ Links ]
5. Landers, J.P. Handbook of Capillary Electrophoresis, CRC Press LLC, (2nd Ed.) USA., 1996. [ Links ]
6. Schwarz, H.A.; Losse, P.J. Jr.; Allen, A.O. J. Am. Chem. Soc. 1954, 76 4693. [ Links ]
7. Janata, E.; Schuler, R.H. J. Phys. Chem. 1982, 86, 2078-2084. [ Links ]
8. Pimblott, S.M.; Schuler, R.H.; La Verne, J.A. J. Phys. Chem. 1992, 96, 7839-7841. [ Links ]
9. Eiben, K.; Fessenden, R.W. J. Phys. Chem. 1971, 75, 1186-1201. [ Links ]
10. Dorfman, L.M.; Taub, I.A.; Bühler, R.E. J. Chem. Phys. 1962, 36, 3051-3061. [ Links ]
11. Chen, X.; Schuler, R.H. J. Phys. Chem. 1993, 97, 421-425. [ Links ]
12. Klein, G.W.; Schuler, R.H. Radiat. Phys. Chem. 1978, 11, 167-171. [ Links ]
Notas
*Este trabajo fue desarrollado durante una estancia sabática. Dirección actual: Instituto de Ciencias Nucleares, UNAM. Apartado Postal 70-543, Coyoacán 04510, México D.F.
†Al valor G se le conoce como rendimiento radiolítico y corresponde al número de moléculas transformadas por cada 100 eV de energía absorbidas.














