Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.2 Ciudad de México abr./jun. 2000
Investigación
Determinación espectrofotométrica de cobre con la tiosemicarbazona del 4-carboxibenzaldehido en agua potable y chocolate en polvo
Leticia López-Martínez,* Pedro Luis López-de-Alba y Bárbara Urbina Zárate
Instituto de Investigaciones Científicas, Universidad de Guanajuato, Guanajuato, Gto., 36000 México. fax: 52-473-26252. E-mail: lopleti@quijote.ugto.mx
Recibido el 4 de abril del 2000.
Aceptado el 19 de junio del 2000.
Resumen
Se estudia espectrofotométricamente la formación del complejo amarillo pálido formado entre el ión Cu(II) y la tiosemicarbazona del 4-carboxibenzaldehido (4CBTSC), desarrollándose un nuevo método fotométrico de determinación de cobre. El intervalo útil de trabajo del método desarrollado esta comprendido entre 0.4 y 3.0 ppm del ión Cu(II) (λmáx = 357 nm, ε = 3.2 × 104 L*mol-1*cm−1) con un error relativo de 2.21 % (para 1.5 ppm de Cu(II), n=11, p=0.05). Se han estudiado las interferencias de numerosos iones. La estequiometría del complejo formado resultó ser 1:1 (4CBTSC:Cu), determinado por métodos espectrofotométricos. El método se aplicó al análisis de cobre en agua potable y chocolate en polvo con buenos resultados.
Palabras clave: tiosemicarbazona, 4-carboxibenzaldehido, cobre, espectrofotometría.
Abstract
The pale yellow complex formed between Cu(II) and thiosemicarbazone of 4-carboxy benzaldehyde (4CBTSC) was studied spectrophotometrically. The use of 4CBTSC as an analytical reagent in photometric estimation of Cu(II) is described. The method is suitable in the range between 0.4 and 3.0 ppm of Cu(II) (λmáx = 357 nm, ε = 3.2 x 104 L*mol-1*cm−1) with a relative error of 2.2 %. The interferences caused by numerous ions have been studied. The stoichiometry of the complex originated by the 4CBTSC with the ion Cu(II) has been determined by spectrophotometric methods and it is 1:1 (reagent:cation). The method was applied to the determination of cooper in drinking water and powder chocolate with satisfactory results.
Key Words: Thiosemicarbazone, 4-carboxybenzaldehyde, copper, spectrophotometry.
En memoria de un gran amigo, compañero y maestro, Dr. Jacobo Gómez Lara
Introducción
El estudio de tiosemicarbazonas (TSC) como reactivos analíticos ha sido en los últimos años un campo muy fecundo de investigación sobre el que se han publicado varias revisiones, bien desde el punto de vista inorgánico [1] o en relación con sus aplicaciones analíticas [2-4]. Estos compuestos se comportan como buenos reactivos analíticos de los cationes de los metales de transición, y en muchos casos son comunes sus reacciones con iones Ag(I), Hg(II), Cu(II) y Pd(II). Si bien, la mayoría de los métodos espectrofotométricos para la determinación del ión Cu(II), utilizan una etapa de extracción y separación del complejo TSC-Metal en un disolvente adecuado [5-9], registrando el espectro de absorción del extracto orgánico y midiendo en este su absorbancia a determinada longitud de onda. En medio homogéneo, son pocos los métodos que permiten la determinación por debajo de 6 µg/mL del ión cobre utilizando como reactivo cromogénico alguna tiosemicarbazona [10-13].
El aldehido 2-carboxibenzaldehido no había sido empleado para la obtención de ninguna Base de Schiff, grupo de compuestos orgánicos ampliamente utilizados como reactivos analíticos, hasta 1990 cuando Salinas y col. [14] sintetizaron por primera vez la tiosemicarbazona del 2-carboxibenzaldehido (2CBTSC), desarrollándose métodos espectrofotométricos y extractoespectrofotométricos para la determinación de los iones Ag (1) [15], Pd(II) [16] y Cu(II) [17].
Sin embargo, el 4-carboxibenzaldehido isómero del aldehído anteriormente mencionado no ha sido utilizado. Por esta razón, en este trabajo se presenta la síntesis, caracterización, reaccionabilidad y la puesta a punto de un nuevo método fotométrico de determinación del ión cobre con la tiosemicarbazona del 4-carboxibenzaldehido (4CBTSC).
Parte experimental
Aparatos
- Espectrofotómetro "Milton Roy Spectronic 3000 Array", provisto de cubetas de cuarzo de 1 cm de paso de luz y el software "Rapid Scan" para el tratamiento de los espectros.
- pH-metro, "Corning mod. 240", con electrodo combinado vidrio-Calomelanos.
- Espectrómetro de absorción atómica, "Perkin Elmer" modelo 3100.
- Espectrofotómetro "Perkin Elmer" infrarrojo con transformadas de Fourier, modelo 1600
Disoluciones
- Disolución de Cu(II).- Disolución de cobre de 1005 µg/mL patrón para E.A.A., "Sigma". A partir de esta disolución, se preparan otras más diluídas.
- Disolución de 4CBTSC. Se prepara por disolución de la cantidad necesaria de 4CBTSC en DMF, de acuerdo a las diferentes concentraciones requeridas.
- Disolución reguladora de pH 7.0. (TRIS O.1 M /HCl 0.1 M).
Los demás reactivos utilizados son todos grado analítico y el agua desionizada grado CLAR.
Síntesis de la tiosemicarbazona del 4-carboxibenzaldehído.
Se disuelven 2.05g de tiosemicarbacida "Aldrich" (0.0224 moles) en 70 ml de una disolución acuoetanólica (1:1) y se adicionan 2 ml de HCl concentrado calentándose hasta disolución total de la TSC. Se adicionan gota a gota 30 ml de disolución acuoetanólica que contiene 3.36g de 4-carboxibenzaldehido "Aldrich" (0.0224 moles) con agitación constante, al cabo de unos minutos se observa un precipitado blanco lechoso que con el tiempo cambia a amarillo pálido. Este precipitado se filtra, se lava con agua destilada caliente, se disuelve con DMF y se reprecipita por adición de agua. Esta operación se realiza dos veces. Se obtienen 4.6 g de producto puro, el cual se caracterizó por análisis elemental y por espectroscopía infrarroja en pastilla de KBr.
Reaccionabilidad de la 4CBTSC frente a iones metálicos a diferentes valores de pH.
Este estudio se realiza de acuerdo a la metodología siguiente: las muestras se preparan en tubos de ensaye, adicionando 0.5 ml del ión metálico de 1000 ppm, 2 ml de disolución amortiguadora de diferentes valores de pH, 2 ml de una disolución de 4CBTSC (1000 ppm) disuelta en DMF y completando el volumen a 5 ml con agua desionizada. Los resultados se compararon frente a un blanco testigo.
Estudio de las variables que tienen efecto sobre la formación del complejo.
Influencia del pH.
Para estudiar esta variable, se prepara una serie de muestras en matraces aforados de 25 mL conteniendo 2.5 ppm de Cu(II), 2.5 mL de una disolución 1 × 10-2 M de 4CBTSC disuelta en DMF, cantidades variables de ácido clorhídrico o hidróxido de amonio para obtener diferentes valores de pH y agua desionizada hasta completar 25 mL. Con las muestras así preparadas, se miden sus absorbancias a 357 nm frente un blanco reactivo. Con los valores de absorbancia obtenidos para cada muestra, se construye un gráfico de absorbancias vs. sus correspondientes valores de pH.
Influencia de la cantidad de reactivo.
Para este estudio, se prepara una serie de muestras en matraces aforados de 25 mL que contienen 2 ppm de Cu(II), volúmenes variables de disolución de reactivo disuelto en DMF, sin superar una concentración final de DMF del 10%, 10 mL de disolución amortiguadora de pH 7.0 y agua desionizada hasta enrase. Después se mide la absorbancia a 357 nm frente a blancos idénticos sin el ión Cu(II).
Estabilidad del complejo en disolución.
La estabilidad se ha determinado midiendo la absorbancia a 357 nm a diferentes intervalos de tiempo de una muestra conteniendo 2 ppm de Cu(II), 2.5 mL de disolución del reactivo 8 × 10-3 M disuelto en DMF, 10 mL de disolución reguladora de pH 7.0 y aforada con agua desionizada a 25 mL.
Procedimiento recomendado para la determinación fotométrica de Cu(II).
En matraces aforados de 25 mL, se adicionan 2.5 mL de 4CBTSC 8 × 10-4 M disuelta en DMF, 7.5 mL de disolución reguladora de pH 7.0 y diferentes alícuotas de las muestras cuyo contenido de ión Cu(II) no debe ser mayor de 3 µgmL−1, se adiciona agua desionizada hasta enrase. Las absorbancias se miden a 357 nm entre 20 y 40 min. de aforadas las muestras, frente a un blanco reactivo.
Determinación de cobre en muestras de chocolate en polvo.
Se pesaron exactamente tres muestras de chocolate en polvo (30.0012, 30.0034 y 30.0076 g), en cápsulas de porcelana, las cuales habían sido previamente tratadas con ácido nítrico al 10 % durante 24 h. Las muestras se calentaron en la estufa a 120°C durante 48 h hasta su completa desecación. Después se introdujeron en la mufla elevando la temperatura gradualmente hasta alcanzar 600 °C, calcinándose durante 7 h. El residuo se dejó enfriar a temperatura ambiente y se trata con 10 ml de HNO3 concentrado y 5 mL de agua milli Q, se coloca encima de la cápsula un vidrio de reloj, calentándose a temperatura controlada y con agitación constante durante 1 hora al cabo de la cual, se filtra a través de un papel filtro Whatman No 41. El filtrado se recoge en un matraz aforado de 100 mL, aforándose con agua tipo milli Q. Se toman alícuotas de 10 mL, se aplica el método de adición de estándar para la determinación de cobre utilizando el procedimiento propuesto. Se analizó enl contenido de cobre en dos marcas de chocolate: Morelia y Choco-choco.
Determinación de cobre en muestras de agua potable calentadas a ebullición en un recipiente de cobre a diferentes tiempos.
Se midió 1 L de agua potable, se transfirió a un recipiente de cobre en el cual se calentó a ebullición, se toman muestras de 10 mL de agua cada hora, hasta completar un tiempo de 3 h de calentamiento. La experimentación se realizó por quintuplicado y el agua potable correspondió a la misma muestra madre (7 litros). Cada muestra se enfría a temperatura ambiente, determinándose el contenido de cobre con la 4CBTSC, utilizando el método de adición de estándar.
Determinación de cobre en muestras de agua destilada y desionizada (tipo milli-Q) calentadas a ebullición en un recipiente de cobre a diferentes tiempos.
Se midió 1 L de agua destilada y desionizada, tipo milli-Q, , se transfirió a un recipiente de cobre en el cual se calentó a ebullición, se toman muestras de 10 mL de agua cada hora, hasta completar un tiempo de 3 h de calentamiento. La experimentación se realizó por quintuplicado y el agua destilada y desionizada correspondió a la misma muestra madre (6 litros). Cada muestra se enfría a temperatura ambiente, determinándose el contenido de cobre con la 4CBTSC, utilizando el método de adición de estándar.
Resultados y discusión
Los resultados obtenidos en la caracterización de la tiosemicarbazona se indican a continuación: análisis elemental obtenido para la 4CBTSC, en porcentaje: C, 47.94; H, 4.05; N, 18.62 y el calculado a partir de C9H9N3O2S, en %: C, 48.43; H, 4.03; N, 18.83, correspondiendo ampliamente los valores teóricos con los experimentales de acuerdo a la estructura siguiente:

El espectro infrarrojo obtenido en pastilla de KBr nuestra las bandas características a 3420 cm−1 correspondiente al grupo -NH; bandas a 3260 y 3160 cm−1 del grupo amino primario; una banda muy intensa a 1740 cm−1 debida al grupo carbonilo del ácido carboxílico; una banda característica del grupo amínico a 1590 cm−1; banda a 1540 cm−1 debida al grupo -CS-NH2 y las bandas a 1350, 1070 y 950 cm−1 debidas al grupo C=S, confirmándose la estructura propuesta.
Las pruebas de reaccionabilidad indican que el 4CBTSC da reacciones de complejación coloreadas sensibles de acuerdo a Arribas [18] con los iones Ni(II), pD = 6.7 a pH = 9.5; Co(II), pD = 6.6 a pH 9.5; Cu(II), pD = 6.9 a pH 7.0; Pd(II), pD = 5.9 a pH = 12. Como se observa de los valores de pD (D es la concentración límite) la reacción más sensible es con el ión Cu(II), por lo que se estudia más en detalle la reacción de complejación entre este ión y la 4CBTSC.
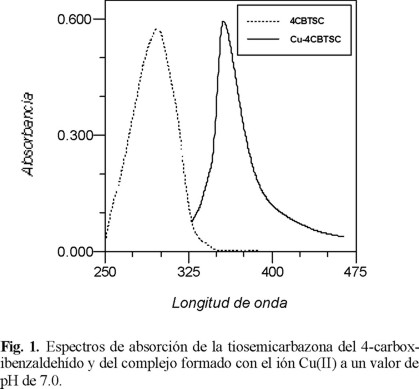
En la Fig. 1, se representan los espectros de absorción del complejo formado con el ión Cu(II) y la 4CBTSC en las condiciones óptimas establecidas en el método propuesto, registrado el espectro frente a un blanco reactivo; también se incluye en esta figura el espectro de absorción que presenta el reactivo en estas condiciones, donde se observa un sólo máximo de absorción a 357 nm para el complejo y uno a 316 nm para el reactivo.
En la Fig. 2, se muestran los resultados obtenidos del estudio de la influencia de la acidez del medio sobre la formación del complejo en donde se observa que la zona óptima de pH para la formación del mismo, es la comprendida entre 6.0 y 8.5 de pH. Se seleccionó un valor de pH de 7.0 para posteriores estudios.

Con el objeto de fijar el valor de pH a 7.0, se estudiaron diferentes disoluciones amortiguadoras, eligiéndose la preparada con TRIS 0.1 M /HCl 0.1 M como la óptima.
De los resultados obtenidos del estudio del efecto de la concentración de reactivo sobre la formación del complejo, se concluye que a partir de una concentración 2.7 × 10-4 M de 2CBTSC la absorbancia es máxima y permanece prácticamente constante hasta 3.75 × 10-3 M de reactivo. En los sucesivo, se utilizará una concentración de reactivo 8 × 10-4 M.
Del estudio de estabilidad del complejo, se pone de manifiesto que durante los primeros 12 min de preparada la muestra los valores de absorbancia aumentan, a partir de los 15 min y hasta los 40, el valor de la absorbancia prácticamente se mantiene constante, posterior a este tiempo, ésta sufre un decremento considerable hasta aproximadamente 60 min. Después de este tiempo, comienza a observarse una turbidez que se incrementa con el tiempo, independientemente de la concentración de DMF que se tenga en el medio. Por tanto, se recomienda medir el valor de absorbancia de las muestras entre los 20 y 40 min de preparadas éstas.
Además de las variables indicadas anteriormente, se estudió el efecto de la concentración de DMF y de disolución amortiguadora, así como el efecto del orden de adición de los reactivos. Se observó que el orden de adición de reactivos no tiene efecto sobre la formación del complejo y las concentraciones óptimas para la formación del mismo, son en 10 % de DMF y la adición de 7.5 mL de disolución amortiguadora.
Cálculo de la Estequiometría del Complejo
Para estudiar la estequiometría del complejo, se aplicaron los métodos de Job [19] y de Yoe-Jones [20]. En todos los casos, los resultados indican la formación de un sólo complejo en relación metal:ligando, 1:1 (Fig. 3). Esta estequiometría fue confirmada al aplicar el método de Román y colaboradores [21]; la constante de estabilidad aparente se determinó por este mismo método, obteniéndose un valor de 5.76 × 105.

Determinación espectrofotométrica de Cu(II)
Se ha estudiado la influencia de la concentración de Cu(II) en el intervalo de concentraciones de 0.2 y 3.0 ppm. En los espectros de absorción obtenidos se observa un sólo máximo de absorción a 357 nm en todos los casos.
Con los datos de absorbancia a 357 nm, se ha comprobado el cumplimiento de la ley de Beer. El sistema obedece dicha ley entre 0.2 y 3 ppm. La absortividad molar a esa longitud de onda resulta ser de 3.2 × 104 L*mol−1*cm−1. El intervalo de concentración óptimo, evaluado por el método de Ringbom es de 0.4 a 3.0 ppm de Cu(II). El error relativo para 1.5 ppm de Cu(II) es de 2.21 % para un intervalo de confianza del 95 % (n = 11). El límite de detección obtenido fue de 0.09 ppm [22] y el de cuantificación [22] resultó ser de 0.29 ppm de Cu(II).
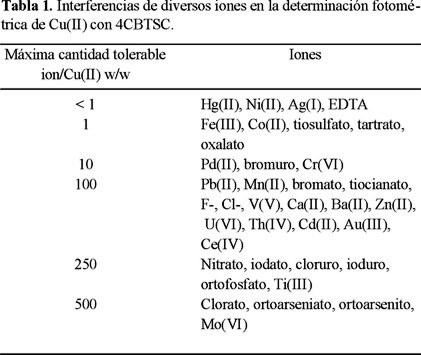
Interferencias de los iones extraños
Para observar el efecto de interferencia de iones extraños sobre la determinación de cobre aplicando el método propuesto, este se realizó sobre disoluciones conteniendo todas ellas 1.5 ppm de Cu(II) y concentraciones diferentes del ión extraño. Se fijó como límite de tolerancia aquella concentración del ión extraño (peso a peso, w/w) que no produce más de un 5% de variación en el valor de la absorbancia del complejo cuando esta ausente el ión extraño. Los resultados obtenidos se muestran en la Tabla 1.
Aplicaciones
El método propuesto se aplicó a la determinación de cobre en muestras de agua potable, agua destilada-desionizada hervida en recipientes de cobre y en chocolate en polvo de dos marcas comerciales, los resultados obtenidos se resumen en las tablas 2 y 3. En todos los casos, el contenido de cobre en las muestras también fue determinado por absorción atómica de flama (EAAF) (aire-acetileno), midiendo las absorbancias a 324.8 nm como método de comparación. Se aplicaron las pruebas estadísticas "t" y "F" para comparar los resultados en precisión y exactitud [23]. En todos los casos los valores de "t" y "F" calculados fueron menores que los valores teóricos observados para un 95 % de confianza, por lo que, se concluye que ambos métodos tienen precisión y exactitud semejantes; esto es, no existen diferencias estadísticamente significativas entre los resultados obtenidos con el método propuesto y los obtenidos por EAAF. Se calcularon los porcentajes de recuperación para cada muestra analizada a través del método de adición de estándar; los resultados de recuperación obtenidos en todos los casos están comprendidos entre 96.27 y 104.32 %.


Conclusiones
A través de la aplicación del método propuesto, se logró determinar satisfactoriamente el contenido de cobre en muestras de chocolate y agua hervida en recipientes de cobre, no existiendo diferencias estadísticamente significativas en precisión y en exactitud al comparar el método propuesto con la EAAF, técnica ampliamente utilizada en el análisis de iones metálicos.
Se observó que al hervir agua en recipientes de cobre se disuelve algo del propio metal por accción de los compuestos químicos presentes en una agua potable, principalmente derivados de cloro o flúor utilizados para potabilizar el agua, generando una oxidación parcial del metal. Acción que no sucede con el agua destilada y desionizada como se observa en los valores obtenidos de contenido de cobre mostrados en la tabla 2.
Agradecimientos
Los autores agradecen al CONACyT el apoyo financiero para la realización de este trabajo. Proyecto 28118-E.
Referencias
1. Padhyé, S.; Kauffman, G.B. Coord. Chem. Rev. 1985, 63, 127-143. [ Links ]
2. Singh, S.K.; Garg, B.S.; Singh, R.P. Talanta 1978, 25, 619-632. [ Links ]
3. Garg, B.S.; Jain, V.K. Microchem. J. 1988, 38, 144-169. [ Links ]
4. Singh, R.B.; Ishii, H. Critical Rev. Anal. Chem. 1991, 22, 381-409. [ Links ]
5. Prakash, K. M. M. S.; Prabhakar, L. D.; Reddy, D. V. Curr. Sci. 1986, 55, 563-566. [ Links ]
6. Calzolari, L. C. Ann. Chim. 1973, 63, 363-367. [ Links ]
7. Kato, T. Y.; Akira, H. Bunseki Kagaku 1982, 31, 579-583. [ Links ]
8. Reddy, K. H.; Reddy, Y.K. Talanta 1986, 33, 617-619. [ Links ]
9. Kumagai, T. Kenkyu Hokoku-Himeji Kogyo Kaigaku 1988, 41A, 18-23; [ Links ] Chem. Abst.: 112, 90607m. [ Links ]
10. Reddy, H. K. Indian J. Chem., Sect. A. 1986, 25A, 982-984. [ Links ]
11. Martínez, M.P.; Valcárcel, M.; Pino, F. Anal. Chim. Acta 1976 81, 157-160. [ Links ]
12. Asuero, A.; Jiménez, A.N.; Herrador, M.A. Ann. Chim. 1989 79, 305-310. [ Links ]
13. Reddy, K.H. Indian J. Chem., Sect. A. 1987, 26A, 712-717. [ Links ]
14. Salinas, F.; Espinosa-Mansilla, A.; López-de-Alba, P.L. Química Analítica 1992, 211-219. [ Links ]
15. Salinas, F.; Espinosa-Mansilla, A.; López-de-Alba, P.L. Analyst 1995, 120, 2857-2860. [ Links ]
16. Guiberteau-Cabanillas, A., Espinosa-Mansilla, A.; Salinas, F.; López-de-Alba, P.L. Electroanalysis 1995, 7, 488-491. [ Links ]
17. López-de-Alba, P.L., López-Martínez, L.; Amador-Hernández, J., Bol. Soc. Chilena Quim. 1999, 44, 469-477. [ Links ]
18. Arribas-Jimeno, S. Química Analítica Cualitativa, 13ª. Edición, Ed. Paraninfo, Madrid 1989, 169-72. [ Links ]
19. Vosburgh, W.C.; Cooper, G.R. J. Am. Chem. Soc. 1941, 63, 437-442. [ Links ]
20. Yoe, J.A.; Jones, A.L. Ing. Eng. Chem. Anal. 1944, 16, 111-114. [ Links ]
21. González García, D.V.; Arrebola Ramírez, A.; Román-Ceba, M. Talanta 1979, 26, 215. [ Links ]
22. IUPAC Analytical Chemistry Division, Pure Appl. Chem. 45, 99 (1976). [ Links ] ACS Committee on Enviromental Improvement, Sub-committees on Enviromental Analytical Chemistry, Anal. Chem. 1980, 52, 2242. [ Links ]
23. Massart, D. Chemometric: a Textbook, 1st. Edition, Elsevier Sci. Publishers Co., New York (1988), pp. 33-57. [ Links ]














