Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.2 Ciudad de México abr./jun. 2000
Investigación
Nuevos compuestos semiconductores. Síntesis, caracterización y estudio comparativo del comportamiento eléctrico de macrociclos de Niquel(II) del tipo [Ni(C17H25N4OL](PF6)2 con L = NH(CH2)2NH2, NH(CH2)4NH2, NH(CH2)12NH2, NHC14H6(O2)NH2
M. Elena Sánchez Vergara,a Jacobo Gómez Larab*, Verónica García Montalvob y Armando Ortíz Rebolloc
a Instituto Tecnológico y de Estudios Superiores de Monterrey, Campus Ciudad de México, Calle del Puente 222, Col. Ejidos de Huipulco, 14380 México, D.F.
b Instituto de Química, Universidad Nacional Autónoma de México, Circuito Exterior, Ciudad Universitaria, 04510 México, D.F.
c Instituto de Investigaciones en Materiales, Universidad Nacional Autónoma de México, Circuito Exterior, Ciudad Universitaria, 04510 México, D.F., Tel. 5622-45-99. e-mail: aortiz@servidor.unam.mx
Recibido el 7 de enero del 2000.
Aceptado el 14 de abril del 2000.
Resumen
El presente trabajo se refiere a la síntesis, caracterización y evaluación de propiedades eléctricas y ópticas de compuestos del tipo de los complejos de Jäger; [Ni(C17H25N4OL)](PF6)2 (L = NH (CH2)2NH2, NH(CH2)4NH2, NH(CH2)12NH2, NHC14H6O2NH2). Los compuestos se sintetizaron a partir del macrociclo [Ni(C18H28N4 O2)](PF6)2 (1) y de las correspondientes aminas bidentadas. La caracterización química se llevó a cabo por espectroscopía IR y UV-Vis, análisis elemental, susceptibilidad magnética y difracción de rayos X de polvos. Todos los compuestos son diamagnéticos y presentan la transición d-d en el visible, que corresponde a la geometría cuadrado plana para un Ni(II) tetracoordinado. Los resultados de IR indican que las aminas empleadas se unen al macrociclo a través de uno sólo de sus extremos. Por otra parte, la evaluación de las propiedades eléctricas de los compuestos sintetizados reveló un comportamiento semiconductor. Las magnitudes de conductividad eléctrica se localizan en el intervalo reportado para este tipo de materiales. Las energías de activación de la conductividad eléctrica se asocian con energías necesarias para deslocalizar electrones, mientras que el ancho de banda de las energías prohibidas adquieren valores desde 1.5 hasta 2.49 eV.
Palabras clave: Niquel (II), semiconductores, macrociclos.
Abstract
The synthesis and study of the electrical and optical properties of compounds [Ni(C 17H25N4OL)](PF6)2 with L = NH (CH2)2NH2, NH(CH2)4NH2, NH(CH2)12NH2, NHC14H6O2NH2 (Jäger type) are reported here. They were synthesized from [Ni(C18H28N4 O2)](PF6)2 (1) and the corresponding bidentate amines and characterized by IR and UV-Vis spectroscopy, elemental analyses, magnetic susceptibility and powder X-Ray diffraction. The compounds are diamagnetic and exhibit the expected d-d transition for a square planar geometry at the Ni(II) in the UV-Vis spectra. The IR results indicate that L is bonded to the macrocycles only through one extreme of the amine group. Additionally, the study of the electrical properties reveal that the behavior of the synthesized material corresponds to a semiconductor. The electrical magnitudes are within the range of the common values reported for this type of compounds. The activation energies are associated with the required energies for delocalizing electrons, while the forbidden energies wide bands get values from 1.5 up to 2.49 eV.
Key Words: Nickel (II), semiconductors, macrocycles.
Introducción
El comportamiento semiconductor de un material queda generalmente definido por la variación de la conductividad eléctrica con la temperatura. Sin embargo, la magnitud de la conductividad eléctrica puede depender de la iluminación y del tipo de impurezas [1]. En el caso de materiales inorgánicos típicos, se observa que la dependencia de la conductividad eléctrica con la temperatura que se asocia con un comportamiento de semiconductor lleva a una familia bastante homogénea con propiedades comunes [2]. Para semiconductores moleculares, se hace necesario establecer además, ciertas características estructurales y electrónicas necesarias en dichos materiales, como son: (a) estructura o apilamiento 1D, (b) estructura o apilamiento regular y (c) traslape de orbitales moleculares. Los semiconductores moleculares presentan la mayoría de las características anteriores, aunadas a un gran número de efectos tales como: las repulsiones coulómbicas entre los electrones de una misma molécula o de moléculas vecinas, interacciones entre espines de electrones vecinos, polarizabilidad, tamaño de la molécula, simetría o asimetría de la misma, naturaleza de los cationes y desorden cristalográfico, entre otros.
La mayoría de los semiconductores moleculares conocidos a la fecha, están constituidos de alineamientos altamente ordenados de especies donadoras y aceptoras, una o ambas, son radicales iónicos termodinámicamente estables [3]. Debido a su posible comportamiento como conductores unidimensionales, se han sintetizado algunos sistemas halogenados de cadenas lineales con níquel, complejos de paladio con ligantes de glioxima, complejos de níquel, paladio y cobre con ligantes de tetraazanuleno, ftalocianinas y porfirinas, parcialmente oxidadas con yodo [4]. En todos estos compuestos, a excepción de la ftalocianina de níquel(I), se encontraron características semiconductoras. También se han reportado como semiconductores; compuestos donador-aceptor con tetraazanuleno de níquel como molécula donadora [5]. El primer semiconductor molecular conocido, es la diftalocianina de lutecio, (Ft2Lu) [2]. Además de este primer semiconductor molecular, muchos complejos metálicos del cis-1,2-etilen disustituido-1,2 dithiol (M(dmit)2), se han usado como posibles moléculas aceptoras, para la preparación de compuestos donante ϖ-aceptor, con un gran número de moléculas inorgánicas y orgánicas. Este tipo de complejos fue seleccionado por su geometría plana, su estructura 1D, su sistema electrónico extendido y su desarrollo redox reversible; ya que según se encontró con Fc2Lu, todas las unidades moleculares pueden ser fácilmente reducidas y oxidadas simultáneamente y pueden llevar a materiales semiconductores.
Por otro lado, a partir de que aparecieron los primeros materiales moleculares con conductividad eléctrica medible, ha surgido un gran interés en la síntesis de nuevos compuestos; algunos de éstos, corresponden a modificaciones de aquellos que han presentado propiedades eléctricas interesantes. Sin embargo, no todos los compuestos modificados han logrado superar o, al menos igualar, los resultados observados en los compuestos originales. Por ejemplo, ninguno de los derivados de TCNQ [6], ha podido sobrepasar al compuesto original en cuanto a la magnitud de la conductividad eléctrica se refiere.
Con el fin de continuar con el estudio de nuevos materiales con importantes propiedades eléctricas y ópticas y sus posibles aplicaciones, el presente trabajo plantea la síntesis, la caracterización química y la evaluación de las propiedades eléctricas y ópticas de nuevos complejos modificados de Niquel(II) del tipo (Ni(C17H25N4OL)((PF6)2 (con L = NH(CH2)2 NH2 (1a), NH(CH2)4NH2 (1b), NH(CH2)12NH2 (1c), NHC14 H6(O2)NH2 (1d). Los sólidos moleculares se sintetizaron a partir del macrociclo [Ni(C18H28N4O2)] (PF6)2 (1) y de aminas bidentadas como la etilendiamina, la 1,4-diaminobutano, 1,12-diaminododecano y 2,6-diaminoantraquinona.
Resultados y discusión
Los compuestos se forman primero por la metilación del complejo metoxiciclideno DADMTANi, [6,13-Ac 2-5,14-Me2- [14]-4,6,11,13-tetraenato-1,4,8,11-N4]Ni(II) [7], produciendo el derivado metil vinil eter (1) [8]. Posteriormente, se sustituye una de las posiciones con las diferentes aminas bidentadas (Fig. 1). La reacción depende fuertemente de la naturaleza de las aminas; se requieren tiempos de reacción mayores para aminas de mayor tamaño. Los compuestos tienden a descomponerse con el tiempo, debido a una posible reprotonación en presencia de humedad.

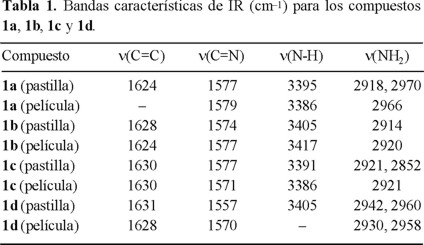
Las asignaciones de IR para estos compuestos, se muestran en la Tabla 1. Los espectros IR para todos los compuestos, presentan las vibraciones de estiramiento de los enlaces C=C y C=N, comunes en este tipo de compuestos [7, 9]. La vibración ν(N-H) indica la presencia de las diferentes aminas unidas al macrociclo. Además, aparece la vibración ν(NH2) que corresponde al grupo amina del extremo no enlazado, y que ha sido observada en complejos análogos reportados por Kumar y Katovic [10,11]. De acuerdo con esto último, las aminas bidentadas se unen únicamente a través de uno de sus extremos al complejo [Ni(C18H28N4O2)](PF6)2 (1) y no por sus dos extremos, como sucede en los complejos informados por Cairns y Busch [8], tratados con ligantes como 1,6-diaminohexano.
Por otra parte, los estudios de susceptibilidad magnética, indican que todos los complejos sintetizados (1a-1d) son diamagnéticos (0 MB). Por lo anterior, se infiere que la geometría alrededor del níquel(II) tetracoordinado, corresponde a un cuadrado plano como normalmente se observa en los compuestos tipo Jäger [12]. Adicionalmente, en los espectros UV-Vis se observa la transición d-d característica de la geometría cuadrado plana para el Ni(II) en la región del visible [13]. Estas se localizan en 21800 cm−1 para 1a, 24700 cm−1 para 1b, 25600 cm−1 para 1c y 25900 cm−1 para 1d.
Las mediciones de transmitancia IR en películas delgadas, se realizaron en películas depositadas sobre substratos de silicio monocristalino. Dichas medidas se obtuvieron con referencia a una oblea de silicio monocristalino, semejante a los usados como substratos de las películas. Debido a lo anterior; al obtener el espectro del sistema película-substrato, se realizó la sustracción del espectro del silicio sin película, corrigiendo la absorción del substrato. A través de los resultados de la espectroscopía IR en película delgada, se determinó la presencia de las vibraciones ν(C=C), ν(C=N), ν(N-H) y ν(NH2). De esta manera, se detecta si durante la evaporación térmica utilizada para la preparación de las películas, se llevan a cabo cambios químicos significativos en estos materiales. Los ligeros desplazamientos en la posición de las vibraciones de estiramiento no son significativos y se deben a los esfuerzos internos generados dentro de las películas delgadas [14] (Tabla 1).
Los espectros de rayos X obtenidos para cada uno de los compuestos en película delgada depositada sobre los diferentes substratos, no mostraron señales de cristalinidad; hecho que se explica debido a que cuando las moléculas llegan al substrato, que se encuentra a temperatura ambiente, no tienen la suficiente energía cinética como para tener una alta movilidad superficial. Por lo tanto, no se logra el orden de largo alcance característico de los cristales y se obtienen películas de naturaleza amorfa [14].
Propiedades eléctricas
Para cada uno de los compuestos obtenidos [Ni(C17H25N4 OL)](PF6)2 (L = etilendiamina (1a), 1,4-diaminobutano (1b), 1,12-diaminododecano (1c) y 2,6-diaminoantraquinona (1d) y la materia prima (1), se evaluó la variación de la corriente eléctrica a través de la muestra, como función de la temperatura, con un voltaje aplicado constante de 100 V, en el régimen óhmico, tanto en pastillas como en películas delgadas. De los resultados de estas mediciones, se determinaron los valores de la resistencia eléctrica que presentan estos materiales a temperatura ambiente. A partir de la resistencia eléctrica y utilizando las dimensiones de las pastillas y películas delgadas, se determinó la conductividad de los compuestos. En las Figs. número 2 y 3 se muestran las curvas de la corriente eléctrica como función de la temperatura obtenidas durante la medición entre −150ºC y 170ºC para cada compuesto, en película delgada y en pastilla.


En la Fig. 2 se observa que excepto el compuesto 1c, los compuestos en película delgada presentan el comportamiento correspondiente al de un material semiconductor. Se observa, por otro lado, que el compuesto 1c es el que presenta menor resistencia, lo que se asocia con un material altamente conductor, como lo demuestra el comportamiento de la corriente eléctrica casi constante a bajas temperaturas; por arriba de 15ºC el comportamiento observado se asocia con el de un conductor. Este efecto no se relaciona con cambios químicos en la estructura del compuesto (aun cuando estos materiales sean higroscópicos). A diferencia de las mediciones en pastilla, los compuestos presentan un comportamiento mas regular en película delgada. En estos materiales, la menor resistencia la presentan los compuestos con substituyentes voluminosos y de alto peso molecular como en 1c y 1d (con L = 1,12-diamino-dodecano y 2,6-diaminoantraquinona, respectivamente).
En la Fig. 3 se observa que los compuestos 1c y 1d presentan el comportamiento típico de un semiconductor a cualquier valor de temperatura. Por otro lado, el compuesto 1a presenta un comportamiento de semiconductor hasta valores cercanos a −40ºC y a temperaturas mayores, su comportamiento cambia drásticamente al de un conductor. Esto contrasta con lo observado en la materia prima; que a temperaturas superiores a −40ºC se comporta como semiconductor. Finalmente el compuesto 1b presenta una resistencia eléctrica constante a bajas temperaturas y a partir de aproximadamente 150ºC se comporta como semiconductor. En esta serie de compuestos, no se presenta un comportamiento similar entre ellos, esto se debe a que los compuestos pueden considerarse como higroscópicos y aunque las mediciones eléctricas se llevaron a cabo al vacío, es probable que durante la preparación y el manejo de la pastilla se hayan alterado dichos compuestos.
De los resultados de conductividad eléctrica obtenidos para los compuestos en película delgada que se muestran en la Tabla 2, se observa que todos los compuestos presentan conductividades eléctricas con magnitudes dentro del intervalo reportado en la literatura [2, 9] para los semiconductores moleculares (10-6 a 101 Ω-1cm−1).
En la Tabla 3 se muestran los valores de conductividad obtenidos para los compuestos en pastilla. Se observa que ninguno de los valores se encuentra dentro del intervalo de conductividad eléctrica a temperatura ambiente establecidos en la literatura. En general, en las mediciones de conductividad eléctrica de materiales en pastilla, se desconoce la trayectoria de la corriente eléctrica, por lo que se pueden observar diferencias en los valores de la conductividad que van de 6 a 10 órdenes de magnitud, respecto de aquellos obtenidos para los mismos materiales en película delgada, tal y como ha sido reportado por Metz y Hanack [15]. Este hecho explica las diferencias obtenidas entre los valores de la conductividad eléctrica obtenidos en pastilla y en película, del presente trabajo.
De acuerdo con estudios previos [16] sobre complejos DADMTANi-TCNQ, la conductividad en estos compuestos se debe básicamente a la planaridad de la molécula, a la presencia de electrones deslocalizados y al ion metálico de transición. Aparentemente el transporte de carga en estos materiales, ocurre a través de los iones Ni(II). Por otro lado, en estos materiales la mayor conductividad la presentan los compuestos con aminas voluminosas y de alto peso molecular. Este hecho contrasta con los estudios realizados por Metz y Hanack [15], que indican que la adición de compuestos voluminosos al macrociclo, tiende a disminuir la conductividad del mismo.
La conductividad en estos materiales puede ser explicada en tres etapas, que se diferencian claramente en las curvas ln I vs 1/KT (líneas rectas con diferentes pendientes [14]) para estos compuestos: a altas temperaturas, la conductividad se lleva a cabo debido a que la energía térmica es suficiente para excitar electrones a los estados extendidos en la banda de conducción y su movimiento es debido al campo eléctrico aplicado. En la segunda etapa a temperaturas mas bajas y denominada salto térmicamente asistido, los electrones en los estados localizados solo pueden contribuir a la conductividad si son capaces de adquirir energía suficiente para saltar de un estado localizado a otro (hopping). Finalmente, en la tercera etapa a temperaturas todavía mas bajas, son posibles otros dos procesos de salto. De la misma manera que en la segunda etapa, todavía puede tener lugar el salto térmicamente asistido desde estados próximos a la Energía de Fermi (EF) hasta sitios vecinos [17].
En la Tabla 4 se muestran los valores calculados para el índice de refracción, el espesor de las películas y la reflectancia óptica. Los valores de los índices de refracción indican que las películas de los materiales sintetizados presentan absorción óptica relativamente baja, así como una conductividad eléctrica que se puede asociar con semiconductores no degenerados. Por otro lado, dichos valores del índice de refracción hacen posible calcular la reflectancia óptica para cada compuesto.
De los espectros de transmisión óptica de los compuestos en película delgada, se obtuvieron los valores de coeficiente de absorción (α) como función de la energía del fotón (Efotón). Como se muestra en la Fig. 4, se puede observar un comportamiento similar en todos los compuestos. Dado que los materiales son de naturaleza amorfa, las propiedades ópticas de los mismos se analizan mediante el modelo de Tauc [13, 15].

En la Tabla 4 se muestran las energías de activación ópticas, así como las energías de activación de la conductividad eléctrica (Eac) que se obtienen de las mediciones de la corriente eléctrica con la temperatura. También se muestran los valores de la conductividad eléctrica a temperatura ambiente obtenidos en película para los diferentes compuestos. De los resultados obtenidos se observa que la energía de activación óptica, calculada según el modelo de Tauc, se puede asociar con la energía requerida para la fotogeneración de pares de portadores de carga electrón-hueco. Mientras que los valores de la energía de activación de la conductividad eléctrica, se pueden asociar con la energía necesaria para transferir un portador de carga desde un estado localizado en la cola de la banda de conducción, hasta un estado extendido en la banda de conducción, remontando el borde de movilidad entre estados localizados y estados extendidos.
Conclusiones
Los compuestos presentan de manera general, un comportamiento semiconductor y su conductividad eléctrica a temperatura ambiente, se encuentra dentro del intervalo establecido para esta clase de materiales. Los resultados obtenidos por espectroscopía IR, indican que la composición química de las películas es la misma que la de los sólidos moleculares sintetizados, por lo que se puede concluir que la técnica de evaporación térmica al vacío, es adecuada para la preparación de películas delgadas de este tipo de materiales. Dado que las películas delgadas preparadas para todos los compuestos son de naturaleza amorfa y dado que los valores calculados para la reflectancia óptica son relativamente pequeños, es posible la aplicación del modelo de Tauc para el análisis de propiedades ópticas. Esto permite determinar energías de activación óptica que se asocian con la fotogeneración de pares electrón-hueco. Por otro lado, las energías de activación de la conductividad eléctrica que coinciden con los resultados reportados [13] para compuestos similares, se asocian con la energía necesarias para deslocalizar electrones.
Parte experimental
Las materias primas se obtuvieron de fuentes comerciales y fueron utilizadas sin purificación previa. El diclorometano utilizado fue destilado en CaH2. Los demás disolventes empleados durante la síntesis, no fueron sometidos a un proceso de secado antes de su empleo. La preparación del complejo metoxiciclodeno DADMTANi, se llevó a cabo de acuerdo con la técnica propuesta por Busch y Riley [7]. Posteriormente, dicho complejo es transformado en 1, según la técnica propuesta por Corfield [9]. La caracterización de estos compuestos se realizó a través de análisis elemental (C, H y N), que fue realizado por Galbraith Laboratories Inc (Knoxville, TN); espectroscopía infrarroja, realizada en un espectrofotómetro IR Perkin Elmer modelo 282-B para pastillas (KBr) y en nujol y hexaclorobutadieno para muestras en suspensión. Los espectros UV-Vis fueron obtenidos en disolución de acetonitrilo, utilizando un espectrofotómetro UV-VIS, Shimadzu U160. La susceptibilidad magnética fue determinada en una Balanza de Susceptibilidad Magnética Johnson Matthey. La difracción de polvos se llevó a cabo en un difractómetro de polvos SIEMENS D5000 con radiación de cobre K∝, y monocromador de grafito a 1°(2ϑ/min). Adicionalmente, se prepararon películas delgadas de estos materiales mediante la técnica de evaporación térmica al vacío. Los depósitos se realizaron sobre diferentes substratos: vidrio pyrex, recubierto con electrodos de plata y de cromo sobre obleas de silicio monocristalino con orientación (100) y resistividad de 200 Ω cm. La caracterización de las películas delgadas, se realizó mediante mediciones de espectroscopía IR con un espectrofotómetro de transformada de Fourier (FT-IR), Nicolet 5-MX. El índice de refracción y el espesor de las películas se determinaron por elipsometría, utilizando un elipsómetro manual de ángulo variable Gaetner L117. Las medidas de transmisión óptica en el visible, fueron hechas con un espectrofotómetro Shimadzu 260 de doble haz, con aire en el haz de referencia. Para la medición de la variación de la corriente con la temperatura en pastilla y en película delgada, se empleó una fuente de voltaje Keithley 230 y un picoamperímetro Keithley 485, acoplados a un adquisidor de datos HP3421 y controlados con una computadora personal. Estas mediciones se realizaron a una presión de 10-3 torr.
[Ni(C17H25N4ONH(CH2)2NH2)](PF6)2*2H2O, 1a. Una muestra de 1.0 g (2.6 mmol) de 1, se disuelve en 40 mL de acetonitrilo y posteriormente se trata con 5 mL de etilendiamina (en exceso). La disolución se agita a temperatura ambiente hasta que la disolución cambia a color naranja-rojizo (8 h). La disolución se concentra en un rotavapor y se refrigera para obtener la cristalización del producto. Posteriormente se filtra y el precipitado amarillento formado se lava con metanol. La purificación por recristalización se lleva a cabo en una disolución 1:1 acetonitrilo-metanol. Rendimiento: 0.77 g (66%). P.f. = 270°C. Análisis elemental calculado: 50.11%C, 7.91%H y 18.46%N. Análisis obtenido: 50.92%C, 7.08%H y 18.00 %N. IR (pastillas KBr) cm−1: 2918, 2970 ν(NH2); 3395 ν(N-H); 1577 ν(C=N); 1624 ν(C=C).
[Ni(C17H25N4ONH(CH2)4NH2)](PF6)2*3H2O, 1b: Este compuesto se sintetizó de acuerdo al método descrito para 1a, a partir de 1.0 g (2.6 mmol) de 1 y un exceso de 1,4-diaminobutano (5 mL). Rendimiento 0.89 g (68.2%). P.f. = 306°C. Análisis elemental calculado: 50.30%C, 8.38%H y 16.77%N. Análisis obtenido: 50.50%C, 8.06%H y 16.66 %N. IR (pastillas KBr) cm−1: 2924 ν(NH2); 3405 ν(N-H); 1574 ν(C=N); 1628 ν(C=C).
[Ni(C17H25N4ONH(CH2)12NH2)](PF6)2*7H2O, 1c: Este compuesto se sintetizó de acuerdo al método descrito para 1a. Una muestra de 1.0g (2.6 mmol) de 1, disuelta en 40 mL de acetonitrilo y tratada con 1.04g de 1,12-diaminododecano (en exceso) previamente disuelto en 40 mL de acetonitrilo. Rendimiento 1.44g (76.3%). P.f. = 315°C. Análisis elemental calculado: 50.66%C, 9.61%H y 12.22%N. Análisis obtenido: 51.47%C, 9.20%H y 12.57%N. IR (pastillas KBr) cm−1: 2921, 2852 ν(NH2); 3391 ν(N-H); 1577 ν(C=N); 1630 ν(C=C).
[Ni(C17H25N4O(C14H10N2O2))](PF6)2*8H2O, 1d: Método semejante al empleado para 1c con una muestra de 1.0 g (2.6 mmol) de 1, disuelta en 40 mL de acetonitrilo. Se adicionan 0.6 mL (4.3 mmol) de trietilamina y posteriormente 1.24 g de 2,6-diaminoantraquinona (en exceso), previamente disuelta en 40 mL de acetonitrilo. Rendimiento de la reacción 1.62 g (77.8%). P.f. = 318°C. Análisis elemental calculado: 50.20%C, 6.75%H y 11.34%N. Análisis obtenido: 50.15%C, 6.28%H y 11.23 %N. IR (pastillas KBr) cm−1: 2942, 2960 ν(NH2); 3405 ν(N-H); 1577 ν(C=N); 1631 ν(C=C).
Referencias
1. Simon J.; Andre J. J. Molecular Semiconductors Photoelectrical Properties and Solar Cells. Springer Verlag, Berlin, 1985, pp 4-25. [ Links ]
2. Simon, J.; Tournillac, F. New J. Chem. 1987, 11, 383-399. [ Links ]
3. Castro, M. Cuadernos de Posgrado 26. Química Inorgánica V. Departamento de Química Inorgánica. Div. de Estudios de Posgrado, Facultad de Química, UNAM, 1986. [ Links ]
4. (a) Hanack, M.; Mitulla, K.; Pawlowski, G.; Subramanian, L. R. Angew. Chem. Int. Ed. Engl. 1979, 18, 322-323; [ Links ] (b) Schneider, O.; Hanack, M. Angew. Chem. Int. Ed. Engl. 1980, 19, 392-393; [ Links ] Day, P. Coord. Chem. Rev. 1999, 190-192, 827-839. [ Links ]
5. Cassox, P.; Valade, L. Molecular Inorganic Superconductors in Inorganic Materials. Duncan W. B.; O'Hare, D. compiladores. 1992, John Wileg & Sons LTD. [ Links ]
6. Korybut-Daszkiewicz, B.; Kojima, M.; Cameron, J. H.; Herron, N.; Chavan, M. Y.; Jircitano, A. J.; Coltrain, B. K.; Neer, G. L.; Alcock, N. W.; Busch, D. H. Inorg. Chem. 1984, 23, 903-914. [ Links ]
7. (a) Busch, D. H. Pure & Appl. Chem. 1980, 52, 2477-2484; [ Links ] (b) Riley, D. P.; Busch, D. H. Inorg. Synth. 1978, 18, 36-44. [ Links ]
8. Cairns, C. J.; Busch, D. H. Inorg. Synth. 1990, 27, 261-282. [ Links ]
9. Corfield, P. W. R.; Mokren, J. D.; Hipp, C. J.; Busch, D. H. J. Am. Chem. Soc. 1973, 95, 4465-4466. [ Links ]
10. Kumar, S.; Malhotra, R.; Dhindsa, K. S. Polyhedron 1992, 11, 1383-1385. [ Links ]
11. Katovic, V..; Taylor, L. T.; Busch, D. H. Inorg. Chem. 1971, 10, 458-462. [ Links ]
12. Soriano García, M.; Toscano, R. A.; Gómez Lara, J. Acta Cryst. 1985, C41, 1024-1026. [ Links ]
13. Busch, D. H. J. Chem. Educ. 1964, 41, 77-85. [ Links ]
14. Gonzalez Rolón, B, Tesis Doctoral, Instituto de Materiales, UNAM, 1996.
15. Metz, J.; Hanack, M. J. Am. Chem. Soc. 1983, 105, 828-830. [ Links ]
16. Bryce, M. R. J. Mater. Chem. 1995, 5, 1481-1496. [ Links ]
17. Lopez Morales, M. E.; Soriano García M.; Gómez Lara J.; Toscano, R. A. Mol. Cryst. Liq. Cryst. 1985, 125, 421-427. [ Links ]
Nota
* La presente contribución es uno de los últimos trabajos de investigación concluidos por el Dr. Jacobo Gómez Lara.




![Síntesis y caracterización de oligosilanos complejos en el sistema pentametilciclopentadienil dicarbonilo de fierro: [η5-C5(CH3)5]Fe(CO)2Si n(Si n = SiMe3; Si2Me5; Si3Me7; y 2-Si3Me7)](/img/es/prev.gif)









