Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agricultura técnica en México
versión impresa ISSN 0568-2517
Agric. Téc. Méx vol.34 no.4 México oct./dic. 2008
Artículos
Germinación y sobrevivencia de esclerocios de (Phymatotrichopsis omnivora) en respuesta a NaOCl y suelo con glucosa*
Germination and survival of (Phymatotrichopsis omnivora) sclerotia in response to NaOCl and dextrose in soil
José Alfredo Samaniego Gaxiola1§
1 Campo Experimental La Laguna, INIFAP. Boulevard José Santos Valdez No. 1200 Poniente. Col. Centro. C. P. 27440 Matamoros, Coahuila.
§ Autor para correspondencia:
samaniego.jose@inifap.gob.mx
*Recibido: Enero de 2007
Aceptado: Febrero de 2008
RESUMEN
Los esclerocios de Phymatotrichopsis omnivora pueden sobrevivir hasta 20 años en el suelo; sin embargo, cuando son expuestos a agentes fungistáticos y competencia microbiana sólo sobreviven algunas semanas. El objetivo de esta investigación fue estudiar la germinación y sobrevivencia de esclerocios tratados primero con NaOCl seguido de una competencia microbiana inducida por la adición de glucosa al suelo. Los estudios se llevaron a cabo en el Campo Experimental La Laguna del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias bajo un diseño factorial. Esclerocios de P. omnivora se sometieron a inmersión en soluciones con 200, 500 y 3 000 ppm de NaOCl durante 0.3, 1, 8 y 72 h en dos temperaturas 15–20 y 28 °C, después, se colocaron en el suelo adicionado con 0.0, 0.125, 0.25 y 0.5 mg de glucosa g–1 y se mantuvo el suelo saturado durante 14 días a 28 °C. El 90% de los esclerocios inmersos durante 20 min en NaOCl a 3000 ppm germinaron en arena estéril y PDA y sólo 15% en arena no estéril y PDA; sin embargo, la sobrevivencia sólo disminuyó 7% en arena no estéril. Cuando se utilizaron esclerocios germinados antes de ser inmersos en NaOCl la sobrevivencia fue de 100% en todos los sustratos. La sobrevivencia disminuyó al aumentar el tiempo de inmersión, concentración del NaOCl y de glucosa en el suelo. Se observó 20% de sobrevivencia máxima en los esclerocios inmersos más de una hora y 1 000 ppm de NaOCl con 0.25 o 0.50 mg de glucosa g–1 de suelo. La sobrevivencia de los esclerocios fue mayor en tratamientos a temperatura de 15–20 °C que en sus similares a 28 °C, debido posiblemente al efecto protector del NaOCl sobre los esclerocios expuestos a la microbiota inducida por la adición de glucosa al suelo.
Palabras clave: fungistasis, hongos fitopatógenos en suelo, suelo saturado.
ABSTRACT
Sclerotia of Phymatotrichopsis omnivora can survive for 20 years in the soil; however, if sclerotia are exposed to chemical agents or microbial competition in soil, survival is reduced to few weeks. The objective of this research was to study the germination and survival of P. omnivore sclerotia, treated first with a solution of NaOCl and then exposed to microbiota competition in soil supplemented with dextrose. The experiments were carried out at 'La Laguna' Research Station of the National Research Institute for Forestry, Agriculture and Livestock under a completely random factorial design.
Sclerotia were immersed in 200, 500 and 3 000 ppm NaOCl solutions during 0.3, 1, 8, and 72 h. at two temperatures, 15–20 and 28 °C, afterwards were placed in soil added with 0.0, 0.125, 0.25 and 0.5 mg g–1 of dextrose during 14 days under saturated conditions at 28 °C. Sclerotia immersed into a 3 000 ppm solution of NaOCl during 20 min showed 90% germination in sterile sand and PDA and only 15% in non–sterile sand and PDA. When sclerotia were germinated before being immersed in NaOCl, viability was 100% in all substrates utilized. Survival of sclerotia decreased with the increase in the time of immersion, concentration of NaOCl, and concentration of dextrose added to the soil. Sclerotia immersed during one hour or more in 1 000 ppm or higher of NaOCl solution and placed in soil with 0.25 or 0.5 mg g–1 of added dextrose showed a maximum survival of 20%. Sclerotia survival was high in some treatments at 15–20 °C than in similar treatments at 28 °C, possible due to a protective effect of NaOCl on sclerotia exposed to soil microbiota enhanced by added dextrose.
Key words: fungistasis, saturated soil, soilborne fungi.
INTRODUCCIÓN
Phymatotrichopsis omnivora (Dugg.) Hennebert, es un hongo que causa importantes pérdidas económicas en decenas de cultivos agrícolas, ya que disminuye el rendimiento o en casos extremos mata a las plantas, (Mulrean et al., 1984; Samaniego y Herrera, 2003) e incluso, limita la siembra de algunos cultivos en regiones enteras, como la alfalfa Medicago sativa L. en parte del estado de Texas (Prostko et al., 1998) o pistacho Pistacia vera L. en La Laguna (Medina y Lagarda, 1979). Por su distribución e importacia se considera que el estudio de este hongo debe efectuarse con nuevos enfoques que aporten soluciones para su control (Fundación Noble, 2005).
Los esclerocios de P. omnivora pueden sobrevivir en el suelo hasta 20 años (Streets y Bloss, 1973); en contraste, en la fase de micelio difícilmente sobrevive más de un año (Wheeler y Hine, 1972). No obstante que el micelio de este hongo es muy suceptible a los fungicidas como el propiconazole a 1 ppm in vitro (Whitson y Hine, 1986), los esclerocios una vez germinados pueden tolerar 500 ppm de varios fungicidas sin afectar su tasa de respiración (Lyda y Burnett, 1970). Asimismo, los esclerocios de P. omnivora son tolerantes a decenas de fungicidas en concentraciones de 100 a 10 000 ppm y únicamente dos fungidas mercuriales afectaron la sobrevivencia a entre 1 y 5 ppm (Hine et al., 1969).
El micelio del hongo es más suceptible al amoniaco que los esclerocios y los esclercocios son menos susceptibles al amoniaco in situ que in vitro, requiréndose 276 ppm de amoniaco en el suelo in situ para disminuir en 79% la sobrevivencia (Rush y Lyda, 1982). En suma, el esclerocio es la fase más tolerante que le permite al hongo sobrevivir; sin embargo, los esclerocios son más susceptibles al ataque de la microbiota nativa del suelo, cuando ésta es favorecida por medio de la adición de carbohidratos solubles y el suelo es saturado; en contraste, los esclerocios toleran altos niveles de competencia microbiana (inducida por la adición de carbohidratos en suelo) en suelo no saturado (Samaniego, 1992; Samaniego y Rivera, 1992).
Algunos hongos fitopatógenos no sobreviven cuando se adicionan residuos orgánicos o fertilizantes al suelo o se da una condición cercana a la saturación (Blok et al., 2000); sin embargo, las cantidades de fertilizantes o carbohidratos solubles requerido para matar a los hongos fitopatógenos considerables, lo que hace impráctica su aplicación.
Una técnica para disminuir la cantidad de residuos orgánicos o fertilizantes consiste en predisponer a los hongos mediante el uso de dosis subletales de fumigantes como el NaOCl, inducir cambios de temperatura, alternar ciclos de humedecimiento y secado del suelo, favorecer los exudados de la raíz, entre otros; de tal forma que, al romper la latencia de los esclerocios de P. omnivora, es posible que aumente su susceptibilidad para ser atacado por la microbiota del suelo (Coley–Smith, 1979; Henis, 1979; Henis y Papavizas, 1983; Hyakumachi y Lockwood, 1989; Samaniego y Rivera, 1992; Mondal y Hyakumachi, 1998). La latencia de los esclerocios de P. omnivora puede romperse al entrar en contacto con NaOCl (Samaniego y Rivera, 1992) y su destrucción puede inducirse al agregar carbohidratos solubles al suelo como la sacarosa y glucosa (Samaniego, 1992 y 1994).
Sin embargo, no se conoce la interacción de ambos factores sobre la germinación y sobrevivencia de los esclerocios de P. omnivora. Por lo tanto, el objetivo de este trabajo fue determinar la respuesta de la germinación y sobrevivencia de esclerocios tratados con inmersiones en NaOCl y colocados en suelo adicionado con glucosa en condición de saturación.
MATERIALES Y MÉTODOS
Reproducción y manejo de los esclerocios. En frascos de vidrio de 1 L se mezcló 600 mL de arena cernida en tamiz malla 16 con 1.8 g de carbono activado, luego se añadió encima 120 mL de grano de Sorghum bicolor (L.) Moench, previamente humedecido por dos días en agua destilada. Posteriormente, se vertió agua destilada hasta saturar el suelo. Los frascos fueron esterilizados durante una hora dos días consecutivos y luego se les añadió micelio (1/2 placa) de P. omnivora de 15 días de crecido en medio de cultivo papa dextrosa agar (PDA) a 28 °C. Los frascos inoculados se incubaron entre 9 y 12 semanas antes de utilizarse. En todos los experimentos se utilizaron esclerocios reproducidos de la manera señalada, excepto en los tres últimos en los que se utilizó grano de sorgo recién cosechado. Posteriormente, todos los esclerocios colectados de los frascos de reprodución se sumergieron en agua destilada y se almacenaron a 10 °C hasta que se utilizaron. En ningún caso se utilizaron esclerocios con más de dos meses de estar almacenados.
Esclerocios en NaOCl
Se diluyó 20 veces hipoclorito de sodio comercial al 6% para obtener una solución a 3000 ppm. Viales con 25 esclerocios fueron inmersos en la solución durante 0, 5, 10, 15 y 20 min, enseguida se extrajeron y se colocaron sobre papel secante y posteriormente se depositaron en cajas petri que contenían PDA, arena estéril y arena no estéril y se incubaron durante 14 días a 28 °C. Después de cinco días de incubación se determinó el por ciento de germinación de los esclerocios y a los 14 días, la sobrevivencia. Los esclerocios no sobrevivientes fueron los incapaces de formar cordones y estar invadidos por otros microorganismos (Samaniego, 1994). Para cada período de tratamiento se establecieron cuatro repeticiones, se utilizaron 25 esclerocios por repetición. Esclerocios previamente germinados fueron tratados con NaOCl en la concentración y períodos señalados; posteriormente se les determinó la germinación y sobrevivencia.
Esclerocios en NaOCl y suelo con glucosa
Los esclerocios se colocaron en el fondo de frascos cilíndricos de 10 cm de diámetro y un volumen de 750 mL. En seguida, a cada frasco se añadió 400 g de arena y encima 80 mL de soluciones de glucosa (grado alimenticio) en proporciones 0.0, 0.5, 1.0 y 2.0 mg g–1 de arena. La arena se saturó con 80 mL de agua destilada; los frascos se incubaron por 14 días a 28 °C. Después, se extrajeron los esclerocios y se determinó su sobrevivencia.
Dosis x tiempo de inmersión en NaOCl, temperaturas
Se realizaron tres experimentos, uno para cada concentración de 100, 500 y 3 000 ppm de NaOCl comercial. En cada solución se trataron esclerocios durante 0.3, 1, 8 y 72 h a temperatura de laboratorio (15–20 °C). Posteriormente, se colocaron 25 esclerocios por frasco de 0.75 L y a cada uno se le adicionó 400 g de arena cernida en tamiz malla 16. Posteriormente, se adicionó glucosa a razón de 0.0, 0.25, 0.5 y 1.0 mg g–1arena. La glucosa se añadió en una solución de 80 mL por frasco y otros 80 mL de agua destilada se añadieron para saturar el suelo. En seguida se incubó durante 14 días a 28 °C. Luego los esclerocios se extrajeron y se determinó su sobrevivencia.
Análisis estadístico
Todos los experimentos se realizaron dos veces excepto el de dosis por tiempo de inmersión en NaOCl y temperaturas el cual se realizó sólo una vez. La sobrevivencia de los esclerocios se expresó como porcentaje. Cada experimento fue analizado con diseño experimental completamente al azar y arreglo factorial; donde los factores fueron tiempo de inmersión de los esclerocios y dosis de glucosa añadida al suelo. Se aplicó la transformación arco–seno a los porcentajes de germinación antes de su análisis estadístico. Las medias de tratamientos fueron separadas con la DMS p < 0.01. Los análisis estadísticos se realizaron con el programa SAS (SAS Institute, 1988).
RESULTADOS
Esclerocios tratados con NaOCl. A los cinco días los esclerocios germinaron casi al 100% después de permanecer en NaOCl y ser colocados en PDA o arena estéril, pero sólo entre 0 y 46% al colocarse en arena no estéril (Cuadro 1). El menor por ciento de germinación de los esclerocios observado en areno no estéril fue significativamente diferente al resto de los sustratos (Cuadro 2). La germinación de los esclerocios después de 20 min de inmersión en NaOCl y permanecer durante cinco días en PDA y en arena estéril fue simultánea y uniforme en toda su superficie (Figuras 1 y 2); entre tanto, los esclerocios colocados en arena no estéril germinaron sólo en algunas partes de la superficie formando cordones miceliales (Figura 3).
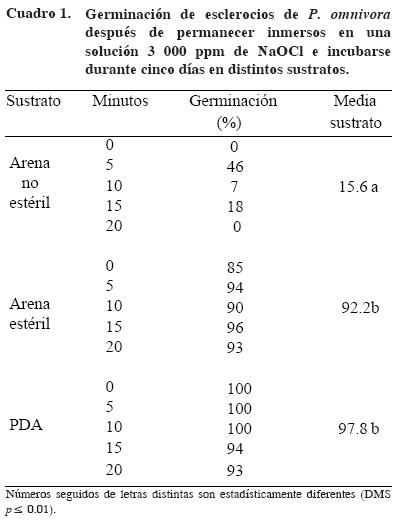




La sobrevivencia de los esclerocios fue afectada por dos factores: el sustrato arena no estéril y el período de inmersión en NaOCl. El 100% de los esclerocios colocados en arena estéril y PDA sobrevivieron. La sobrevivencia mínima de los esclerocios fue de 85% con 20 min de inmersión en NaOcl y colocados en arena no estéril.
Esclerocios en NaOCl y suelo con glucosa. La sobrevivencia de los esclerocios disminuyó al aumentar el tiempo de inmersión en NaOCl y la concentración de glucosa (Figura 4). Ambos, tiempo de inmersión en NaOCl y concentración de glucosa en suelo repercutieron significativamente en la sobrevivencia de los esclerocios y 1.0 mg de glucosa g–1 redujo al 40% la sobrevivencia de los esclerocios no inmersos en NaOCl. La glucosa en el suelo de 0.0 hasta 1.0 mg g–1 redujo la sobrevivencia de los esclerocios sólo cuando estos permanecieron por lo menos 10 min en NaOCl (Figura 4). Los esclerocios germinados que posteriormente se expusieron a NaOCl y se incubaron en suelo hasta con 1 mg g–1 de glucosa lograron sobrevivir al 100%.

Concentración de glucosa por tiempo de inmersión en NaOCl y temperaturas. El análisis de varianza fue significativo (p < 0.001) para las variables tiempo de inmersión, dosis de glucosa y su interacción (experimentos I a VI); excepto en el experimento II en donde la interacción no mostró significancia, (Cuadro 3). Por tanto, los factores y su interacción influyeron en la sobrevivencia de los esclerocios, misma que disminuyó al aumentar el tiempo de inmersión en NaOCl y la dosis de glucosa en el suelo. Los esclerocios que permanecieron inmersos durante 72 h en 200 ppm de NaOCl entre 15 – 20 °C y colocados en suelo con todas las dosis de glucosa (experimento I) alcanzaron una sobrevivencia entre 80 y 96% (Cuadro 4); un comportamiento similar en la sobrevivencia de los esclerocios se observó en el experimento IV, excepto cuando se añadió 1 mg g–1 de glucosa en suelo, en cuyo caso los esclerocios sobrevivieron 5%.

En el experimento III, la sobrevivencia de los esclerocios fue del 86 al 97% en el tratamiento de 0.3 h de inmersión en NaOCl a cualquier dosis de glucosa; en el resto de los tratamientos, la sobrevivencia de los esclerocios disminuyó alaumentar su tiempo de inmersión en el NaOCl y la dosis de glucosa en el suelo. Cuando los esclerocios permanecieron 8 h o más en NaOCl a 3 000 ppm se observó un efecto tóxico, que se tradujo en una nula sobrevivencia.
La sobrevivencia de los esclerocios en el experimento (I) alcanzó el valor mínimo entre 0.3 y 1 h de inmersión en 200 ppm de NaOCl y paradójicamente alcanzó valores superiores a las 72 h (Figura 5, A, C, E y G). En el experimento IV se observó mayor sobrevivencia a las 72 h similar a la del experimento I (excepto en el tratamiento 1.00 mg g–1 glucosa en suelo), aunque la menor sobrevivencia de los esclerocios se observó a las 8 h (Figura 5, B, D y F).
DISCUSIÓN
El NaOCl rompe la latencia de los esclerocios de P. omnivora y la germinación ocurrió por múltiples puntos cuando permanecieron en arena estéril y PDA; en contraste, en arena no estéril el hongo germinó por sitios determinados formando cordones miceliales, lo que sugiere que la microbiota circundante inhibió en parte la germinación y afectó la sobrevivencia. Los esclerocios de Sclerotium rolfsii Sacc. pueden germinar de manera eruptiva e hifal, la primera se caracteriza por ser en múltiples puntos, mientras la segunda es restringida a sitios determinados en los que se parecía la formación de cordones miceliales (Punja y Grogan, 1981). Por tanto, los esclerocios de P. omnivora pueden germinar en forma hifal o eruptivamente de manera similar a los de S. rolfsii (Punja y Grogan, 1981).
El proceso de germinación de los esclerocios deP. omnivora podría ser crítico para su sobrevivencia posterior, en esta investigación se observó que los esclerocios previamente germinados e inmersos en NaOCl no perdieron en absoluto su sobrevivencia. Si bien, en este estudio únicamente se analizó con esclerocios germinados inmersos en NaOCl a 3 000 ppm hasta 20 min, sería necesario incrementar el tiempo de inmersión para determinar la sobrevivencia al efecto del NaOCl y posiblemente a otros compuestos tóxicos, así como a la competencia inducida en suelo adicionado o no con glucosa.
A menor temperatura, los hongos toleran más las condiciones adversas y sobreviven más, que a temperaturas más elevadas (Samaniego, 1994; Mondal y Hyakumachi, 1998). Posiblemente, las temperaturas entre 10 – 20 °C donde permanecieron inmersos los esclerocios 72 h en NaOCl a 200 ppm (experimento I), permitió la absorción del compuesto lo suficiente paraquedar protegido del ataque de la microbiota en el suelo adicionado hasta con 1 mg g–1 de glucosa, otra causa pudo ser consecuencia de la promoción de la latencia del esclerocio, o bien, que el NaOCl tomado por el esclerocio fue posteriormente liberado lo que inhibió a la microbiota circundante.
La condición de saturación disminuye la sobrevivencia de hongos fitopatógenos que habitan el suelo. Hongos de los géneros Fusarium, Phymatotrichopsis, Sclerotium y Verti–cillium pueden sobrevivir de 5 a 20 años en el suelo (Street y Bloss, 1973; Henis, 1979; Pullman y DeVay, 1982; Crowe y Debons, 1992), pero cuando el suelo se inunda seis meses o menos (Taubenhaus et al., 1931; Stover, 1955; Pullman y DeVay, 1982) y a quince días en suelos adicionados con carbohidratos solubles (Menzies, 1962; Watson, 1965; Samaniego, 1994). Los hongos fitopatógenos Fusarium, Sclerotium y Phymatotrichopsis en suelo inundado o saturado pierden sus reservas y mueren o son susceptibles para ser destruidos por la microbiota del suelo (Hyakumachi et al., 1987; Hyakumachi y Lockwood, 1989; Samaniego, 1994; Mondal et al., 1995; Mondal y Hyakumachi, 1998).
La glucosa es el principal nutrimento que promueve la actividad metabólica y el crecimiento de las poblaciones de microorganismos en el suelo (Alexander, 1980; Alden et al., 2001). De hecho, varias compostas son supresivas parahongos fitopatógenos cuando tienen altas cantidades de carbohidratos solubles como la glucosa (Chen et al., 1988 a y b; Bohem y Hoitink, 1992). Por tanto, la presencia de carbohidratos solubles, contenidos en compostas, abonos orgánicos u otros, parece ser indispensable para incrementar los microorganismos en el suelo que potencialmente pueden destruir a los hongos fitopatógenos.
Los carbohidratos son los compuestos orgánicos más abundantes en el suelo (Cheshire, 1977) y parecen ser responsables de la resistencia del maíz hacia P. omnivora (Eaton y Rigler, 1946). Concentraciones de 2.0 mg g–1 de glucosa inducen la muerte del 100% de los esclerocios de P. omnivora sólo si el suelo es inundado (Samaniego, 1994). El uso del NaOCl como un compuesto aplicado al suelo es impráctico, aunque, en el laboratorio se ha utilizado como un compuesto para entender el mecanismo de latencia y germinación de S. rolfsii (Punja y Grogan, 1981; Henis y Papavizas, 1983).
Otros compuestos generados en el suelo podrían predisponer a los hongos fitopatógenos al ataque por lamicrobiota, entre ellos, los ácidos orgánicos volátiles que se producen cuando los microorganismos fermentan los carbohidratos contenidos en abonos orgánicos, compostas o residuos de cosecha añadidos al suelo. Los ácidos orgánicos volátiles son generados en el suelo bajo condiciones de inundación (Alexander, 1980), y podrían reducir la sobrevivencia de los esclerocios de P. omnivora (Samaniego, 1992). Recientemente se asoció la pérdida de sobrevivencia de Verticillium dahliae Kleb. con los ácidos orgánicos volátiles (Conn et al., 2005). El estudio de la predisposición de varios géneros de hongos fitopatógenos en el suelo se piensa que es relevante para el desarrollo posterior de estrategias de control biológico (Mondal y Hyakumachi, 1998), ya que algunos géneros tienen similitudes onto–fisiológicas (Coley–Smith, 1979).
Diferentes clases de esclerocios de hongos fitopatógenos distintos a P. omnivora son estimulados para que germinen por factores físicos como la temperatura, químicos como el NaOCl, biológicos como exudados de plantas, lo que determina también su diferenciación y capacidad para atacar plantas cultivadas susceptibles (Punja y Jenkins, 1984; Sanogo y Pennypacker, 1997; Matheron y Porchas, 2005).
Las variaciones de temperatura a las que se sometieron los esclerocios en los experimentos I a III (10 – 20 °C), podrían afectar la susceptibilidad al NaOCl y posterior respuesta a la incubación en suelo adicionado con glucosa, si bien, al respecto no se tiene información, lo que podría ser tema de estudios posteriores. Se consignó que Verticillium dahliae responde a cambios de temperatura los cuales inducen una pérdida de su sobrevivencia (Hawke y Lazarovits, 1994), de tal manera que si son almacenados a temperatura constante (–70 a 24 °C) durante 1 a 10 semanas y luego son colocados a germinar su sobrevivencia no se afecta en absoluto, pero si las temperaturas de almacenamiento oscilan la sobrevivencia disminuye conforme se incrementa el tiempo.
CONCLUSIONES
La latencia de los esclerocios de P. omnivora se suspende por efecto del NaOCl lo cual se manifiesta en una germinación más rápida, aunque ello ocurre en función del período de inmersión, de la concentración de éste y del sustrato en el que germinen.
Los esclerocios expuestos a NaOCl mostraron germinación hifal caracterizada por la formación de cordones miceliales, o una germinación por múltiples sitios o eruptiva; la primera se manifestó en arena no estéril y la segunda en arena estéril o PDA.
La sobrevivencia de los esclerocios a concentración de 200 ppm y tiempo de exposición de 72 h, sugieren que: el esclerocio absorbe el NaOCl y queda protegido del ataque de la microbiota; el NaOCl promueve la latencia del esclerocio, o bien, que el NaOCl es absorbido y posteriormente liberado por el esclerocio inhibiendo a la microbiota circundante.
LITERATURA CITADA
Alden, I.; Demoling, F. and Bååth, E. 2001. Method of determining factors limiting bacterial growth in soil. Appl. & Environm. Microbiol. 67:1830–1838. [ Links ]
Alexander, M. 1980. Introduction to soil microbiology. 2ed. John Wiley and Sons. New York, USA. 467 p. [ Links ]
Blok, W. J.; Lamers, J. G.; Termorshuizen, A. J. and Bollen, G. J. 2000. Control of soilborne plant pathogens by incorporating fresh organic amendments followed by taping. Phytopathology 90:253–259. [ Links ]
Bohem, M. J. and Hoitink, H. A. J. 1992. Substance of microbial activity in potting mixes and its impact on severity of Pythium root rot poinsettia. Phytopathol. 82:259–254. [ Links ]
Chen, W.; Hoitink, H. A. J. and Madden, L. V. 1988 a. Microbial activity and biomass in container media for predicting suppressiveness to damping–off caused by Pythium ultimum. Phytopathol. 78:1447–1450. [ Links ]
Chen, W.; Hoitink, H. A. J.; Schmittenner, A. F. and Tuovinen, O. H. 1988 b. The role of microbial activity in suppression of damping–off caused by Pythium ultimum. Phytopathol. 78:314–322. [ Links ]
Cheshire, M. V. 1977. Origins and stability of polysaccharide. J. Soil Sci. 28:1–10. [ Links ]
Coley–Smith, J. R. 1979. Survival of plant pathogenic fungi in soil the absence of host plants. p. 39–57. In: Schippers, B., and Gams, W. (eds.). Soil–borne plant pathogens. Academic Press, London, 686 p. [ Links ]
Conn, L. K.; Tenuta, M. and Lazarovits, G. 2005. Liquid swine manure can kill Verticillium dahliae microsclerotia in soil by volatile fatty acid, nitrous acid, and ammonia toxicity. Phytopathol. 95:28–35. [ Links ]
Crowe, F. J. and Debons, J. 1992. Effect of in season flooding on white rot of garlic and survival of Sclerotium cepivorum. Phytopathol. 82:1108 (Abstract). [ Links ]
Eaton, F. M. and Rigler, N. E. 1946. Influence of carbohydrate levels and root surface microfloras on Phymatotrichum root rot in cotton and maize plants. J. Agric. Res. 72:137–161. [ Links ]
Fundación Noble, 2005. http://www.noble.org/Events/Medicago2005/premeeting.html. [ Links ]
Hawke, M. A. and Lazarovits, G. 1994. Production and manipulation of individual microesclerotia of Verticilluim dahliae for use in studies of survival. Phytopathol. 84:883–890. [ Links ]
Henis, Y. 1979. Relationship between metabolism, morphogenesis, survival and parasitism in sclerotial soil–borne pathogenic fungi. p. 59–71. In: Schippers, B., and Gams, W. (eds.). Soil–Borne Plant Pathogens. Academic Press, London, 686 p. [ Links ]
Henis, Y. and Papavizas, G. C. 1983. Factors affecting germinability and susceptibility to attack Trichoderma harzianum in field soil. Phytopathol. 73:1469–1474. [ Links ]
Hine, R. B.; Jhonson, D. L. and Wenger, C. J. 1969. The persistency of two benzimidazole fungicides in soil an their fungistatic activity against Phymatotrichum omnivorum. Phytopathology 59:798–801. [ Links ]
Hyakurnachi, M.; Loffler, H. J. M. and Lockwood, J. L. 1987. Decreased aggressiveness of Sclerotium rolfsii sclerotia in response to nutriment stress in soil. Phytopathol. 77:1758 (Abstract). [ Links ]
Hyakurnachi, M. and Lockwood, J. L. 1989. Relation of carbon loss from sclerotia of Sclerotium rolfsii during incubation in soil to decreased germinability and pathogenic aggressiveness. Phytopathol. 79:1059–1063. [ Links ]
Lyda, S. D. and Burnett, E. 1970. Influence of benzimidazole fungicides on Phymatotrichum omnivorum and Phymatotrichum root rot of cotton. Phytopathol. 60:726–728. [ Links ]
Matheron, M. E. and Porchas, M. 2005. Influence of soil temperature and moisture on eruptive germination and viability of sclerotia of Sclerotinia minor and S. sclerotiorum. Plant Dis. 89:50–54. [ Links ]
Medina, M. M. del C., y Lagarda, M. A. 1979. Pruebas de adaptación de tipos de criollos y cultivares de pistacho (Pistasia vera) bajo las condiciones ecológicas de la Comarca Lagunera. Informe de Investigación Agrícola en Fruticultura. Campo Agrícola Experimental La Laguna. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP)–Secretaría de Agricultura y Recursos Hidráulicos (SARH). Matamoros, Coahuila, México. p. 17– 35. [ Links ]
Menzies, I. D. 1962. Effect of anaerobic fermentation in soil on survival of sclerotia of Verticillium dahliae. Phytopathol. 52:743. (Abstract). [ Links ]
Mondal, S. N.; Kageyama, K. and Hyakumachi, M. 1995. Germinability, viability, and virulence of chlamydospores of Fusarium solani f. sp. phaseoli as affected by the loss of endogenous carbon. Phytopathol. 85:1238–1244. [ Links ]
Mondal, S. N. and Hyakumachi, M. 1998. Carbon loss and germinability, viability, and virulence of chlamydospores of Fusarium solani f. sp.phaseoli after exposure to soil at different pH levels, temperatures, and matric potentials. Phytopathol. 88:148–155. [ Links ]
Mulrean, E. N.; Hine, R. B. and Mueller, J. P. 1984. Effect of Phymatotrichum root rot on yield and seed and lint quality in Gossypium hirsutum and G. barbadense. Plant Dis. 68:381–383. [ Links ]
Prostko, P. E.; Muir, P. J.; Vestal, M. D., and Stokes, R. S. 1998. Alfalfa variety performance in central Texas. http://stephenville.tamu.edu/~butler/foragesoftexas/ForageResearch/1998/alfalfa_performance.pdf [ Links ]
Pullman, G. S. and DeVay, J. E. 1982. Effect of soil flooding paddy rice culture on the survival of Verticillium dahliae and incidence of Verticillium wilt in cotton. Phytopathol. 72:1285–1289. [ Links ]
Punja, Z. K. and Grogan, R. G. 1981. Mycelial growth and infection without a food base by eruptibely germinating sclerotia of Sclerotium rolfsii. Phytopathol. 71:1099–1103. [ Links ]
Punja, Z. K. and Jenkins, S. F. 1984. Influence of temperature 0moisture, modified gaeous atmosphere, and depth in soil on eruptive sclerotial germination of Sclerotium rolfsii. Phytopathol. 74:749–754. [ Links ]
Rush, C. M. and Lyda, S. D. 1982. Effects of anhydrous ammonia on mycelium and sclerotia Phymatotrichum omnivorum. Phytopathol. 72:1085–1089. [ Links ]
Samaniego, G. J. A. 1992. Relación entre el nivel de humedad y sacarosa en el suelo y la disminución de la sobrevivencia de los esclerocios de Phymatotrichum omnivorum. Rev. Mex. Fitopatol. 10:126–133. [ Links ]
Samaniego, G. J. A. y Rivera, G. M. 1992. Factores que afectan la sobrevivencia de los esc1erocios de Phymatotrichum omnivorum y su susceptibilidad a Trichoderma sp. Rev. Mex. Fitopatol. 10:116–125. [ Links ]
Samaniego, G. J. A. 1994. Sobrevivencia de los esclerocios de Phymatotrichum omnivorum (Shear) Dugg. en suelos inundados y complementados con glucosa. Rev. Mex. Fitopatol. 12:125–133. [ Links ]
Samaniego, G. J. A. y Herrera, P. T. 2003. Producción de Nuez en Nogales [Carya illinoensis (Wangenh.) K.] atacados por Phymatotrichopsis omnivora (Dugg.) Hennebert. Rev. Mex. Fitopatol. 21:326–333. [ Links ]
Sanogo, S. and Pennypacker, S. P. 1997. Factors affecting sporogenic and myceliogenic germination of sclerotia of Colletotrichum coccodes. Plant Dis. 81:333–336. [ Links ]
Statistical Analysis System Insitute (SAS Institute), Inc. 1988. SAS/STAT user's guide. Relase 6.03 edition. SAS Insitute. Cary, North Carolina, USA. 1028 p. [ Links ]
Stover, R. H. 1955. Flood–fallowing for eradication of Fusarium oxysporum f cubense. III. Effect of oxygen on fungus survival. Soil Science 80, 397–412. [ Links ]
Streets, R. B. and Bloss, H. E. 1973. Phymatotrichum Root Rot. Phytopathological Monograph 8, American Phytopathological Society. St. Paul, MN, USA. 38 p. [ Links ]
Taubenhaus, J. J.; Ezekiel, W. N. and Lusk, J. P. 1931. Preliminary studies on the effect of flooding on Phymatotrichum root rot. Amer. J. Bot.18:95–101. [ Links ]
Watson, R. D. 1965. Eradication of soil fungi by combination of crop residues, flooding, and anaerobic fermentation. Phytopathol. 55:1437–1438. [ Links ]
Wheeler, J. E. and Hiñe, R. B. 1972. Influence of soil temperature and moisture on survival and growth of strands of Phymatotrichum omnivorum. Phytopathol. 62:828–832. [ Links ]
Whitson, R. S. and Hine, R. B. 1986. Activity of propiconazole and other sterol–inhibiting fungicides against Phymatotrichum omnivorum. Plant Dis. 70:130–133. [ Links ]














