Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agricultura técnica en México
versión impresa ISSN 0568-2517
Agric. Téc. Méx vol.34 no.3 México jul./sep. 2008
Artículos
Posición de la umbela, vernalización, ácido giberélico y fecha de plantación en la germinación de zanahoria*
Umbel position, vernalization, giberelic acid and date of planting on carrot germination
José Antonio Rangel–Lucio1 , José Guadalupe García Rodríguez1, Francisco Chablé Moreno1, Edmundo García–Moya2, Gabriel Alcántar González2 y Mariano Mendoza Elos1
, José Guadalupe García Rodríguez1, Francisco Chablé Moreno1, Edmundo García–Moya2, Gabriel Alcántar González2 y Mariano Mendoza Elos1
1 Instituto Tecnológico de Roque–DGEST–SEP. km 8 carretera Celaya–Juventino Rosas, C. P. 38110. Celaya, Guanajuato, México.
2 Posgrado en Botánica, Colegio de Postgraduados
 Autor para correspondecia:
Autor para correspondecia:
arangel_1@yahoo.com
* Recibido: Noviembre de 2006
Aceptado: Diciembre de 2007
RESUMEN
El objetivo de este estudio fue determinar el efecto de diferentes períodos de vernalización, acondicionamiento con ácido giberélico de la raíz y fecha de plantación en la germinación de la semilla de zanahoria (Daucus carota L.) de tres estratos umbelares. El experimento se estableció en el Campo Experimental del Instituto Tecnológico de Roque en Celaya, Guanajuato, México. Raíces del cv. Nantes se vernalizaron a 4.0 °C durante 0, 20 y 40 días. Se acondicionaron con 50, 100 y 150 ppm de ácido giberélico y se plantaron el 22 de febrero, 4 y 22 de marzo de 2003. La semilla se cosechó 180 días después de la plantación del primero, segundo y tercer estrato umbelar y se les determinó el porciento de germinación. Se utilizó un diseño experimental de bloques al azar con arreglo en parcelas subdivididas con cuatro repeticiones. Los resultados mostraron 86% de germinación en las semillas de umbelas primarias plantadas el 22 de febrero con tratamiento de vernalización. En las semillas de umbelas secundarias, la vernalización de la raíz durante 40 días y el testigo, mostraron 81.67 y 81.97% de germinación, respectivamente. En la semilla de umbelas terciarias, el tratamiento de la raíz con 100 ppm de ácido giberélico mostró 78% de germinación. No obstante que los resultados mostraron diferencias estadísticas entre la fecha de plantación, vernalización y acondicionamiento con ácido giberélico, éstas no fueron agronómicamente relevantes.
Palabras clave: Daucus carota L., calidad de semilla de zanahoria, umbelas primaria, secundaria y terciaria.
ABSTRACT
The objective of this study was to determine the effect of planting date, vernalization and conditioning with giberelic acid of three levels in the seed stalk on the seed germination of carrot root (Daucus carota L.). The study was carried out at the Instituto Tecnologico de Roque experimental station at Celaya, Guanajuato, Mexico. Carrot roots of cv. Nantes were vernalized at 4 °C during 0, 20 and 40 days. Subsecuently, were conditioned with 50, 100 and 150 ppm of giberelic acid and planted on February 22, March 4 and March 22, 2003. Seed was harvested at 180 days after planting from the first, second and third umbel level and seed germination determinated by standard procedures. A complete random block design arranged in subdivided plots and four replications was used. Results showed 86% germination in seeds from the first umbel level planted on February 22 with vernalization. No difference was observed in seeds from the second umbel level vernalized during 40 days and the control, with germination of 81.67 and 81.97%, respectively. Seeds from the third umbel level treated with 100 ppm of giberelic acid showed 78% of germination. In spite of the statistical differences observed among the plantig date, vernalization and conditioning with giberelic acid, these differences are not agronomically relevant.
Key words: Daucus carota L., carrot seed quality, first, second and third umbel level.
INTRODUCCIÓN
La zanahoria es una hortaliza ampliamente cultivada en el mundo (Singh y Singh, 1996) y es fuente importante de carotenos y vitaminas. La inflorescencia es típica de las umbelíferas, consiste de una umbela terminal o primaria y de otras umbelas inferiores de menor orden e importancia, cuyo patrón de floración es complicado. Debido a ello la época de cosecha tiene un efecto crítico en la calidad de semilla, ya que ésta mantiene diferentes estados de desarrollo; por lo que, para producir semilla de buena calidad, la colecta debe realizarse sólo de umbelas primarias y secundarias (Miyagi, 1959; Gray, 1983; Singh y Malik, 1986).
La calidad de la semilla de zanahoria ha sido asociada con el hábito de floración y la posición en la planta madre (Hegarty, 1971). Butler y Crowe (1996) observaron que el mayor tamaño de las umbelas primarias favorece el vigor alto de la semilla, mientras que Carvalho y Nakagawa (1983) reportaron que, además del tamaño, estas semillas poseen embriones completos y mayor reserva de nutrimentos. Debido a lo anterior, la semilla de umbelas primarias presentan mejor vigor germinativo que las secundarias y terciarias (Nascimento, 1991; Szafirowska, 1994); sin embargo, cada semilla genera una planta genéticamente diferente, al adquirir diversos atributos fisiológicos durante su formación en cada umbela (Oliva, 1989).
Para la producción de semilla de zanahoria se utilizan dos técnicas distintas: semilla–semilla que consiste en la siembra directa en campo de la semilla cosechada; ésta práctica es de bajo costo y menos laboriosa que la técnica raíz–semilla, en la cual la raíz se remueve del suelo, selecciona y replanta, de modo que la semilla se cosecha en el ciclo siguiente.
La obtención de alto rendimiento calidad de semilla, exige el crecimiento apropiado de la planta y de las umbelas (Singh y Singh, 1996). Para favorecer el crecimiento de la umbela primaria, se han estudiado diversas prácticas como la poda de la umbela secundaria, que aumenta el tamaño y mejora la viabilidad de la semilla (Miyagi, 1956), pero es económicamente inviable. Otra práctica consiste en utilizar altas poblaciones, lo que restringe el desarrollo de ramas laterales y prolonga el período de floración de las umbelas primarias y mejora el peso y calidad de la semilla (Gray y Steckel, 1985). En otros cultivos se ha estudiado la aplicación de reguladores de crecimiento como Clormequat (460 g L–1de Cloruro de Clormequat y 320 g L–1 de Cloruro de Colina), que retarda la germinación y reduce el nivel de ácido giberélico (AG3) en semilla de lechuga (Thomas, 1968), mientras que Diaminozide [4–(2,2–dimetilhidrazinil)–ácido 4–oxobutnoico] aumenta el rendimiento y la germinación de la semilla de col de Bruselas (Brassica oleracea var. gemmifera). El tratamiento de la zanahoria con AG3 se ha asociado con un patrón irregular de floración y esterilidad de plantas (Dickerson y Peterson, 1960) y con efectos ligeros en el número de umbelas y rendimiento de semilla (Elballa y Cantliffe, 1987).
Para la producción de semilla con la técnica raíz–semilla, la zanahoria requiere un período de baja temperatura por lo que los productores aprovechan el período de almacenamiento para vernalizar la raíz. Guenko (1983) reportó que la raíz de la zanahoria adquiere la vernalización cuando alcanza un diámetro de 6 mm, siempre que se encuentre expuesta a temperatura entre 4 y 10 °C. Relf y McDaniel (2000) determinaron que la temperatura óptima para la germinación de la semilla de zanahoria, varía entre 10 y 29 °C.
Austin (1972) observó que el rendimiento y calidad de semilla y vigor de plántula, fueron influenciados por el ambiente de crecimiento de la planta madre. En un estudio similar, el tamaño, viabilidad y germinación de semilla de zanahoria varió en función del cultivar, lote y época de producción (Cardoso, 2000). Sin embargo, otros autores reportaron que las diferencias observadas en diversos estudios pueden ser atribuídas a la densidad de plantación, orden de la umbela de origen y condiciones climáticas prevalecientes durante el desarrollo de la semilla (Gray et al., 1988).
En México se ha generado poca información sobre el cultivo de zanahoria, en particular sobre la influencia del orden de umbela sobre la calidad de la semilla. Por lo anterior, el objetivo de este estudio fue determinar el efecto de la vernalización, tratamiento con ácido giberélico y fecha de plantación sobre la germinación de semilla de zanahoria de tres estratos umbelares.
MATERIALES Y MÉTODOS
En la primera etapa del estudio se efectuó la siembra directa de la zanahoria [Daucus carota L. ssp. sativus (Hoffm.) Archang] cv. Nantes y el manejo del cultivo se realizó de acuerdo con las recomendaciones para la producción comercial en El Bajío Guanajuatense. La dosis de fertilización química aplicada fue 100–80–00, a base de sulfato de amonio (21 % N) y superfosfato de calcio simple (21% P2O5). La colecta de la raíz se efectuó en forma manual de plantas con competencia completa el 21 de febrero de 2003, se seleccionaron por diámetro y aspecto sanitario y enseguida se trataron con 30 g de Manzate 200 (80% de Bisdictiocarbamato de etileno de Mn) y 30 g de Agrimicin 500 (150 g de Sulfato de Estreptomicina y 15 g de Clorhidrato de Oxitetracilina), disueltos en 12 L de agua. Posteriormente, se dividieron en tres partes y se introdujeron cada una en una solución a base de ácido giberélico AG3) a tres concentraciones: 50, 100 y 150 ppm. En seguida se sometieron a vernalización (V) durante 0, 20 y 40 días (d) a 4 °C y 90 a 95% de humedad relativa.
La segunda etapa cosistió en la siembra de las raíces en unidades experimentales de 21.6 m2, en un suelo Vertisol Pélico de Celaya, Guanajuato, México, localizado a 20° 34' 28" latitud norte y 100° 50' 00" longitud oeste a 1 765 msnm; el clima de la región es BS1hw(w)(e)g, templado con lluvias en verano (García, 1988). Los tratamientos formados por la combinación de AG3 (parcela chica), V (parcela media) y (FP), se efectuo el 22 de febrero, 4 y 22 de marzo de 2003 (parcela grande). Los tratamientos se distribuyeron bajo un diseño experimental de bloques al azar con arreglo en parcelas subdivididas con cuatro repeticiones. Quince días después de cada fecha de plantación se aplicó la dosis 200–150–75: la primera mitad del nitrógeno con sulfato de amonio (21 % N), superfosfato de calcio triple (44% P2O5) y sulfato de potasio (44% K2SO4), y la segunda parte del nitrógeno con urea, (44% N) al inicio de brotación del tallo floral. Se aplicaron cinco riegos durante el ciclo, con base en el diagnóstico de la necesidad visual de la planta y suelo. El manejo preventivo de Erwinia carotovora L. R. Jones y Xantomonas caratae Kender, se realizó con el equivalente de 0.5 kg ha–1 de Agrimicin 500 y 1.2 kg ha–1 de CuSO4 tribásico, respectivamente.
La colecta de las umbelas primarias inició 180 días después del trasplante y las umbelas secundarias y terciarias 12 y 35 días después, respectivamente. Con la semilla libre de impurezas, se procedió conforme a la técnica propuesta por Moreno (1984). Se tomaron 100 semillas al azar y se colocaron sobre papel filtro en cajas Petri de 210 x 15 mm. Para lograr la imbibición y el proceso germinatico y asegurar la sanidad de la semilla, se agregó 1 mL de solución preparada con 2.5 g de Captán/L de agua [CISN (triclometil) tio–4–ciclohexano 1,2] por caja. En seguida se colocaron en estufa marca Conviron, calibrada a 30 °C, sin control de humedad relativa, por lo que la condición hídrica de la semilla y plántula se recuperó con el suministro diario de agua destilada. La germinación se determinó en dos períodos: 7 y 14 días. Se consideró semilla germinada, aquella que mostró un desarrollo normal de plántula y radícula (ISTA, 1993). El análisis de varianza y la prueba de comparación de medias de los resultados, se realizaron con el paquete estadístico SAS 6.2 (1996).
RESULTADOS Y DISCUSIÓN
Germinación de semillas de umbelas primarias
Se observó diferencia altamente significativa (p<0.01) entre las fechas de plantación para el porciento de germinación de las semillas de umbelas primarias (Cuadro 1). La germinación de la semillas de umbelas primarias (GUP) con fecha de plantación del 22 de febrero fue 86%, lo cual sugiere que esta fecha sería la óptima para plantar la raíz de zanahoria y obtener alto porcentaje de germinación de la semilla de umbelas primarias; sin embargo, la diferencia de sólo 1.1% entre la primera y al última fecha de plantación no representa una ventaja agronómica de relevancia para incorporarse al proceso de producción raíz–semilla de zanahoria. No obstante, lo anterior permite afirmar que la época de siembra óptima para la producción de semilla es la misma que para la producción comercial de la raíz de zanahoria (Figura1).

Diversas investigaciones confirman las ventajas fisiológicas de las semillas de umbelas primarias. Las semillas de este orden floral poseen un embrión de mayor tamaño que se desarrolla rapidamente lo que favorece el vigor y germinación (César, 1974; Krarup y Montealegre, 1975). Por su parte, Atanasov y Carrazana (1975) reportaron 91 y 85% de germinación en semillas de zanahoria cosechadas del primer y segundo orden floral, respectivamente.
La temperatura es el factor ambiental que más influye sobre la producción y calidad de semilla de los cultivos, desde la fase vegetativa hasta la madurez (Elballa y Cantliffe, 1996).
Los resultados observados en esta investigación podrían ser explicados en parte por las temperaturas relativamente bajas y estables que se registraron en el sitio de estudio durante los 10 días posteriores al 22 de febrero (primera fecha de plantación) que fueron en promedio 33.3, 15.7 y 1.5 °C, para la máxima, media y mínima, respectivamente a la intemperie a 10 cm sobre el suelo. En las dos fechas posteriores, las temperaturas registradas fueron: 36.1, 19.3 y 5.34 (4 de marzo) y 33.4, 17.8 y 4.3 °C (22 de marzo), en el mismo orden y que se sumarían a los requerimientos de vernalización de la raíz.
El almacenamiento a temperatura ambiente fue suficiente para mostrar 86% de germinación, el cual fue estadísticamente igual al observado con vernalización durante 20 días y significativamente diferente al de 40 días a 4 °C (Figura 2). Cabe destacar que entre los 14 y 20 días después de la segunda fecha de plantación, se registraron temperaturas inferiores a 0 °C, lo cual pudo contribuir en el período de vernalización en esta fecha de plantación. No obstante que se observaron resultados positivos por efecto de la vernalización, esta práctica no representa una ventaja importante, ya que la diferencia entre 0 y 20 días de vernalización, con respecto a 40 días, fue de sólo 1% en la germinación de la semilla de umbelas primarias.
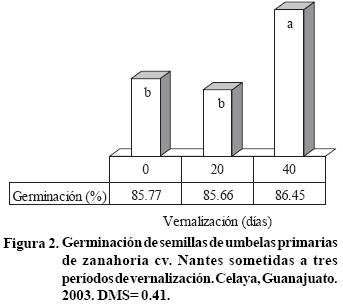
El efecto interactivo de la fecha de plantación del 4 de marzo y 40 días de vernalización (Figura 3), mostro diferencias significativas en la germinación de semilla de las umbelas de primer orden, con incremento de casi 3% (Figura 3); sin embargo, el 0.6% de diferencia entre esta fecha y el 22 de febrero, apoyaría la conveniencia de plantar en fecha temprana (Figura 3) además, la vernalización durante 40 días representaría una desventaja económica. Krarup y Schwerter (1981) determinaron que 8 días de vernalización de la raíz de zanahoria a 4 °C fueron suficientes para inducir la brotación y alcanzar 96% de germinación de la semilla, la cual fue estadísticamente igual a 44, 72, 97 y 173 días de tratamiento frío. Tambien, observaron una disminución gradual de el porciento de germinación de semilla provocada por la interacción de fecha de plantación tardía (4 y 22 de marzo) y vernalización de 0, 20 y 40 días.

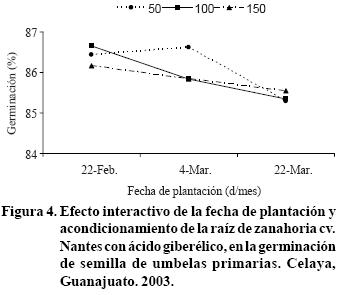
En general, el por ciento de germinación de semillas de umbelas primarias mostró, tendencia a disminuir por efecto de la interacción a FP * AG3 (Figura 4). La plantación del 22 de febrero pudo beneficiarse de las bajas temperaturas que se presentaron en esta fecha, que mejoraron ligeramente (1 %) la germinación, independientemente de la concentración de AG3. Con excepción del ligero incremento que se observó en fecha de plantación del 4 de marzo más acondicionado de la raíz con 50 ppm de AG3, en general, la germinación disminuyó 1.23% a medida que se retrasó la fecha de siembra (Figura 4).
Sakr y Thompson (1942) reportaron que el desarrollo de la raíz a temperatura entre 10 y 15 °C, seguida de un tratamiento de vernalización, mejoró de 60 a 100% la floración en contraste con tratamientos de 15 a 21 ó 21 a 27 °C. En este estudio se observó que prolongar la vernalización hasta 40 días incrementa en 1% la germinación con respecto al testigo, sólo si las raíces se trataran con 50 y 100 ppm de AG3 (Figura 5).

La interacción triple de los factores estudiados sólo se observó en las semillas de umbelas primarias (Cuadro 2). Con base en este resultado, se confirma que las flores formadas en el inicio aprovechan las reservas nutricionales acumuladas durante la etapa vegetativa. Lo anterior justificaría la respuesta altamente significativa de la germinación de las semillas formadas en la primera inflorescencia de la zanahoria (Cuadro 1). La triple interacción de los factores estudiados, en particular con los tratamientos que corresponden a 22 febrero*40 d*50 ppm, 4 marzo*40 d*50 ppm y 22 febrero*40 d* 100 ppm, de la interacción FV*TV*AG3, respectivamente, mostró casi 88% de germinación en las semillas de la umbela primaria (Cuadro 2). Los resultados destacan el efecto favorable de la temperatura en la germinación de semillas de zanahoria, provocada por la participación conjunta de la vernalización y la concentración menor de AG3 en fechas de plantación temprana e intermedia. En el caso de que la producción de semilla de zanahoria se iniciara el 22 de marzo se podría omitir la vernalización y el acondicionamiento con AG3 y la germinación registraría valores ligeramente superiores a 85%.
Germinación de semillas de umbelas secundarias (GUS)
Se observó efecto significativo en la germinación de semilla del segundo orden floral por efecto de TV y a los efectos interactivos FP*AG y TV*AG (Cuadro 1). El por ciento de germinación fue igual en el testigo y la vernalización durante 40 días y ligeramente superior a la vernalización durante 20 días (Figura 6). Jacobsohn y Globerson (1980) y Krarup et al. (1976) consideraron como de buena calidad 80% de germinación en semilla de umbelas secundarias, sobre todo porque esta especie presenta problemas de embrión inmaduro. En este estudio, el testigo mostró 82% de germinación en las semillas de umbelas de segundo orden floral. Es conveniente mencionar que la norma para la producción de semilla de zanahoria en los Estados Unidos de Norteamérica permite como mínimo 55% de germinación.

El efecto favorable de la fecha de plantación y empleo de ácido giberélico ha sido reportado en Olness et al. (1990) (citado por Below, 2002), quienes analizaron la acumulación de reservas nutrimentales en la planta y concluyeron que la fecha de plantación, riego y clima alteraron la disponibilidad de nitrógeno. Por su parte, el ácido giberélico es esencial para la germinación al estimular el crecimiento del tejido embrional (Naqvi, 2002). Adicionalmente, las giberelinas se caracterizan por compensar el efecto de temperaturas bajas que inducen la floración de las plantas bianuales (Talón, 2000). Salisbury y Ross (1992), indican que las giberelinas, además de contribuír con la vernalización, interaccionan con la luz al reemplazar los efectos de día largo en ciertas especies vegetales como la zanahoria. Estos antecedentes podrían justificar los valores de germinación (82%) registrados en umbelas secundarias de zanahoria, inducidos por la fecha de plantación del 2 de marzo y 50 ó 100 ppm de AG3 (Figura 7). El efecto de 150 ppm de AG3 también se manifestó con valores de germinación aceptables, al interaccionar con las fechas de plantación del 22 de febrero y 22 de marzo.

El por ciento de germinación más alto se observó en el tratamiento con 50 ppm de AG3 (50 ppm) y vernalización durante 40 días. Sin embargo, la tendencia general muestra efectos negativos en la germinación por efecto de los tratamientos de vernalización y acondicionamiento con AG3 (Figura 8).

Germinación de semillas de umbelas terciarias (GUT)
Se detectaron diferencias estadísticas significativas en la germinación de semillas de umbelas del tercer orden floral por el efecto interactivo de los factores TV* AG (Cuadro 1). Sin embargo, dicho efecto fue debido al acondicionamiento con 100 ppm de AG3 sin vernalizar la raíz de zanahoria (Figura 9). El prolongar el período de vernalización redujo la germinación en el tratamiento con 100 ppm de AG3. Efecto contrario se observó con los niveles de 50 y 150 ppm de AG3 y vernalización durante 20 y 40 días.

El tratamiento con base en 100 ppm de AG3 mostró casi 78% de germinación de las semillas de la tercera umbela. Este valor fue similar al observado por Krarup y Schwerter (1981) para semilla del tercer y cuarto orden floral y superior al reportado por Krarup et al. (1976) con 70% de germinación en semilla de órdenes similares. El tamaño de la semilla en las umbelas terciarias, podría explicar los resultados observados en este estudio. Oliva et al. (1988) reportaron tamaños reducidos del embrión en semillas cosechadas de estratos inferiores de la umbela de zanahoria que condicionan la germinación y viabilidad.
CONCLUSIONES
El porcentaje más alto de germinación de semillas se obtiene en umbelas del primer orden y disminuye en las umbelas de segundo y tercer orden. Cuarenta días de vernalización y fecha de plantación temprana (22 de febrero), favorecen la germinación de semillas de umbelas primarias (86%); sin embargo, la escasa diferencia con respecto al testigo, como ocurrió en la mayoría de los efectos simples e interactivos no son agronómicamente sobresalientes y por lo tanto la vernalización y el acondicionamiento de la raíz con AG3 no se justifican para la producción de semilla de umbelas primarias y secundarias. La combinación de vernalización y AG3 promovió porcentajes de germinación aceptables sólo en las umbelas terciarias.
LITERATURA CITADA
Atanasov, N. y Carrazana, D. 1975. Posibilidades de producción de semilla de zanahoria en Cuba. In: Memorias del 1er. Simposio Nacional de Semillas. INRA. La Habana, Cuba. p. 25–37. [ Links ]
Austin, R. B. 1972. Effects of environment before harvesting on viability. In: Roberts, E. R. (ed.). Viability of Seed. Syracuse University Press. Syracuse, New York. p. 114–119. [ Links ]
Below, F. E. 2002. Nitrogen metabolism and crop productivity. In: Pessarakly, M. (ed.). Handbook of Plant and Crop Physiology. 2nd. Edition. Marcel deker, Inc. New York. p. 385–406. [ Links ]
Butler, M. and Crowe, F. J. 1996. Evaluation of simulated hail damage to seed carrots and onions in Central Oregon. www.oregonstate.edu/dept/coar/sh.htm . (fecha de consulta: octubre 28, 2005). [ Links ]
Cardoso, A. I. I. 2000. Produçã e qualidade de sementes de censura das cultivares de Brasilia e Carandaí. Bragantia, Campinas. 59(1):77–81. [ Links ]
Carvalho, N. M. and Nakagawa, J. 1983. Sementes: Ciência, tecnologia e produção. 2 ed. Campinas, Fundação Cargill. 429 p. [ Links ]
César, G. 1974. Quelques notes au sujet de influence du calibre des semences de chicorré witloof et de carottes sur leur faculté germinative. Hort. Sci. 144:53–56. [ Links ]
Dickerson, M. H. and Peterson, C. E. 1960. The influence of gibberellin on flowering of carrots. Can. J. Plant Sci. 40:468–473. [ Links ]
Elballa, M. M. A. and Cantliffe, D. J. 1987. Effect of growth regulators on flowering, number of umbels, seed yield and seed quality of carrot (Daucus carota). Acta Horticulturae 198:163–170. [ Links ]
Elballa, M. M. A. and Cantliffe, D. J. 1996. Alteration of seed stalk development, seed yield, and seed quality in carrot by varying temperature during seed growth and development. J. Amer. Soc. Hort. Sci. 121(6):1076–1081. [ Links ]
García, E. 1988. Modificaciones al sistema de clasificación climática de Köppen (para adaptarlo a las condiciones de la República Mexicana). 5ª. Edición. Talleres de Offset Larios, S. A. México, D. F. 220 p. [ Links ]
Gray, D. 1983. Improving the quality of vegetable seeds. Spain. 26:4–6. [ Links ]
Gray, D.; Steckel, J. R. A.; Dearman, J. and Brocklehurst, P. A. 1988. Some effects of temperature during seed development on carrot (Daucus carota L.) seed growth and quality. Ann. Appl. Biol. 112:367–376. [ Links ]
Guenko, G. 1983. Fundamentos de la horticultura cubana. Ciencia y tecnología. La Habana, Cuba. 335 p. [ Links ]
Hegarty, T. W. 1971. A relation between field emergence and laboratory germination in carrots. J. Hort. Sci. 80:401–407. [ Links ]
Internacional Seed Testing Association (ISTA). 1993. International rules for seed testing. Seed science and technology (Supplement) 21:1–287. [ Links ]
Jacobsohn, R. and Globerson, D. 1980. Daucus carota (carrot) seed quality. I. Effects of seed size on germination, emergence and plant growth under sub–tropical conditions. II. The importance of the primary umbel in carrot seed production. In: Seed production (Hebblethwaite, P. D. ed.). Butterworths. London–Boston. pp. 637–646. [ Links ]
Krarup, A. and Montealegre, J. 1975. Production of carrot seed. I. Influences of planting separation on plant yield and hectareae yield. Agro Sur 3:50–53. [ Links ]
Krarup, A.; Montealegre, J. and Moretti, J. 1976. Production of carrot seed. III. Yield contribution and germination of seeds from different floral tiers. Agro Sur. 4:81–87. [ Links ]
Krarup, A, and Schwerter, E. 1981. Seed production in carrot. VII. Effect of harvest date and root store periods on carrot seed production. Agro Sur. 9:83–86. [ Links ]
Miyagi, K. 1956. Experiment on carrot seed growing. I. Effects of prunning and rainfall on yield of carrot seeds and its viability. J. Hort. Assoc. Japan. 24:254–260. [ Links ]
Miyagi, K. 1959. Experiments on carrot seed growing. V. Seed production of carrot varieties. J. Hort. Assoc. Japan. 28:115–122. [ Links ]
Moreno, M. E. 1984. Análisis físico y biológico de semillas agrícolas. Instituto de Biología. Universidad Nacional Autónoma de México, México. 383 p. [ Links ]
Naqvi, S. S. M. 2002. Plant growth hormones: growth promotors and inhibitors. In: Pessarakly, M. (ed.). Handbook of plant and crop physiology. 2nd. Edition. Marcel Deker, Inc. New York. p. 501–525. [ Links ]
Nascimento, W. M. 1991. Efeito da orden das umbelas na produção e qualidade de sementes de cenoura. Revista Brasileira de Sementes, Brasilia. 13 (2): 131 – 133. [ Links ]
Oliva, R. N.; Tissaqui, T. and Bradford, K. F. 1988. Relations of high plant density and harvest index to seed yield and quality in carrot. J. Amer. Soc. Hort. Sci. 113:532–537. [ Links ]
Oliva, R. N. 1989. Mejoramiento genético de la zanahoria (Daucus carota L.). Curso internacional en investigación y producción de semilla de hortalizas. Instituto de Investigaciones Agropecuarias–INIA, Chile. FAO. Oficina Regional para América Latina y el Caribe. p. 39–50. [ Links ]
Relf, D. and McDaniel, A. 2000. Seed for the garden. Virginia Tech. Virginia cooperative extension. An Environmental Horticulture Publication. 426–316. 4 p. [ Links ]
Sakr, E. S. and Thompson, H. C. 1942. Effect of temperature and photoperiod on seed stalk development in carrot. Proc. Amer. Soc. Hort. Sci. 41:343–346. [ Links ]
Salisbury, F. B. and Ross, C. W. 1992. Plant Physiology. 4th; Edition. Wadsworth Publishing Company. Belmont, California. 682 p. [ Links ]
Statical Analysis Sistem Institute (SAS Institute). 1996. SAS User's guide: Statistics. SAS Institute, Cary, N.C. [ Links ]
Szafirowska, A. I. 1994. The correlation between mother plant architecture, seed quality and field emergence of carrot. Acta Horticulturae. 354:93– 97. [ Links ]
Singh, B. and Malik, Y. S. 1986. Carrot seed yield as influenced by stecklings, planting dates and spacings. Haryana J. Hort. Sci. 15:278–281. [ Links ]
Singh, A. K. and Singh, A. K. 1996. Effect of nitrogen and potash on seed yield of carrot (Daucus carota L.) cv. Pusa Kesar. Crop Res. 12(2): 182–184. [ Links ]
Talón, M. 2000. Fundamentos de fisiología vegetal. Facultad de Biología. Universidad de Barcelona. Departamento de Citricultura. Instituto Valenciano de Investigaciones Agrarias. Moncada, Valencia. Madrid, España. pp. 285–418. [ Links ]
Thomas, T. H. 1968. Effect of the growth retardant CCC on flowering seed production and performance of the progenie of two lettuce species. J. Hort. Sci. 43:391–400. [ Links ]














