Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agricultura técnica en México
versión impresa ISSN 0568-2517
Agric. Téc. Méx vol.34 no.2 México abr./jun. 2008
Artículos
Vectores causantes de punta morada de la papa en Coahuila y Nuevo León, México*
Vectors causal of potato purple top in Coahuila and Nuevo Leon, Mexico
Isidro Humberto Almeyda–León1§ José Alfredo Sánchez–Salas2 y José Antonio Garzón–Tiznado3
1 Campo Experimental General Terán, INIFAP. km 31 carretera Montemorelos–China, C. P. 67400, General Terán, Nuevo León, México.
2 Campo Experimental Saltillo, INIFAP.
3 Campo Experimental Valle de Culiacán, INIFAP.
§Autor para correspondencia:
halmeida@fcb.uanl.mx
* Recibido: Enero de 2006
Aceptado: Marzo de 2007
RESUMEN
El cultivo de papa en la región noreste de México es afectado por un complejo de plagas, donde destacan los insectos vectores de virus y fitoplasmas. El objetivo de este estudio fue realizar el diagnóstico de las diferentes especies de insectos asociados a la papa y maleza, y que pueden ser vectores del agente causal de la enfermedad punta morada, se seleccionaron seis sitios de muestreos, tres en el estado de Coahuila (El Tunal, Emiliano Zapata y Huachichil) e igual número en el estado de Nuevo León (San Rafael, Cristal y Raíces). Desde diciembre de 2003 hasta agosto de 2004, en cada sitio se realizaron colectas de insectos, plantas de papa (cultivada y plantas mostrencas), con los síntomas característicos de infección por punta morada, así como de maleza (dentro y aledaña al cultivo), las cuales se trasladaron al laboratorio para ser analizadas mediante la técnica de reacción en cadena de la polimerasa–secuencial (PCR–Secuencial), utilizando los iniciadores P1/P7 y R16mF2/R16mR1 para determinar su asociación con fitoplasmas considerados como los agentes causales de la enfermedad punta morada. Las especies de insectos con mayor población en los seis sitios de muestreo fueron: los psílidos Bactericera cockerelli y Heteropsylla texana y las chicharritas Aceratagallia spp. y Empoasca spp. La asociación de H. texana con el cultivo de la papa es considerada como un nuevo registro en la región. B. cockerelli, además de ser la especie con mayor población en todos los sitios, mostró la mayor asociación (52%) con fitoplasmas de acuerdo a los resultados obtenidos en las PCR–Secuenciales. El fitoplasma también fue encontrado en H. texana, Aceratagallia spp. y Empoasca spp., así como en la papa y en las malezas girasolillo y correhuela. El mayor porcentaje de asociación de B. cockerelli con fitoplasmas, ubica a esta especie como el posible principal vector del agente causal de la punta morada de la papa en la zona de estudio.
Palabras clave: Aceratagallia spp., Bactericera cockerelli (Sule), Convolvulus arvensis L., Empoasca spp., Helianthus annuus L., Heteropsylla texana (Crawford).
ABSTRACT
Potato crop production in the northeast of Mexico is affected by a complex of insect pests, where the most important insects are those that are vectors of virus and phytoplasms. The objective of this study was to examine the different insect species associated with potato crop and weeds in the region and determine the species with potential to transmit the phytoplasm causing potato purple top. The study was conducted from december of 2003 to august of 2004, in six sites: three in the state of Coahuila (El Tunal, Emiliano Zapata and Huachichil) and three in the state of Nuevo León (San Rafael, Cristal and Raíces). In the six sites there were collections during both years of insects, potato plants with typical symptoms of phytoplasm infection and weed plants growing around the potato crop field. In order to determine presence of the potato purple top phytoplasms, all the collections were analysed in laboratory through the technique Nested–Polymerase Chain Reaction (Nested–PCR), using the primers P1/P7 and R16mF2/R16MR1. The insect species that showed high populations were: the psyllids Bactericerca cockerelli and Heteropsylla texana, as well as the leafhoppers Aceratagallia spp. and Empoasca spp. The association of H. texana with the potato crop in the northeast of Mexico is considered as a new record. B. cockerelli was the most abundant species in all the experimental sites; furthermore, according with the results from Nested–PCR, this insect had the highest association with the potato purple top phytoplasm (52%). The pathogen was also found in the insects H. texana, Aceratagallia spp. and Empoasca spp., and in plants of potato, wild sunflower and correhuela. These results, to point at B. cockerelli how the vector principal possible of potato purple top phytoplasm in the study region.
Key words: Aceratagallia spp., Bactericera cockerelli (Sule), Convolvulus arvensis L., Empoasca spp., Helianthus annuus L., Heteropsylla texana (Crawford).
INTRODUCCIÓN
En los estados de Coahuila y Nuevo León, ubicados en el noreste de la república mexicana, anualmente se siembra una superficie aproximada a 6 000 ha de papa (Solanum tuberosum L.) bajo condiciones de riego, con un rendimiento promedio de 31 t ha–1 que es uno de las más importantes a nivel nacional. La producción de papa es afectada por diversos problemas parasitológicos, entre los que está la baja calidad fitosanitaria de la semilla y se constituye como fuente de inóculo primario de enfermedades, principalmente las de origen viral y las ocasionadas por fitoplasmas como la punta morada que actualmente es la de mayor importancia en la región. Los insectos son relevantes, ya que son los vectores de patógenos como virus y fitoplasmas que causan enfermedades de importancia y reducen el rendimiento además, que ocasionan la pérdida del valor comercial de la cosecha; los psílidos y las chicharritas de la familia Cicadellidae son los insectos de mayor importancia a nivel regional y nacional (Flores et al., 2004). En muestreos realizados por Comité Estatal de Sanidad Vegetal (CESV) de Coahuila en 2001 se detectaron poblaciones de hasta 1 000 psílidos por trampa por semana (Durán, com. pers.), niveles poblacionales que no han sido observados en otras regiones a nivel nacional; sin embargo, se desconoce las especies de psílidos y chicharritas que están asociadas a la papa en Coahuila y Nuevo León. En muestreos realizados en 2002 por el Campo Experimental Saltillo del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) y el CESV de Coahuila, se detectó la presencia de diversas especies de la familia Psílidae. Se desconoce si estas especies son vectores del agente causal de la enfermedad punta morada y los períodos infectivos de estos psílidos.
Cranshaw (2002), indica que el psílido Bactericera cockerelli (Sulc), anteriormente Paratrioza cockerelli, es un insecto altamente migrante que causa daño a la papa al alimentarse y succionar la savia de la planta e inyectar una toxina sistémica, causando una enfermedad denominada amarillamiento del psílido; sin embargo, Garzón (1986) y Becerra (1989), consignan que este psílido en México está relacionado con la enfermedad "permanente del tomate" y consideraban que su agente causal era de etiología viral. En estudios posteriores realizados por Delgadillo (1999), estableció que esta enfermedad estaba relacionada con organismos del tipo fitoplasmas. Almeyda et al. (2002b) indican que el psílido B. cockerelli colectado en tomate (Lycopersicum esculentum Mill), en el estado de Morelos y que presentaba los síntomas del permanente fue positivo a un fitoplasma del grupo I, el cual es considerado como uno de los agentes causales de la enfermedad punta morada de la papa. Por otra parte, Maramorosch (1998), menciona que la punta morada se ha atribuido a un fitoplasma, el cual es transmitido por insectos vectores de la familia Cicadellidae, en el que se incluye a Macrosteles quadrilineatus (Stal). Beres et al. (1998), reportan la detección del fitoplasma de la punta morada en plantas y tubérculos de papa enfermos al igual que en chicharritas del género Aceratagallia spp.
La chicharrita de la remolacha Circulifer tenellus (Baker), también ha sido reportada como vector del agente causal de la punta morada de la papa y recientemente ha sido encontrada en los estados de Washington y Oregon en los Estados Unidos de América (Lee et al., 2004; Crosslin et al., 2005; Munyaneza, 2005; Munyaneza and Upton 2005; Munyaneza et al., 2006).
En lo que respecta a las plantas hospederas de B. cockerelli, se reporta que ataca principalmente a la familia Solanaceae. Pletesch (1947) y Wallis (1955), mencionan que B. cockerelli también se ha detectado en algunas especies de las familias Amaranthaceae, Fabaceae, Lamiaceae, Malvaceae, Pinaceae, Poaceae, Plolygonaceae, Rosaceae, Salicaceae, y Zygophyllaceae.
Cranshaw (1989), menciona que los síntomas de la enfermedad se detectan primeramente en los bordes del lote de cultivo y posteriormente hacia el centro, por lo tanto las capturas de los vectores se deberán realizar en las orillas del cultivo, principalmente mediante redazos. Ploaie (1981), consigna que los principales vectores de fitoplasmas son cicadélidos del suborden Auchenorhyncha. García y Rodríguez (1998), en un estudio sobre transmisión de la enfermedad punta morada, realizado en el Estado de México, señalan que los cicadélidos de los géneros Graminiella spp., Deltocephalus spp., Dalbulus maidis, D. elimatus y Empoasca spp., no tenían efectos positivos en la transmisión de la enfermedad. Zavala y Cadena (1998), mencionan que la punta morada de la papa es una de las enfermedades más importantes de este cultivo en México, la cual se encuentra distribuida en gran parte de las zonas paperas, afectando la calidad y rendimiento al grado que dificulta o imposibilita la comercialización para consumo en fresco o su uso como semilla. En estudios realizados por Béres et al. (1998), reportan que la enfermedad punta morada y bola de hilo, son causadas por el mismo agente causal que es un fitoplasma y que éste también se detectó en un cicadélido del género Aceratagallia spp., por tal razón, se considera que este insecto pudiera ser uno de los vectores de esta enfermedad en nuestro país.
González y Fernández (1998), llevaron a cabo un estudio en las regiones paperas de Coahuila y Nuevo León, para identificar posibles vectores de enfermedades, detectando la presencia de dos especies de chicharritas, Empoasca fabae (Harris) y Dalbulus maidis (Delong y Wolcott) y pulgones de los géneros Aphis gossypii (Glover), Myzus persicae (Sulzer) y Uroleucon spp. Almeyda et al. (2002a, 2002b, 2004), en trabajos realizados en los estados de Coahuila y Nuevo León, determinaron que son dos los fitoplasmas que están implicados como agentes etiológicos en el síndrome de la punta morada de la papa, también señalan que el psílido Bactericera cockerelli incuba a estos fitoplasmas, por lo cual se considera que este insecto se constituye como un vector potencial e igual este mismo patógeno se detectó en plantas de girasol silvestre (Helianthus annuus L.). Garzón et al. (2004), reportan a B. cockerelli, como un vector de los fitoplasmas que infectan a la papa causándole la enfermedad punta morada.
En Coahuila y Nuevo León, el control de plagas en especial de psílidos y chicharritas, se realiza solamente durante el ciclo del cultivo; sin embargo, existen reportes que durante el período de otoño–invierno las poblaciones se incrementan en las hospederas alternas aledañas al cultivo (González y Fernández, 1998) y se desconoce si estas poblaciones son infectivas, lo cual de ser cierto repercutiría desfavorablemente en el siguiente ciclo del cultivo, debido a que la nueva población de estos insectos estaría infectiva y sería fuente de inóculo de la enfermedad punta morada desde el inicio del cultivo. Tomando en cuenta lo anterior, se consideró la importancia de realizar este trabajo cuyo objetivo fue realizar el diagnóstico de las diferentes especies de insectos asociados a la papa y la maleza y que pueden ser vectores del agente causal de la punta morada ocasionada por fitoplasmas esta constituida como la principal enfermedad que afecta a la papa en la región noreste de México.
MATERIALES Y MÉTODOS
De diciembre de 2003 hasta agosto de 2004, se realizaron muestreos de insectos, papa y maleza en las localidades de El Tunal, Emiliano Zapata y Huachichil, Coahuila, y San Rafael, Cristal y Raíces de Nuevo León. La selección de los sitios fue con base en la cercanía a estaciones climatológicas y a los ambientes agroecológicos para el cultivo de la papa. Los muestreos se realizaron durante el tiempo señalado anteriormente con la finalidad de capturar a los insectos dentro y fuera del ciclo de cultivo.
Para la captura de insectos se colocaron trampas amarillas (charolas de plástico con agua y con pegamento) una de cada una por sitio de muestreo. También se realizaron muestreos mediante redazos (40), directamente a la planta, los redazos al igual que la revisión de las trampas amarillas se realizaron cada 15 días. Los insectos capturados se colocaron en frascos de plástico con alcohol al 70% y se trasladaron al laboratorio del Campo Experimental de Saltillo perteneciente al Centro de Investigación Regional Noreste del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), para su identificación. Posteriormente con la ayuda del microscopio de disección se separaron y clasificaron por ordenes, familia, género y especie.
Detección de fitoplasmas. Todas las muestras de papa, insectos y maleza colectadas en todos los sitios de muestreo, se trasladaron para su análisis molecular a la Unidad de Investigación en Biología Celular y Molecular del INIFAP, ubicado en la Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León (UANL). Se utilizó la técnica de reacción en cadena de la polimerasa (PCR), en la modalidad de PCR secuencial, utilizándose en un primer ciclo de amplificación los iniciadores P1/P7 (Smart et al., 1996) y en el segundo ciclo de amplificación a los iniciadores R16mF2/R16mR1 (Gundersen y Lee, 1996). Las reacciones de PCR se realizaron de acuerdo a lo reportado por Almeyda et al. (2004), en tubos de 0.5 ml; el volumen total de la reacción fue de 25 µL y se conformaron de la manera siguiente: 50 ng de DNA; para el segundo ciclo de amplificación se hicieron diluciones 2:40 del primer ciclo de amplificaciones y se utilizaron 2 µL de la dilución como DNA molde, 0.5 µM de cada iniciador, 200 µM de cada dNTP (A–T–C–G), 2.0 mM de MgCl2 y 1.5 Unidades de la Taq DNA polimerasa marca Gibco®. Las PCR's se llevaron a cabo en un termociclador MJ Research con el programa: 1 ciclo de desnaturalización a 94 °C de 2 min y 35 ciclos adicionales con el siguiente programa: 1 min de desnaturalización a 94 °C; 30 seg de apareamiento a 55 °C; 1 min y 30 seg de polimerización a 72 °C; y una extensión final de 72 °C durante 10 min. Los productos de PCR se fraccionaron en geles de agarosa al 1.5% a 100 V por h–1, se tiñeron con bromuro de etidio (0.5 µg/ml) y se visualizaron bajo luz ultravioleta.
Análisis del polimorfismo en la longitud de los fragmentos de restricción (RFLP's). Con la finalidad de establecer la identidad de los fitoplasmas detectados en papa, insectos y maleza, se realizó el análisis del polimorfismo en la longitud de los fragmentos restricción (RFLP's), para tal efecto, los fragmentos amplificados en las PCR's utilizando los iniciadores R16mF2/R16mR1 fueron sometidos a tratamiento con la endonucleasa AluI acorde a las indicaciones del fabricante (Bio Labs Inc).
RESULTADOS Y DISCUSIÓN
Detección de fitoplamas. En las PCR's secuenciales, se obtuvo la amplificación de fragmentos de un tamaño molecular aproximado de 1.45 Kb a partir del Ácido desoxirribonucleico (ADN) genómico de papa mostrenca con síntoma típico de infección por punta morada, insectos y maleza. No se obtuvo amplificación a partir del ADN genómico de papa sana desarrollada a partir de minitubérculo y bajo condiciones de invernadero la cual fue usada como testigo negativo (Figura 1). Estos resultados confirman la presencia de fitoplasmas en papa mostrenca, insectos y maleza colectada en los 6 sitios de muestreo y confirman su asociación con el síndrome de punta morada.
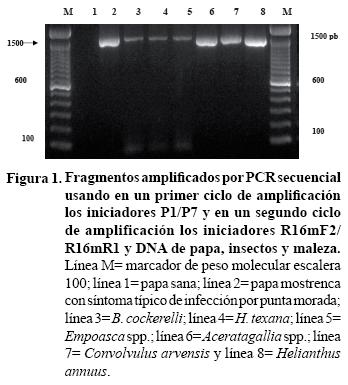
Análisis de restricción de los fragmentos amplificados por PCR. Al digerir con la endonucleasa AluI a los fragmentos de 1.45 Kb amplificados en las PCR's secuenciales, se observaron dos perfiles de restricción (Figura 2). Los dos perfiles observados corresponden a los fitoplasmas que pertenecen a los grupos I y II de acuerdo con Lee et al. (1998), como se puede observar en la Figura 2, los dos perfiles se observan tanto en las plantas de papa como en los insectos y en la maleza, lo cual confirma que se detectaron a los fitoplasmas que ocasionan la enfermedad y refuerza la posibilidad de que estos insectos sean los potenciales vectores del agente causal de la punta morada y que la maleza sea un hospedero alternante del mismo patógeno. No se descarta la posibilidad de mezcla de los fitoplasmas tanto en plantas como en insectos.

Dinámica poblacional y presencia de fitoplasmas en los insectos colectados. En las Figuras 3, 4, 5, 6, 7 y 8, se indica la dinámica poblacional de las principales especies de insectos colectados en las distintas localidades de los estados de Coahuila y Nuevo León durante el año 2004 (no se muestran los datos del 2003 que fueron muy similares). La zona sombreada en dichas figuras, corresponde a muestreos en maleza y las fechas posteriores son poblaciones de insectos detectados en el cultivo.






Se realizó la detección de una nueva especie de la familia Psilidae cuyo nombre científico es Heteropsylla texana (Crawford) (Homoptera: Psyllidae). En el estado de Coahuila se detectó desde la primera semana de marzo hasta la tercera semana de junio; sin embargo, el período de mayor incremento poblacional fue de abril a mayo, período en el cual las poblaciones de Bactericera cockerelli [Sulc] (Homoptera: Psyllidae) fueron bajas (Figuras 3, 4 y 5).
Las poblaciones de H. texana, en el estado de Nuevo León se detectaron de la tercera semana de abril a la segunda semana de junio (Figuras 6, 7 y 8), las poblaciones fueron menores que en el estado de Coahuila, lo cual se atribuye a que las temperaturas fueron más altas en las localidades muestreadas en Nuevo León. Las poblaciones de B. cockerelli aumentaron considerablemente de junio a septiembre, y las de H. texana disminuyeron, incluso a cero, lo cual concuerda en todas las localidades y se asume que esto es debido a que B. cockerelli es más tolerante a altas temperaturas que H. texana. En el predio el Tunal, Coahuila, las poblaciones de B. cockerelli, fueron positivos al fitoplasma desde la primera semana de mayo; en la primera semana de junio además deB. cockerelli, H. texana también fue positiva al fitoplasma. En la primera semana de julio las poblaciones de B. cockerelli de nuevo fueron positivas al fitoplasma además de las chicharritas (Figura 3). Como puede observarse en las Figuras 3, 4, 5, 6, 7 y 8 la mayor población entre los insectos corresponde a B. cockrelli.
En la Figura 9 se indica la presencia del fitoplasma en insectos, papa y maleza, la cual fue determinada mediante las pruebas de PCR–secuencial. En los insectos la asociación con fitoplasmas ocurre desde la primera quincena de mayo hasta la segunda quincena de agosto. El psílido B. cockerelii presenta el mayor porcentaje de asociación con fitoplasmas en todos los predios muestreados. El psílido H. texana, se detectó positivo a fitoplasma solamente en las poblaciones colectadas en la primera quincena de junio en el predio el Tunal, Coahuila.
Las especies de chicharritas y pulgones que tuvieron mayor incidencia tanto en el cultivo como en la maleza aledaña fueron, Empoasca spp. (26%), Aceratagallia spp. (14%), (Homoptera: Cicadellidae), Myzus persicae (32%) y Aphis gossypii (28%). De estas cuatro especies, sólo se detectaron positivas a fitoplasmas la chicharrita verde Empoasca spp. y chicharrita gris Aceratagallia spp. Lo anterior ocurrió desde la primera quincena de junio a la primera quincena de agosto en los predios de Emiliano Zapata y el Tunal, Coahuila. Los pulgones y los especimenes pertenecientes al orden Thysanoptera de la familia Thripidae (trips), no se encontraron positivos a fitoplasmas.
En las plantas mostrencas de papa, el fitoplasma solamente se detectó en las plantas que presentaban el síntoma típico de punta morada en la primera quincena de julio y en la segunda de agosto. De la maleza analizada, la presencia de fitoplasmas se detectó en el girasol o polocote (Helianthus annuus L.) (Compositae) y en la correhuela (Convolvulus arvensis L.) (Convolvulaceae) (Figura 9).
En estudios preliminares sobre insectos asociados a la papa indican que el psilido B. cockerelli fue el más común y abundante en las zonas productoras de papa que presentaban daños similares a los producidos por la punta morada de la papa en los Estados Unidos de América (Munyaneza et al., 2007).
Datos similares han sido reportado en México por Garzón et al. (2004) y Hernández–García et al. (2006), lo que pone de manifiesto que B. cockerelli juega un rol preponderante en la diseminación de la punta morada de la papa en el noreste de México. Munyaneza et al. (2007), al no detectar la presencia de fitoplasmas en plantas y/o tubérculos provenientes de plantas de papa con síntomas de la enfermedad conocida como "zebra chip" (ZC), sugieren que la sintomatología observada fue debido a la posible inyección de una toxina por el psílido al momento de alimentarse, aunque también sugieren que la sintomatología pudo ser ocasionada por un patógeno de etiología desconocida.
Sin embargo, en estudios recientes realizados por Lee et al. (2006) y Secor et al. (2006), detectaron tres fitoplasmas diferentes (yellows phytoplasma 16SrI–A, clover proliferation phytoplasma 16Sr VI y un fitoplasma anteriormente conocido como stolbur phytoplasma group 16SrXII y que recientemente fue llamado "Candidatus phytoplasma americanum") en tubérculos infectados con ZC aunque en bajas concentraciones. Si bien es cierto que los psílidos inyectan toxina a las plantas cuando se alimentan, ocasionando disturbios en el desarrollo y metabolismo de la planta (Eyer y Crawford, 1933; Eyer, 1937; Eyer y Miller 1938; Carter, 1950; Wallis, 1955; Abernathy, 1991; Purcel et al., 1997; Liu y Trumble, 2004; Liu et al., 2006), también es cierto que algunas especies de psílidos pueden transmitir patógenos de plantas incluyendo bacterias, fitoplasmas y virus (Davies et al., 1992; Carraro et al., 1998; Blomquist y Kirkpatrick 2002; Tedeschi y Alma 2004; Salazar, 2006).
En el caso de la enfermedad del amarillamiento del psílido Binkley (1929), sugirió que esta era una enfermedad causada por un virus más que las posibles toxinas inyectadas por el psílido. En el caso particular de la papa, hasta la fecha no ha sido posible aislar la toxina que se sospecha es inyectada por el psílido y tampoco ha sido detectada usando técnicas moleculares modernas (Munyaneza et al., 2007), lo que imposibilita concluir con seguridad que la sintomatología observada en las plantas de papa donde se alimentan los psílidos sea debida exclusivamente a una posible inyección de toxinas o si también un patógeno esta involucrado. La evidencia de que B. cockerelli puede trasmitir fitoplasmas fue demostrada por Salas et al. (2006), aunque con menor eficiencia que algunas especies de chicharritas.
Por consecuencia, en la estrategia del manejo de la enfermedad en esta región, se debe considerar prioritario el control de B. cockerelli, tanto como posible inyector de toxina como por ser un posible vector de los dos grupos de fitoplasmas detectados en Coahuila y Nuevo León, sin olvidar a las especies de chicharritas Empoasca spp. y Aceratagallia spp., las cuales también fueron detectadas positivas a fitoplasmas.
CONCLUSIONES
Heteropsylla texana se detectó como una nueva especie asociada al cultivo de la papa en los estados de Coahuila y Nuevo León, y se observó positiva para fitoplasma.
Bactericera cockerelli es el insecto con mayor porcentaje de asociación con los fitoplasmas que infectan la papa.
Las chicharritas de los géneros Empoasca spp. y Aceratagallia spp. fueron positivas a los fitoplasmas que infectan a la papa.
En el Helianthus annuus, Convolvulus arvensis, y Solanum tuberosum (papa mostrenca), se detectó la presencia de los fitoplasmas que infectan a la papa.
Los fitoplasmas detectados en papa, insectos y plantas hospederas, pertenecen a los grupos I y II de fitoplasmas.
LITERATURA CITADA
Abernathy, R. L. 1991. Investigation into the nature of the potato psyllid toxin. M. S. thesis, Colorado State University, Fort Collins, CO. 87 p. [ Links ]
Almeyda, L. I. H.; Sánchez S., J. A.; Garzón, T. J. A.; Zavala, Q. T y Rubio, C. O. 2002a. Detección molecular del agente etiológico de la punta morada de la papa. In: CONPAPA (eds.). Memoria del XI Congreso Nacional de Productores de Papa. p. 52–57. [ Links ]
Almeyda, L. I. H.; Sánchez S, J. A.; Rubio, C. O.; Ramos, V. O. y Rocha P, M. A. 2002b. Detección molecular de fitoplasmas en insectos y maleza asociados al cultivo de la papa (Solanum tuberosum L.). In: Fuentes D., G. (ed.). Memorias del XXIX Congreso Internacional de la Sociedad Mexicana de Fitopatología. Resúmen F–141. [ Links ]
Almeyda, L. I. H.; Sánchez, S. J. A; y Garzón, T. J. A. 2004. Detección molecular de fitoplasmas en papa. In: Flores, O. A.; Gallegos, M. G. y García, M. O. (eds.). Memorias de Simposio Punta Morada de la Papa. p. 4–14 [ Links ]
Becerra, F. A. 1989. Biología de Paratrioza cockerelli y su relación con la enfermedad "permanente del jitomate" en el Bajío. Tesis Químico Agrícola. Universidad Autónoma de Querétaro. 30 p. [ Links ]
Beres, M.; Zavala, S. M.; Ríos, B. M.; Marín, J. A.; Rocha, R y Leal, K. D. 1998. Etiología y ecología del agente causal de los síndromes bola de hilo y punta morada de la papa en México. Segundo Simposium Internacional de Papa. Toluca, Estado de México, p. 1–3. [ Links ]
Binkley, A. M. 1929. Transmission studies with the new psyllid yellows disease of solanaceus plants. Science (Wash., D.C.) 70:615. [ Links ]
Blomquist, C. L. and Kirkpatrick, B. C. 2002. Frequency and seasonal distribution of pear psylla infected with the pear decline phytoplasma in California pear orchards. Phytopathology 92:1218–1226. [ Links ]
Carraro, L.; Osler, R.; Loi, N.; Ermacorea, P. and Refatti, E. 1998. Transmission of European stone fruit yellows phytoplasma by Cacopsylla pruni. Journal Plant Pathology 80:233–239. [ Links ]
Carter, R. D. 1950. Toxicity of Paratrioza cockerelli (Sulc) to certain solanaceaus plants. Ph. D. dissertation, University of California, Berkeley, C.A. [ Links ]
Crosslin, J. M.; Munyaneza, j. E.; Jensen, a. S. and Hamm, P. B. 2005. Association of beet leafhopper (Hemiptera: Cicadellidae) with a clover proliferation group phytoplasma in Columbia Basin of Washington and Oregon. Journal of Economic Entomology 98:279–283. [ Links ]
Cranshaw, W. S. 1989. The potato–tomato psyllid as a vegetable insect pest. Proc. 18 th Ann. Crio Prot. Inst. Colorado State University p. 69–76. [ Links ]
Cranshaw, W. S. 2002. Manejo del psílido de la papa–tomate el cultivo de la papa. Memorias del XI Congreso Nacional de Productores de Papa. Septiembre 26–28, 2002. León, Guanajuato, México. p. 46–51. [ Links ]
Davies, D. L.; guise, C. M.; Clark, M. F and Adams, A. N. 1992. Parry's disease of pears is similar to pear decline and is associated with mycolasma–like organisms transmitted by Cacopsylla pyricola. Plant Pathology 41:195–203. [ Links ]
Delgadillo S., F. 1999. Alteraciones histológicas causadas por fitoplasmas asociados al "permanente del jitomate" en Guanajuato. XXVI Congreso Nacional de Fitopatología. 320 p. [ Links ]
Eyer, J. R. and Crawford, R. F. 1933. Observations on the feeding habits of the patato psyllid (Paratrioza cockerelli Sul.) and the pathological history of the "psyllid yellows" which it produces. Journal of Economic Entomology 26:846–850. [ Links ]
Eyer, J. R. 1937. Physiology of psyllid yellows of potatoes. Journal of Economic Entomology 30:981–898. [ Links ]
Eyer, J. R., and Miller, M. 1938. A study of the pathological anatomy of psyllid yellows with special references to similar changes in sugar beets affected with curly top. Phytopathology 28:669. [ Links ]
Flores, O. A.; Alemán, N. I. A.; y Notario, Z. M. I. 2004. Alternativas para el manejo de la punta morada de la papa. In: Flores, O. A.; Gallegos, M., G. y García, M., O. (eds.). Memorias de Simposio Punta Morada de la Papa p.40–63. [ Links ]
García, R., J. y Rodríguez, R. 1998. Transmisión y control de la enfermedad punta morada de la papa. Memoria en Segundo Simposium Internacional de Papa. Toluca, Estado de México. 135 p. [ Links ]
Garzón, T. J. A. 1986. Determinación del insecto vector de la enfermedad del tipo viral "permanente del jitomate" en la región del Bajío. XIII Congreso Nacional de Fitopatología. 30 p. [ Links ]
Garzón, T. J. A.; Bujanos, M. R.; Velarde, F. S.; Marín, J. A.; Parga, T. V. M.; Aviles, G. M. C.; Almeyda l. I. H.; Sánchez, S. J. A.; Martínez, C. J. L. y Garzón, C., J. A. 2004. Bactericera (Paratrioza) cockerelli Sulc, vector de fitoplasmas en México In: Flores, O., A., Gallegos, M., G. y García, M., O. (eds.). Memorias de Simposio Punta Morada de la Papa, p. 64–83. [ Links ]
González, E., A, y Fernández, R., J. 1998. Estudios para el establecimiento del manejo integrado de insectos vectores en el cultivo de papa en Coahuila y Nuevo León. Memoria en Segundo Simposium Internacional de Papa. Toluca, Estado de México. 135 p. [ Links ]
Gundersen, D. E., and Lee, I. M. 1996. Ultrasensitive detection of phytoplasmas by nested–PCR assays using two universal primer pairs. Phytopathologia Mediterránea 35:144–151. [ Links ]
Hernández–García, V.; Sánchez–Arizpe, A.; Frías–Treviño, G. A. y Padrón Corral, E. 2006. Factores bióticos y su reacción con el síndrome de punta morada de la papa. In: Memoria de XXII Congreso de la Asociación Latinoamericana de la Papa. Toluca, Estado de México. p. C–17. [ Links ]
Lee, I.–M.; Gundersen–Rindal, D. E., and Bertaccini, A. 1998. Phytoplasma. Ecology and genomic diversity. Phytopathology 88:1359–1366. [ Links ]
Lee, I.–M.; Bottner, K. D.; Munyaneza, J. E.; Secor, G. A. and Gudmestad, N. C. 2004. Clover proliferation group (16SrVI) subgroup A (16SrVI–A) phytoplasma is a probable causal agent of potato purple top disease in Washington and Oregon. Plant Disease 88:429. [ Links ]
Lee, I.–M.; Bottner, K. D., Secor, G. A. and Rivera–Varas, V. 2006. "Candidatus phytoplasma americanum", a phytoplasma associated with potato purple top disease complex. International Journal of Systematic and Evolutionary Microbiology 56:1593–1597. [ Links ]
Liu, D. and Trumble, J. T. 2004. Tomato psyllid behavioral responses to tomato plant lines and interactions of plant lines with insecticides. Journal of Economic Entomology 97:1078–1085. [ Links ]
Liu, D.; Trumble, J. T. and Stouthamer, R. 2006. Genetic differentation between eastern populations and recent introductions of potato psyllid (Bactericera cockerelli) into western North America. Entomological Experimental Application 118:177–183. [ Links ]
Maramorosch, K. 1998. Potato purple top wilt. Segundo Simposium Internacional de Papa. Toluca, Estado de México. p. 13–15. [ Links ]
Munyaneza, J. E. 2005. Purple top disease and beet leafhoper–transmitted virescence agent (BLTVA) phytoplasma in potatoes of the Pacific Northwest of the United States, p. 211–220. In: A. J. Haverkort and P. C. Struik (eds.), potato in progress: Science meets practice. Wageningen Academic Publishers, Wageningen. The Netherlands. [ Links ]
Munyaneza, J. E. and Upton, J. E. 2005. Beet leafhopper (Memiptera: Cicadellidae) settling behavior, survival, and reproduction on selected host plants. Journal of Economic Entomology 98:1824–1830. [ Links ]
Munyaneza, J. E.; Crosslin, J. M. and Upton, J. E. 2006. The beet leafhopper (Hemiptera: Cicadellidae) transmits the Columbia Basin potato purple top phytoplasma to potato, beets, and weeds. Juornal Economic Entomology 99:268–172. [ Links ]
Munyaneza, J. E.; Crosslin, J. M. and Upton, J. E. 2007. Association of Bactericera cockerelli (Homoptera: Psyllidae) with "Zebra Chip" a new pottao disease in Southwestern United States and Mexico. Journal Economic 100:656–663. [ Links ]
Pletsch, D. J. 1947. The potato psyllidPratrioza cockerelli its biology and control. Montana Agrc. Expt. Stn. Bull. 446: 95. [ Links ]
Ploaie, P. G. 1981. Plant diseases and vectors ecology and epidemiology. Maramorosch, K and Harris, K. F. (Eds.). Academic Press. New York, USA. 368 p. [ Links ]
Purcell, M. F.; Balciunas, J. K. and Jones, P. 1997. Biology and host–range of Boreioglycaspis melaleucae (Hemiptera: Psyllidae), potential biological control agent for Melaleuca quinquenervia (Myrtaceae). Environmental Entomology 26:366–372. [ Links ]
Salas–Marina, M. A.; Flores–Olivas, A.; Sánchez–Arizpe, O.; García–Martínez, O.; Almeyda–León, I. H y Garzón–Tiznado, J. A. 2006. Eficiencia de insectos vectores en la transmisión de fitoplasmas de la punta morada de la papa. In: Memoria de XXII Congreso de la Asociación Latinoamericana de la Papa. Toluca, Estado de México. p. 0–1. [ Links ]
Salazar, L. F. 2006. Emerging and re–emerging potato disease in the Andes. Potato Research 49:43–47. [ Links ]
Secor, G. A.; Lee, I.–M.; Bottner, K. D.; Rivera–Varas, V. and Gudmestad, N. C. 2006. First report of a defect of processing potatoes in Texas and Nebraska associated with new phytoplasma. Plant Disease 90:377. [ Links ]
Smart, C. D.; Schneider, B.; Bomquist, C. L.; Guerra, L. J.; Harrison, N. A.; Ahrens, U.; Lorenz, K.–H.; Seemüller, E., and Kirkpatrick, B. C. 1996. Phytoplasma–specific PCR primers based on sequences of the 16–23S rRNA spacer region. Applied and Environmental Microbiology 62:2988–2993. [ Links ]
Tedeschi, R. and Alma, A. 2004. Transmission of apple proliferation phytoplasma by Cacopsylla melanoneura (Homoptera:Psyllidae). Journal of Economic Entomology 97:8–13. [ Links ]
Wallis, R. L. 1955. Ecological studies on the potato psyllid as a pest of potatoes. USDA. Tech Bull. 1107 p. Washington, DC. [ Links ]
Zavala–Quintana, T. E. y Cadena–Hinojosa, M. A. 1998. Punta morada de la papa. Resúmenes, tecnología de cultivo de papa. Confederación Nacional de Productores de Papa de la República Mexicana (CONPAPA), Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP), Toluca Estado de México, p. 17–19. [ Links ]














