Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agricultura técnica en México
versão impressa ISSN 0568-2517
Agric. Téc. Méx vol.33 no.1 México Jan./Abr. 2007
Nota de Investigación
PRODUCCIÓN DE Lecanicillium (= Verticillium) lecanii EN DIFERENTES SUSTRATOS Y PATOGENICIDAD*
PRODUCTION OF Lecanicillium (= Verticillium) lecanii IN DIFFERENT MEDIA AND PATHOGENICITY
Hipólito Cortez–Madrigal1
1 Colegio de Postgraduados–Campus Tabasco. Carretera libre Cárdenas a Coatzacoalcos, Km 21, poblado C27. 86500 Cárdenas, Tabasco, México
 Autor para correspondencia:
Autor para correspondencia:
madri60@hotmail.com
* Recibido: Septiembre de 2005
Aceptado: Marzo de 2007
RESUMEN
La investigación se realizó en 2001 en Cárdenas, Tabasco, México. Se estudió la relación entre producción conidial del hongo Lecanicillium lecanii en diferentes sustratos (medios nutritivos y soporte) y su patogenicidad. Como medios se evaluaron: sorgo, grano de arroz, grano de arroz quebrado ("granillo") polvo de arroz ("pulido"), y como soportes: bagazo de caña, cascarilla de arroz y "olote" de maíz. La combinación de medios y soportes proporcionó doce tratamientos más un testigo constituido solo por arroz. La producción conidial de los tratamientos mostró diferencias significativas (p< 0.05). Los sustratos con mayor producción de conidios fueron bagazo de caña y arroz (839.7 ± 1.2 x 106 g–1) y sorgo y olote (825.8 ± 1.7 x 106 g–1). Aunque el pulido fue el medio menos eficiente, la producción conidial en todas sus combinaciones fue superior a la del arroz solo, que mostró la menor producción conidial (265.4 ±1 x 106 g–1). La patogenicidad de L. lecanii sobre Toxoptera aurantii y Aphis gossypii también se vio afectada por el medio y el soporte en que se produjo. La aireación proporcionada por el soporte marcó la diferencia entre los tratamientos y el testigo. Los resultados señalan que el medio de cultivo es importante en la producción masiva de L. lecanii e indican que la patogenicidad del hongo también fue afectada por el mismo.
Palabras clave: Aphis gossypii, Lecanicillium lecanii, Toxoptera aurantii, hongos entomopatógenos.
ABSTRACT
The conidial production of the fungus Lecanicillium lecanii cultivated in different substrates (nutrition media + supports) and its pathogenicity were determined. The evaluated media were: sorghum, rice grain, broken rice grain ("granillo"), rice polish ("pulido") and as supports sugar cane leftover "bagazo", rice husk and corn cob "olote". The combination of media and supports provided twelve treatments plus a control constituted by rice alone. The production of conidia displayed statistical differences (p< 0.05) among treatments; those with larger conidia production were sugar cane leftover (bagazo) + rice (839.7 ± 1.2 x 106 g–1) and sorghum + corn cob (825.8 ± 1.7 x 106 g–1). Although polished of rice was the less efficient medium for production, all combinations where it was included resulted superior to rice alone. Rice showed the smallest production of conidia (265.4 ± 1 x 106 g–1). Also, the media and support where it was produced affected the pathogenicity of L. lecanii on Toxoptera aurantii and Aphis gossypii. The aeration favored by the support marked the difference between treatments and the control. Results indicated that the culture medium is important for the massive production of L. lecanii; besides, they indicate that the pathogenicity of the fungus was also affected by the culture medium.
Key words: Aphis gossypii, Lecanicillium lecanii, Toxoptera aurantii, entomogenous fungi.
En México, los hongos entomopatógenos se producen comercialmente con grano de arroz de primera calidad. El interés cada vez mayor en su producción (Tanada y Kaya, 1993; Khachatourians et al., 2002), hace urgente la identificación de medios de cultivo económicos y eficientes. Pocos trabajos han sido documentados al respecto (Cisneros y Vera, 2000); sin embargo, existen evidencias de la factibilidad de producir estos hongos por medio de sustratos más económicos que los tradicionales (Puzari et al., 1997; López–Llorca y Carbonell, 1998).
El medio de cultivo es importante para la producción masiva de hongos entomopatógenos (Easwaramoorthy y Jayaraj, 1977), por lo que el éxito en su producción dependerá del medio utilizado y de la especie y/o raza del hongo en cuestión. Cortez et al. (2003) encontraron diferencias importantes en la producción masiva de 15 cepas poliespóricas y monospóricas del hongo Verticillium lecanii en grano de arroz. Recientemente renombrado como Lecanicillium lecanii (Zare y Gams, 2001), este hongo es un importante biorregulador de insectos, principalmente áfidos, coccidos y aleyrodidos (Hall, 1981), por lo que es uno de los hongos entomopatógenos con mayor potencial en el manejo de plagas agrícolas. Los objetivos de la presente investigación fueron: evaluar la producción de L. lecanii en diferentes sustratos y medios nutritivos y su patogenicidad sobre áfidos.
Obtención y conservación del hongo
Se evaluó la cepa monospórica C(3) del hongo L. lecanii, previamente identificada por Cortez et al. (2003) como de mayor potencial para el manejo del áfido Toxoptera aurantii, plaga del cacao (Theobroma cacao L.) en Tabasco, México. La cepa se conserva en el Laboratorio de Entomología del Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional del Instituto Politécnico Nacional (CIIDIR–IPN) Jiquilpan, Michoacán, México. La cepa se cultivó inicialmente en medio Agar–Dextrosa– Sabouraud + 0.1 % de extracto de levadura (ADS+EL). Se incubó durante 10 días a 25 ± 1 °C y fotoperíodo de 12:12 h.
Evaluación de sustratos
Los sustratos se conformaron por dos componentes: medios nutritivos y soportes en una proporción 1:1. Se evaluó grano de sorgo, arroz entero y sus subproductos industriales, grano de arroz quebrado ("granillo") y polvo de arroz ("pulido"), como medios nutritivos. Como soporte se utilizaron: "olote" de maíz, "bagazo" de caña de azúcar y "cascarilla" de arroz. La combinación entre medios y soportes dio origen a doce tratamientos. Como testigo se usó el grano de arroz entero solo. Los materiales se colocaron en bolsas de polipapel y se esterilizaron en autoclave a 120 °C durante 15 min; se inocularon con 10 mL de una suspensión de 1x106 conidios mL–1 de L. lecanii y se incubaron a 25 ± 1 °C y un fotoperíodo de 12:12 h. A los 10 días se evaluó la producción y viabilidad de conidios. Se tomó 1 g del sustrato y se suspendió en 10 mL de agua destilada estéril. El número de conidios se calculó mediante un hematocitómetro y la concentración (esporas mL–1) se calculó con la fórmula propuesta por Lipa y Slizynski (1973).
C= (Cc)(4 x 106)(Fd)/80
donde:
C= Número de conidios mL–1
Cc= Número promedio de conidios contados en el hematocitómetro y
Fd= Factor de dilución.
Finalmente, se calculó la producción de conidios por gramo de sustrato. Los resultados se sometieron al análisis de varianza (ANVA) en un diseño experimental completamente al azar en arreglo factorial A x B donde A= Medio, B= Soporte; A tuvo 4 niveles, B tuvo 3 niveles.
Pruebas de patogenicidad
La patogenicidad de los conidios cosechados de cada tratamiento se evaluó en los áfidos T. aurantii y Aphis gossypii. En ambos casos se utilizaron recipientes de plástico y en su interior se colocó una placa de agar–agua (Hall, 1976); sobre ella una hoja de cítrico o de chile, según el áfido utilizado. T. aurantii se colectó de plantaciones de cacao y se mantuvo sobre hojas de cítrico. A. gossypii se desarrollo en plantas de chile. Por tratamiento se utilizaron 20 áfidos adultos, mismos que fueron inmersos por 5 s en una suspensión de 1 x 106 conidios mL–1 y posteriormente secados y colocados en los recipientes señalados e incubados a 25 °C. La variable respuesta fue el número de áfidos muertos desde el segundo hasta el sexto día y se incluyó un testigo sin tratar. El experimento se repitió tres veces. Transformados los datos con la expresión arcoseno de la proporción (Little y Hills, 1976; Soper et al., 1988), se sometieron al ANVA.
Las medias se separaron mediante la prueba de Tukey (p= 0.05).
Efecto de sustratos
El análisis estadístico reveló diferencias significativas (p<0.05) entre las combinaciones de soportes y medios nutritivos evaluados para la producción del hongo. El bagazo proporcionó las mejores condiciones para la producción conidial de L. lecanii (605.6 ± 154.8). Este material está disponible en los ingenios azucareros, en donde constituye actualmente una fuente de contaminación al no tener un uso específico. Una desventaja que presentó fue que ocasionalmente perforó las bolsas en donde se cultivó el hongo y ocasionó contaminación del material. Situación parecida se observó con la cascarilla de arroz, que además fue el soporte menos eficiente en la producción de conidios (278.8±20.6) (Cuadro 1).
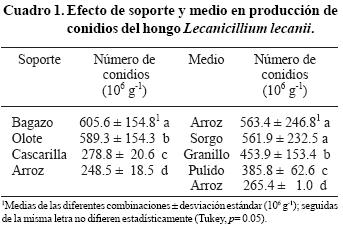
Los mejores medios nutritivos fueron arroz (563.4 ± 246.8) y sorgo (561.9 ± 232.5), mientras que el menos favorable fue el pulido de arroz (3 85.8 ± 62.6). Todas las combinaciones de soportes y medios proporcionaron mayor producción conidial (p< 0.05) que el arroz solo (265.4 ± 1.0) (Cuadro 1).
En cuanto a la interacción del soporte con los medios (sustratos), los resultados indicaron diferencias significativas (p< 0.05) en los tratamientos. Las combinaciones de sustrato de arroz + bagazo de caña (839.67 ± 1.2 x 106 g–1) y sorgo + olote (825.8 ± 1.7 x 106 g–1) mostraron la mayor producción conidial. El sustrato menos eficiente fue el de arroz solo (265.4 ± 1.0 x 106 g–1) (Figura. 1). Al parecer, el efecto de los soportes en la producción del hongo fue solamente físico, ya que en pruebas preliminares donde se sembró el hongo en el soporte solo, éste no se desarrolló.
Es probable que todos los sustratos produjeran más conidios que el testigo (arroz solo) por la menor compactación de la mezcla soporte y medio en comparación con el testigo. Cortez (2001) indicó que la baja producción de conidios de la cepa C(3) de L. lecanii pudo deberse a la alta compactación que ejerce el hongo sobre el arroz como medio, lo que evita que exista aireación interna y, consecuentemente, se reduzca la producción conidial. Los resultados obtenidos demuestran que el hongo L. lecanii produce mayor cantidad de conidios cuando se cultiva en sustratos que le permiten mayor aireación. Dado que 1 g de los sustratos evaluados tiene mayor volumen y área de crecimiento que 1 g de arroz, también tiene mayor producción conidial g–1.
La ventaja de este sistema de cultivo es que abarata costos de producción de hongos entomopatógenos. Los resultados obtenidos sugieren que, al contar con medios más eficientes y económicos para producir hongos entomopatógenos, el precio final del bioinsecticida será menor y competirá con los insecticidas organosintéticos. Contar con productos más económicos y eficientes facilita que los productores de bajos recursos puedan incorporarlos a sus sistemas agrícolas. Pocos trabajos han descrito la producción de medios económicos de hongos entomopatógenos. Puzari et al. (1997) consignan la producción de un bioinsecticida a base del hongo Beauveria bassiana cultivado en un medio con cascarilla de arroz, pulido de arroz y aserrín, con una mortalidad en plagas del arroz cercana a 80%.
Patogenicidad del hongo
La evaluación de la patogenicidad de los conidios sobre el áfido T. aurantii, mostró diferencias significativas (p< 0.05) entre los tratamientos, donde los mejores fueron los producidos en sorgo y olote (100.0 ± 0.0), arroz y bagazo (95.0 ± 5.0), granillo y olote (91.7 ± 2.8) y todas las combinaciones con cascarilla de arroz. La combinación menos eficiente fue pulido y bagazo (43.3±5.7), incluso menor al arroz solo (73.3 ± 7.6) (Cuadro 2).
En el áfido A. gossypii se observó una tendencia similar a la registrada con T. aurantii (Cuadro 3), confirmándose la importancia del medio de cultivo en la calidad de los conidios del hongo L. lecanii. Por lo tanto, es importante no sólo conocer el proceso y eficiencia de producción de conidios sino también la calidad de éstos en cuanto a su patogenicidad. Los resultados sugieren que la mayor o menor patogenicidad de los conidios obtenidos con los diferentes sustratos posiblemente se deba a la calidad nutritiva de los medios, pero también puede obedecer a la influencia de los soportes: cuando el hongo se cultivó en arroz solo, la patogenicidad fue menor que cuando se cultivó en arroz + bagazo, lo que sugiere que en este caso la aireación proporcionada por el soporte juega un importante papel en esta característica de L. lecanii. En general, los medios con partículas más pequeñas (pulido, granillo y sorgo) fueron mejores cuando se combinaron con la cascarilla de arroz que con los otros soportes. Aunque se ha mencionado que L. lecanii se desarrolla en casi cualquier medio de cultivo (Hall, 1981), los resultados obtenidos en el presente estudio complementan los de trabajos previos (Easwaramoorthy y Jayaraj, 1977; Cortez et al., 2003), al respecto de la relación entre la producción y calidad de los conidios obtenidos de L. lecanii y el medio de cultivo usado.
Los resultados indican que se obtuvieron sustratos más económicos y eficientes que el tradicional (arroz) para la producción masiva del hongo L. lecanii. Al abatir el costo de producción, se abren perspectivas para su mayor uso como biorregulador de insectos nocivos para la agricultura.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONACYT)–Sistema Golfo (SIGOLFO), y a la Fundación PRODUCE–Tabasco, México por el apoyo económico brindado para el desarrollo de la presente investigación.
LITERATURA CITADA
Cisneros, F. and Vera, A. 2000. Mass–producing Beauveria brongniartii inoculum, an economical, farm–level method. Program Report, Centro Internacional de la Papa. Lima, Perú. p 155–160. [ Links ]
Cortez–Madrigal, H. 2001. Selección de aislamientos del hongo Verticillium lecanii (Zimm.) Viegas para el manejo del pulgón negro del cacao Toxoptera aurantii Boyer en Tabasco, México. Tesis Doctoral, Colegio de Postgraduados, Montecillo, Texcoco, Estado de México, México. 110 p. [ Links ]
Cortez–Madrigal, H.; Alatorre–Rosas, R; Mora–Aguilera, G.; Bravo–Mojica, H.; Ortiz– García, C.F. y Aceves–Navarro, L. A. 2003. Caracterización cultural y patogénica de diferentes aislamientos del hongo Lecanicillium (= Verticillium) lecanii. Rev. Mex. de Fitopatol. 21:161–167. [ Links ]
Easwaramoorthy, S., and Jayaraj, S. 1977. The effect of temperature, pH, and media on the growth of the fungus Cephalosporioum lecanii J. Invert. Pathol. 29:399–400. [ Links ]
Hall, R. A. 1976. A bioassay of the pathogenicity of Verticillium lecanii conidiospores on the aphid, Macrosiphoniella sanborni. J. Invert. Pathol. 27:41–48. [ Links ]
Hall, R. A. 1981. The fungus Verticillium lecanii as a microbial insecticide against aphids and scales. In: Burges, H. D. (ed.). Microbial Control of Pests and Plants Disease. Academic Press, New York. p. 483–498. [ Links ]
Khachatourians, G. G.; Valencia, E. P. and Miranpuri, G. S. 2002. Beauveria bassiana and other entomopathogenic fungi in the management of insect pests. In: Opender, K. and Dhaliwal, G. S. (ed.) Microbial Biopesticides. New Delhi. p. 279–275. [ Links ]
Lipa, J. J. and K. Slizynsky. 1973. Wskazówki metodyczne I. Terminologóa do wyznaczania srednej dawki smiertelnej (LD50) W Patologia Owadow I Tksykologia. Prace Navkome Instytutu ochrony Roslin Tom. XV, Seszyti: 59–83. [ Links ]
Little, T. M. y F. J. Hills. 1976. Métodos estadísticos para la investigación en la agricultura. Trad. de la 1a. ed. Paula–Crespo. Trillas, México. pp. 125–143. [ Links ]
López–Llorca, L. V. and Carbonell, T. 1998. Use of almond mesocarp for production of entomopathogenic fungus Verticillium lecanii. Can. J. Microbiol. 44:886–895. [ Links ]
Puzari, K. C.; Sarma, D. K. and Hazarika, L. K. 1997. Medium for mass production of Beauveria bassiana (Balsamo) Vuillemin. J. Biol. Contr. 11:97–100. [ Links ]
Soper, R. S.; M. Shimazu; R. A. Humber; M. E. Ramos; and A. E. Hajek. 1988. Isolation and characterization of entomophaga Maimaiga sp. nov., a fungal pathogen of gypsy moth, Lymantria dispar, from Japan. J. Invert. Pathol. 51:229–241. [ Links ]
Tanada, Y.; and Kaya, H. K. 1993. Insect Pathology. Academic Press. San Diego, USA. 666 p. [ Links ]
Zare, R. and Gams, W. 2001. A revision of Verticillium sect. Prostata. IV. The genera Lecanicillium and Simplicillium gen nova. Nova Hedwigia 73:1–50. [ Links ]














