Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agricultura técnica en México
versión impresa ISSN 0568-2517
Agric. Téc. Méx vol.33 no.1 México ene./abr. 2007
Artículos
EL CONSUMO DE FRIJOL COMÚN (Phaseolus vulgaris L.) Y SU EFECTO SOBRE EL CÁNCER DE COLON EN RATAS SPRAGUE–DAWLEY*
COMMON BEAN (Phaseolus vulgaris L.) CONSUMPTION AND ITS EFFECTS ON COLON CANCER IN SPRAGUE–DAWLEY RATS
Rosalía Reynoso Camacho1 , María del Carmen Ríos Ugalde1, Irineo Torres Pacheco2, Jorge Alberto Acosta Gallegos3, Ana Cristina Palomino Salinas1, Minerva Ramos Gómez1, Eva González Jasso4 y Salvador Horacio Guzmán Maldonado2
, María del Carmen Ríos Ugalde1, Irineo Torres Pacheco2, Jorge Alberto Acosta Gallegos3, Ana Cristina Palomino Salinas1, Minerva Ramos Gómez1, Eva González Jasso4 y Salvador Horacio Guzmán Maldonado2
1 Programa de Posgrado en Alimentos del Centro de la República (PROPAC). Universidad Autónoma de Querétaro. Apartado Postal 184, Cerro de las Campanas s/n, Col. Las Campanas. 76010, Querétaro, Querétaro.
2 Unidad de Biotecnología, Campo Experimental Bajío, INIFAP.
3 Programa de Frijol. Campo Experimental Bajío, INIFAP.
4 Centro de Investigación en Ciencia Aplicada y Tecnología Avanzada–IPN, Unidad Querétaro.
 Autora para correspondencia:
Autora para correspondencia:
rrcamachomx@yahoo.com.mx
* Recibido: Junio de 2006
Aceptado: Enero de 2007
RESUMEN
Se cree que la baja incidencia de cáncer de colon observada en algunos países de América Latina, en comparación con países desarrollados, es consecuencia del mayor consumo de frijol, entre otros factores. El objetivo de la presente investigación fue determinar si el consumo de frijol común reduce la incidencia de esta enfermedad, inducida químicamente por medio de inyección de 1,2 dihidroclonuro de dimetilhidrazina (DMH) en ratas Sprage–Dawley. Se utilizaron cuatro variedades de frijol de los tipos con mayor demanda en México, administrándose a las ratas en cantidades similares al promedio de consumo actual en México (0.30/100 g de alimento, equivalente a 11 kg por persona por año). En harinas de frijol cocido se cuantificó el contenido de: taninos, antocianinas, azúcares solubles y compuestos fenólicos. La alta concentración de taninos en la variedad Flor de Junio Marcela se relacionó con una baja ganancia de peso (30%) y supervivencia de las ratas (35%). La incidencia de lesiones en forma de placas fue mayor en la parte distal del colon en ratas alimentadas con las variedades Pinto Zapata, Flor de Mayo Anita y Flor de Junio Marcela; las alimentadas con frijol Blanco Tlaxcala (0.30/100 g de alimento) y Flor de Junio Marcela (75/100 g de alimento), mostraron mayor incidencia de placas en la parte media y proximal del colon y disminuyeron entre 10 y 12% la carcinogénesis del colon. El consumo de frijol cv. Pinto Zapata redujo 36% la incidencia, número y volumen de tumores (1 y 0.043 cm3, respectivamente) comparado con el número (2 a 4) y volumen de tumores (0.055 a 0.95 cm3) en ratas alimentadas con las otras variedades. A pesar de las diferencias en la composición química de las variedades de frijol, no se determinó relación alguna entre los compuestos estudiados y los resultados de incidencia del cáncer de colon. Los resultados mostraron que el consumo del grano redujo la incidencia de tumores cancerígenos en ratas Sprague–Dawley.
Palabras clave: Phaseolus vulgaris L., cáncer de colon, fitoquímicos.
ABSTRACT
The lower incidence of colon cancer registered in Latin–American countries as compared with other countries, is partially due to the higher consumption of common bean. The objective of the present research was to determine if the consumption of cooked common bean would reduce 1,2 dimethylhydrazine–induced colon carcinogenesis in Sprage–Dawley rats. Four common bean cultivars belonging to commercial classes of high consumption in Mexico were fed at the current average bean consumption in Mexico (0.30/100 g food; equivalent to 11 kg per person per year). Tannins, anthocyanins, phenolic components and oligosaccharides were quantified in dry flour of cooked grain from the four cultivars. The high tannin content in the seed of cultivar Flor de Junio Marcela might have contributed to a low weight increase (30%) and low survival of rats (35%). The incidence of plaque was higher in the distal portion of the colon in rats fed with Pinto Zapata, Flor de Mayo Anita and Flor de Junio Marcela cultivars. Rats fed with cultivars Blanco Tlaxcala (0.3 0/100 g food) and Flor de Junio Marcela (75/100 g food) showed higher incidence of plaques in the middle and proximal portion of the colon and showed a 10–12% reduction in colon carcinogenesis. The consumption of cv. Pinto Zapata reduced 36% the incidence of colon cancer and a lower number and volume of tumours (1 and 0.043 cm3, respectively) as compared with the number (2 to 4) and volume of tumours (0.055 to 0.095 cm3) observed with the consumption of the other bean cultivars. In spite of differences in the phytochemical content in the seed of the bean cultivars, none relationship was observed between those compounds and colon cancer in rats. Results indicated that the inclusion of common bean in the diets reduced colon cancer in Sprage–Dawley rats.
Key words: Phaseolus vulgaris L., colon cancer, phytochemicals.
INTRODUCCIÓN
El frijol común no sólo es una buena fuente de proteína y carbohidratos complejos, también aporta vitaminas y minerales en cantidad relativamente adecuada (Guzmán–Maldonado et al., 2000) y contiene metabolitos secundarios como taninos, antocianinas, compuestos fenólicos y fibra, entre otros (Guzmán–Maldonado et al., 1996; De Mejía et al., 2003). Existe evidencia de que estos compuestos, identificados como fitoquímicos (DeFelice, 1995), juegan un papel importante en la prevención y el tratamiento de ciertas enfermedades.
Loarca–Piña et al. (1996) y Cardador–Martínez et al. (2002) reportaron que los taninos de frijol negro inhiben la actividad mutagénica de la aflatoxina B1, del benzo (a) pireno (De Mejía et al., 1999) y de la ciclofosfamida en ratones (Azevedo et al., 2003). Los ácidos gálico, clorogénico y caféico inhiben la capacidad mutágenica de varios compuestos (Ohshima y Bartsch, 1983; Stich y Rosin, 1984).
No se tienen estudios in vivo sobre el efecto de los compuestos fenólicos del frijol sobre la salud; sin embargo, se sabe que la rutina extraída de la soya protege contra el cáncer de colon en ratas (Carr, 1985). Además, las antocianinas de Myrica rubra, una baya de origen chino, actúan como antioxidantes (Bao et al., 2005), inhiben el crecimiento de células cancerosas (Hou et al., 2004) e inducen la apoptosis (Heo y Lee, 2005; Hou et al., 2004).
Otros componentes del frijol, los oligosacáridos, no son hidrolizados en el estómago ni en el intestino delgado y pasan al colon donde son fermentados por bacterias benéficas para producir ácidos grasos de cadena corta, como el butírico que inhibe la proliferación celular e induce la apoptosis de células de cáncer de colon (Barnard y Warwick, 1993).
En México, los tumores del tracto digestivo fueron el tercer tipo de neoplasma más frecuente en 1990 (Parra–Cabrera et al., 1994). Se cree que el cambio del patrón alimenticio de la población ha incrementado el cáncer del sistema digestivo. En los años setenta la dieta de la población Mexicana estaba constituida principalmente por tortilla y frijol. Sin embargo, el modelo de alimentación ha cambiado incrementándose el consumo de alimentos de alto contenido calórico (grasa de origen animal y almidones procesados), lo que redujo el consumo de tortilla y frijol. En 1996 una persona consumía en promedio 22 kg de frijol en un año (Castellanos et al., 1997); mientras que para 2003 el consumo per cápita descendió a 14.9 kg para el mismo periodo (FIRA–SAGARPA, 2003). Se estima que en la actualidad el consumo es de 11 kg/año. Con base en estos datos, Parra–Cabrera et al. (1994) concluyen que la disminución en el consumo de este alimento, además de otros factores, ha contribuido al aumento significativo en la incidencia de cáncer en el tracto intestinal de los mexicanos.
Se ha demostrado que la baja incidencia de cáncer de colon observada en algunos países de América Latina, en comparación con otros, podría atribuirse al consumo de frijol común (Anderson et al., 1999). Al respecto, se ha reportado que ratas inducidas al cáncer de colon, y alimentadas con frijol pinto, blanco y negro, desarrollaron cuatro veces menos tumores que las ratas alimentadas sin frijol (Hughes et al., 1997; Hangen y Bennink, 2002).
El objetivo de la presente investigación fue evaluar el efecto del consumo de grano de cuatro cultivares de frijol común de alta demanda en México, con base en una ingesta similar a la de la población mexicana (11 kg/año), sobre cáncer de colon inducido químicamente en ratas, y determinar la asociación entre la posible protección de los taninos, antocianinas, azúcares solubles y compuestos fenólicos contenidos en el grano de frijol y el menor desarrollo de la enfermedad.
MATERIALES Y MÉTODOS
Animales
Se utilizaron 180 ratas machos Sprague–Dawley de seis semanas de edad, adquiridas en Harland (Tecland, México). Los animales se mantuvieron en un bioterio con humedad relativa (40–50%) y temperatura (22–24 °C) controlada, con períodos de luz y oscuridad de 12 h durante toda la fase experimental. Las ratas se aclimataron durante una semana en cajas de acrílico con suministro de agua y una dieta básica ad libitum.
Cultivares de frijol y dietas
Se utilizó grano de cuatro cultivares de frijol: Pinto Zapata, Flor de Mayo Anita, Flor de Junio Marcela (Phaseolus vulgaris L.) y Blanco Tlaxcala (P. coccineus L. ) cosechadas en 2004. los tres primeros cultivares se seleccionaron por representar tipos de frijol de alta demanda en México (Castellanos et al., 1997). Después de la cosecha, el grano de cada cultivar se manejo en forma uniforme de almacenamiento y en el laboratorio se coció, sin remojo, en agua potable en una olla con aislamiento térmico y temperatura controlada (95 °C). Una vez cocidos, los granos se secaron en un horno de convección a 60 °C por 12 h, enfriados a temperatura ambiente y molidos en molino de aspas (PULVEX 200), equipado con una malla de 0.5 mm.
Después de moler la croqueta comercial para rata (Tecland), se mezcló con la harina de frijol de cada cultivar a una concentración de 0.30 g de frijol por cada 99.7 g de croqueta molida (Cuadro 1). Esta concentración permitió que las ratas ingirieran el equivalente al consumo promedio anual per cápita de frijol en México (11 kg). Con fines comparativos, se preparó una dieta con 75% de harina de frijol Flor de Junio Marcela y 25% de la croqueta molida de acuerdo con el reporte de Hughes et al. (1997). El grupo control fue alimentado con la croqueta comercial molida sin frijol. En el Cuadro 1 se muestra la composición del alimento comercial y las dietas utilizadas.
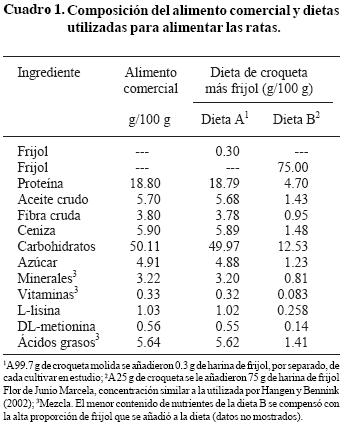
Taninos
Se tomó una muestra de 200 mg de harina de cada variedad de frijol y de la croqueta comercial. La extracción se realizó con 10 ml de metanol por 20 min a temperatura ambiente y agitación constante (Price y Butler, 1977). Posteriormente se centrifugó a 1000 g durante 30 min. Se tomó 1 ml del sobrenadante y se le adicionaron 5 ml del reactivo de la vainillina (partes iguales de 8% de HCl en metanol y 1% de vainillina en metanol). Las muestras se incubaron a 30 °C durante 20 min y la absorbancia se midió en un espectrofotómetro a una longitud de onda de 500 nm. El contenido de taninos se calculó tomando como referencia una curva de calibración de (+) catequina y se reportaron como mg equivalentes de catequina por 100 g de muestra (mg EC/100 g).
Antocianinas
Muestras de harina de frijol cocido de cada variedad se sometieron a una extracción con metanol (5% HCl) (Abdel–Aal y Hucl, 1999) con agitación constante durante 3 h a temperatura ambiente, protegidas de la luz y se centrifugaron. El sobrenadante fue liofilizado y almacenado a –20 °C en frasco ámbar en una atmósfera de nitrógeno hasta su análisis. El contenido de antocianinas fue calculado comparando las lecturas espectrofotométricas de las muestras con una curva estándar de cianidina–3–glucósido (C–3G) y se reportaron como mg equivalentes de C3G por 100 g de muestra (mg EC3G/100g).
Azúcares solubles
Con base en el método reportado por Dubois et al. (1956), se pesaron 10 mg de cada muestra de harina y se sometieron a una extracción con 10 ml de etanol al 80%. La muestra se agitó 15 min y se centrifugó a 1700 g durante 5 min. Se recuperó 1 ml del sobrenadante al que se le agregaron 50 μl de fenol 80%; se agitó y se le adicionaron directamente 5 ml de ácido sulfúrico; nuevamente se agitó, se dejó reposar 10 min y se incubó por 15 min en baño María a 30 °C. Inmediatamente después la absorbancia fue leída a 490 nm en un espectrofotómetro (Jenway). Los azúcares solubles se calcularon con base en una curva de glucosa y se reportaron como mg equivalente de glucosa por 100 g de muestra (g EG/100 g).
Otros compuestos fenólicos
A 100 mg de muestra de harina se le añadieron 20 ml de metanol:agua (30:70 v/v), se agitó 10 min y centrifugó a 1700 g durante 30 min. El sobrenadante se guardó en viales de color ámbar para protegerlo de la luz. Las muestras fueron analizadas por cromatografía líquida de alta resolución (HPLC, por sus siglas en inglés) en un equipo Agilent (Modelo 1100) equipado con dos bombas, un inyector de 100 μl de capacidad y una columna marca Zorbax (150 x 4.6 mm). La fase móvil consistió en dos soluciones A y B, la primera (A): ácido acético (2%) en agua, y la segunda (B): agua: ácido acético (2%): acetonitrilo (30%). Se utilizó un gradiente de la solución A al 10% al tiempo inicial hasta 100% de la solución B después de 30 min de corrida, con un flujo de 1 ml/min. La temperatura de corrida fue de 25 °C. Para la detección de los compuestos fenólicos, se utilizó un detector UV (G1362A, Agilent 1100) a una longitud de onda de 280 nm.
Para la identificación de los compuestos fenólicos, se preparó una mezcla de 15 estándares de estos componentes a una concentración de 1 mg/ml en una solución de metanol al 3 0%, la cual se inyectó al cromatógrafo en las mismas condiciones que las muestras. El contenido de fenólicos en las muestras se reportó en mg/100 g de muestra comparando los picos con tiempos de retención similares entre las muestras y los estándares (ácido benzoico, caféico, clorogénico, cumárico, ferúlico, gálico, 4–hidroxibenzóico, 3,4–dihidroxibenzóico, protocatecóico, salicílico, siríngico y vanílico, catequina, rutina y vainillina (SIGMA), a una concentración de 1 mg por estándar para la curva).
Inducción del cáncer de colon con la 1,2 dimetilhidrazina (DMH)
Las ratas fueron divididas en seis grupos de 20 animales cada uno. Durante el período de aclimatación los grupos fueron alimentados con la dieta comercial molida. Posteriormente, los primeros cinco grupos recibieron dietas preparadas con la mezcla de harinas de croqueta y las variedades de frijol. El grupo 6 sólo recibió la harina de la dieta comercial. Después de cuatro semanas bajo este régimen, las ratas fueron tratadas con el carcinógeno 1,2 dimetichideazina DMH (21 mg/kg de peso corporal disuelta en 0.37 mg/ml EDTA, 0.9% NaCl) vía subcutánea, una vez por semana durante ocho semanas. Los animales continuaron alimentándose con las dietas de frijol y croqueta comercial durante la fase de inducción del cáncer de colon (nueve semanas después del tratamiento con el carcinógeno) y el peso corporal de los animales se registró semanalmente.
Análisis macroscópico de lesiones y tumores
Las ratas se sacrificaron a las 17 semanas después de la primera inyección con DMH, bajo anestesia con éter y se sometieron a una autopsia para la disección y análisis de los tejidos. El colon fue retirado y abierto longitudinalmente. Se lavó con una solución salina fisiológica fría. La pared interior del colon fue examinada visualmente para el conteo y localización de placas y tumores. El tamaño de las lesiones y tumores (longitud, ancho y grueso) fue medido con un Vernier (Mitutoyo, 0.1 mm de graduación).
Análisis estadístico
Los resultados fueron expresados como medias de tres repeticiones ± DE. Se aplicó un análisis de varianza a cada uno de los parámetros estudiados y se determinaron las diferencias entre medias de tratamientos con la prueba de Tukey (p<0.05) (Steel y Torrie, 1982).
RESULTADOS Y DISCUSIÓN
Fitoquímicos del frijol
El grano del cultivar Flor de Junio Marcela presentó la más alta concentración de taninos (689.4 mg EC/100 g) en comparación con el de los otros cultivares, 3.5 veces más que en el grano de Pinto Zapata, nueve veces más que Flor de Mayo Anita y más de mil veces que el contenido de Blanco Tlaxcala (Cuadro 2). La concentración de taninos observada fue similar a la reportada por Guzmán–Maldonado et al. (1996 y 2000) y De Mejía et al. (2003). Por otro lado, el cultivar Flor de Junio Marcela presentó 3.75 mg EC3G/100 g de antocianinas, concentración significativamente mayor a la de los otros cultivares estudiados. El cultivar Blanco Tlaxcala mostró un contenido de azúcares solubles significativamente (100%) mayor a Pinto Zapata y Flor de Junio Marcela. La presencia de estos compuestos entre los que se incluye a los oligosacáridos es importante por el papel benéfico contra el cáncer de colon (Barnard y Warwick, 1993).
Con respecto a los compuestos fenólicos, el grano del cultivar Pinto Zapata fue el único que presentó ácido siríngico, vainillina y catequina (Cuadro 2). Se sabe que la actividad antioxidante de estos compuestos se debe a su capacidad para atrapar radicales libres (Azevedo et al., 2003).
Consumo de alimento, ganancia de peso y supervivencia de los animales
El grupo de ratas alimentadas con la dieta A y el control positivo consumió en promedio 23 g de alimento/día, por lo que se estimó un consumo de frijol por rata, en proporción a su peso, equivalente a 11 kg que representa el consumo anual de una persona de 70 kg de peso. El grupo de ratas alimentado con la dieta B (75% de frijol), consumieron en proporción 250 veces más el equivalente a 11 kg de frijol.
No se observaron diferencias significativas en la ganancia de peso entre las ratas alimentadas con la dieta A y el control (p<0.05, Figura 1). El grupo alimentado con la dieta B (Flor de Junio Marcela, 75%), presentó menor incremento (p<0.05) en peso comparado con el resto. Durante el primer mes del experimento, los animales alimentados con la dieta B consumieron menor cantidad de alimento. Es probable que la administración del carcinógeno y la alta concentración de frijol afectaran la ganancia de peso. El porcentaje de supervivencia de las ratas alimentadas con la dieta B fue 35, el cual resultó significativamente menor al observado en las ratas alimentadas con la dieta A y el control (Figura 2). Las ratas alimentadas con la dieta A que contenía frijol Flor de Junio Marcela presentaron menor supervivencia (52%, p<0.05) que el resto de los grupos y el control (Figura 2).
Aparentemente el alto contenido de taninos de la variedad Flor de Junio Marcela (Cuadro 2) disminuyó la biodisponibilidad de proteínas y minerales, afectando la ganancia de peso y la supervivencia de los animales (Chung et al., 1998; Frossard et al. , 2000); lo cual sugiere que pudo haberse presentado un efecto antagónico de los taninos, que ya ha sido reportado (De Mejía et al., 2003). No se observó ninguna relación entre el contenido de antocianinas, la ganancia de peso y la supervivencia de las ratas. Se sabe que estos compuestos no son tóxicos a niveles hasta 20 veces mayores que las que contiene el frijol (Mazza, 1995).
Formación de placas y tumores
Las ratas que recibieron la dieta A con el cultivar Flor de Junio Marcela presentaron el mayor número de placas (lesiones planas precancerosas que sobresalen ligeramente de la mucosa del colon, Teague, 1983) (p<0.05); mientras que el grupo control presentó el mayor número de tumores (3/rata) (Figura 3). En contraste, las ratas alimentadas con frijol Pinto Zapata presentaron menos de un tumor por rata y hasta dos placas por rata.
Estos resultados sugieren que el consumo de grano de frijol cultivar Pinto Zapata detuvo la evolución del cáncer al mantener el daño en lesiones (placas) que no se transforman en tumores. Es importante señalar que este cultivar tiene un contenido de fitoquímicos diferente al resto de los cultivares, incluyendo el ácido siríngico que podría contribuir a la protección contra el cáncer de colon en forma sinérgica con los otros compuestos (Akagi et al., 1995).
Por otro lado, Hangen y Bennink (2002) reportaron que la incidencia de tumores en ratas alimentadas con frijol fue menor en la parte proximal y mayor en la parte distal del colon. Estos resultados no coinciden con los observados en esta investigación (datos no mostrados) dado que todos los grupos de ratas alimentados con frijol presentaron menor incidencia de tumores en la parte distal. La justificación dada por Hangen y Bennink (2002) fue que la fermentación del almidón resistente y la fibra soluble ocurre en la parte proximal del colon y la concentración de ácidos grasos de cadena corta se va reduciendo paulatinamente en la parte media y distal, disminuyendo su efecto protectivo (Gamet et al., 1992; Barnard y Warwick, 1993) al inducir la apoptosis celular de cáncer de colon (Hague et al., 1993). Sin embargo, la fibra insoluble del frijol también arrastra almidón resistente, fibra soluble y oligosacáridos hasta el colon distal donde son fermentados. Hangen y Bennink (2002) reportaron que la mayor concentración de ácidos grasos se presentó en la parte distal del colon en las ratas que fueron alimentadas con frijol.
Distribución por el número y tipo de lesión
En el grupo control 29% de las ratas presentaron dos placas y el 100% de los animales de uno a cuatro tumores (Cuadro 3); mientras que del grupo de ratas alimentado con la dieta A que contenía frijol Pinto Zapata, el 97% presentó de una a tres placas, pero solo 64% de los animales desarrollaron un tumor.
El consumo de frijol Pinto Zapata disminuyó la incidencia en la formación de tumores en un 36%. Por el contrario, a pesar de que el grupo alimentado con frijol Blanco Tlaxcala presentó la más baja incidencia de placas (28%), la capacidad para disminuir la incidencia de tumores en el colon fue solo del 11%, nivel similar a la variedad Flor de Junio Marcela con ambas dietas A y B (Cuadro 3). La variedad Flor de Mayo Anita no mostró ningún efecto en la disminución de tumores en ratas.
Estudios anteriores con frijol y cáncer de colon señalan que el frijol negro y blanco disminuyen la incidencia de la enfermedad en 54% y 59%, respectivamente (Hangen y Bennink, 2002). Esos niveles de inhibición son mayores que los resultados de la presente investigación, lo cual puede deberse al tipo de carcinógeno utilizado por estos autores (azoximetano), el tipo de dieta suministrada a las ratas, así como el tipo de frijol utilizado. Hughes et al. (1997) reportaron una reducción del cáncer de colon del 24% en ratas alimentadas con frijol pinto, resultado similar al localizado en esta investigación con el cultivar Pinto Zapata.
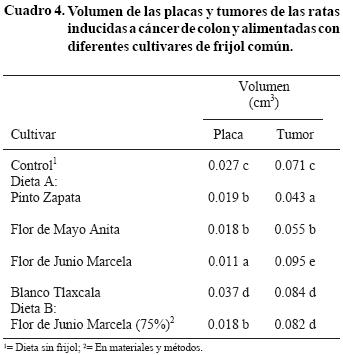
Volumen de placas y tumores
Se observó que los tumores en las ratas alimentadas con la dieta A con Pinto Zapata, presentaron un menor volumen (p<0.05) comparado con los demás tratamientos (Cuadro 4). El volumen de los tumores en las ratas alimentadas con el cultivar Flor de Junio Marcela (dietas A y B) fue el doble que el volumen de los tumores de las ratas alimentadas con Pinto Zapata.
CONCLUSIONES
El consumo de frijol inhibió la incidencia de cáncer de colon en ratas Sprague–Dawley, efecto casi cuatro veces mayor con grano de Pinto Zapata que en el resto de los cultivares estudiados.
El consumo de grano del cultivar Pinto Zapata disminuyó en número y volumen de tumores y redujo el número de placas que evoluciona a tumores en ratas Sprague–Dawley.
Los fitoquímicos determinados en el grano de los cultivares de frijol estudiados no mostraron relación alguna con la disminución en la incidencia de cáncer de colon en ratas Sprague–Dawley.
LITERATURA CITADA
Abdel–Aal, E. S. M. and Hucl, P. 1999. A rapid method for quantifying total anthocyanins in blue aleurone and purple pericarp wheats. Cereal Chemistry. 76(3):350–354. [ Links ]
Akagi, K.; Hirose, M.; Hoshiya, T.; Mizoguchi, Y.; Ito, N. and Shirai, T.1995. Modulating effects of ellagic acid, vanillin and quercetin in a rat medium term multi–organ carcinogenesis model. Cancer Lett. 94:113–21. [ Links ]
Anderson, J. W., Smith, B. M. and Washnock, C. S. 1999. Cardiovascular and renal benefits of dry bean and soybean intake. Am. J. Clin. Nutr. 70:464S–474S. [ Links ]
Azevedo, L.; Gomes, J. C.; Stringheta, P. C.; Gontijo, A. M. M. C.; Padovani, C. R.; Ribeiro, L. R. and Salvadori, D. M. F. 2003. Black bean (Phaseolus vulgaris, L.) as a protective agent against DNA damagen in mice. Food Chem Toxicol. 41:1671–1676. [ Links ]
Bao, J.; Cai, Y.; Sun, M.; Wang, G. and Corke, H. 2005. Anthocyanins, flavonols, and free radical scavenging activity of Chinese bayberry (Myrica rubra) extracts and their color properties and stability. J. Agric. Food Chem. 53:2327–2332. [ Links ]
Barnard, J. A. and Warwick, G. 1993. Butyrate rapidly induces growth inhibition and differentiation in HT–29 cells. Cell Growth Differ. 4:495–501. [ Links ]
Cardador–Martínez, A.; Loarca–Piña, G. and Oomah, B. D. 2002. Antioxidant avtivity in common bean (Phaseolus vulgaris L.) J. Agric. Food Chem. 50:6975–6980. [ Links ]
Carr, C. J. 1985. Food and drug interactions. Xenobiotics in Food and Feeds, ACS Symposium 234. Finley, J. W. and Schwass, D. E. (eds.). Amercian Chemical Society, Washington, D. C., p. 221. [ Links ]
Castellanos, Z. J.; Guzmán–Maldonado, S. H.; Jiménez, A.; Mejía, C.; Muñoz–Ramos, J. J.; Acosta–Gallegos, J.; Hoyos, G.; López–Salinas, E.; González–Eguiarte, D.; Salinas–Pérez, R.; González–Acuña, J.; Muñoz–Villalobos, J. A.; Fernández–Hernández, P. y Cácares, B. 1997. Hábitos preferenciales de los consumidores de frijol común (Phaseolus vulgaris L.) en México. Archivos Latinoamericanos de Nutrición 47(2): 163–167. [ Links ]
Chung, K–T.; Wong, T. Y.; Wei, CH–I.; Huang, Y–W. and Lin, Y. 1998. Tannins and human health: A review. CRC. Crit. Rev. Food Sci. Nutr. 38:421–464. [ Links ]
DeFelice, S. L. 1995. The nutraceutical revolution: its impact on food industry. Trends Food Sci. Technol. 6:59–61. [ Links ]
De Mejía, E.; Castaño–Tostado, E. and Loarca–Piña, G. 1999. Antimutagenic effects of natural phenolic compounds in beans. Mutat. Res. 441:1–9. [ Links ]
De Mejía, E.; Guzmán–Maldonado, S. H.; Acosta–Gallegos, J. A.; Reynoso–Camacho, R.; Ramírez–Rodríguez, E.; González–Chavira, M. M.; Castellanos, J. Z. and Kelly, J. 2003. Effect of cultivar and growing location on the trypsin inhibitors, tannins, and lectins of common bean (Phaseolus vulgaris L.) grown in the semiarid highlands of Mexico. J. Agric. Food Chem. 51:5962–5966. [ Links ]
Dubois, M.; Gilles, K. A.; Hamilton, J. K.; Rebers P. A. and Smith, F. 1956. Colorimetric method for determination of sugars and related substances. Anal Chem. 28:350–356 (1956). [ Links ]
Fideicomisos Instituidos en Relación con la Agricultura–Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. (FIRA–SAGARPA). 2003. http://www.sagarpa.mx [ Links ]
Frossard, E.; Bucher, M.; Mächer, F.; Mozafar, A. and Hurrell, R. 2000. Potential for increasing the content and bioavailability of Fe, Zn, and Ca in plants for human nutrition. J. Sci. Food Agric. 80:861–879. [ Links ]
Gamet, L.; Daviaud, D.; Denispouxviel, C.; Ramsey, C. and Murat, J. C. 1992. Effects of short–chain fatty acids on growth and differentiation of the human colon cancer cell line HT–29. Int. J. Cancer 52:286–289. [ Links ]
Guzmán–Maldonado, H.; Castellanos–Ramos, J. Z. and González de Mejía, E. 1996. Relationship between theoretical and experimentally detected tannins of common beans (Phaseolus vulgaris L). Food Chemistry 55(4):333–335. [ Links ]
Guzmán–Maldonado, S. H.; Acosta–Gallegos, J. and Paredes–López, O. 2000. Protein characteristics and mineral contents of a novel collection of wild and weedy common bean (Phaseolus vulgaris L.). Journal of the Science of Food and Agriculture 80:1874–1881. [ Links ]
Hangen L. and Bennink, M. R. 2002. Consumption of black beans and navy beans (Phaseolus vulgaris) reduced azoxymethane–induced colon cancer in rats. Nutr. Cancer 44:60–65. [ Links ]
Hague, A.; Manning, A. M.; Huschtscha, L. I.; Hart, D. and Paraskeva, C. 1993. Sodium butyrate induces apoptosis in human colonic tumor cell lines in a p53–independent pathway: implications for the possible role of dietary fiber in the prevention of large bowel cancer. Int. J. Cancer 55:498–505. [ Links ]
Heo, H. J. and Lee, C. Y. 2005. Strawberry and its anthocyanins reduce oxidative stress–induced apoptosis in PC 12 cells. J. Agric. Food Chem. 53:1984–1989. [ Links ]
Hou, D–X.; Fujii, M.; Terahara, N. and Yoshimoto, M. 2004. Molecular mechanisms of the chemopreventive effects of antocyanidins. J. Biomed Biotechnol 5:321–325 [ Links ]
Hughes, J. S.; Ganthavorn, CH. and Wilson–Sanders, S. 1997. Dry bean inhibit azoxymethane–induced colon carcinogenesis in F344 rats. J. Nutr. 127:2328–2333. [ Links ]
Loarca–Piña, G.; Kuzmicky, P. A.; González de Mejía, E.; Kado, N. Y. and Hsieh, D. P. H. 1996. Antimutagenicity of ellagic acid against aflatoxin B1 in the Salmonella microsuspension assay. Mutat. Res. 60:15–21. [ Links ]
Mazza, G. 1995. Anthocyanins in grape and grape products. Crit Rev Food Sci Nutr 35:341–371. [ Links ]
Ohshima, H. and Bartsch, H. 1983. A new approach to quantitate endogenous nitrosation in humans. In: Carcinogens and Mutagens in the Environment, Vol. 2, Stich, H. F., Ed., CRC Press. Boca Raton, Fl., USA. p. 3. [ Links ]
Parra–Cabrera, S.; Fernández–Ortega, M. C.; Vandale–Toney, S. and López–Carrillo, L. 1994. Dietary fiber and gastro–intestinal tumors, implications for the Mexican population. Arch. Latinoam. Nutr. 44:76–81. [ Links ]
Price, M. L. and Butler, L. G. 1977. Rapid visual estimation and spectrophotometric determination of tannin content of sorghum grain. J. of Agric. and Food Chem. 25:1268–2274. [ Links ]
Steel, R. G. D. and Torrie, J. H. 1982. Principles and Procedures of Statistics. McGraw–Hill, Kogakusha, Tokio. [ Links ]
Stich, H. F. and Rosin, M. P. 1984. Naturally occurring phenolics as antimutagenic and anticarcinogenic agent. In: Nutritional and Toxicological Aspects of Food Safety, Friedman, W. (ed.). Adv. Exp. Med. Biol. 177:1–25. [ Links ]
Teague, C. A. 1983. Morphological changes during chemical induction of colon cancer. In: Autrup, H. Willimas, G. M., (eds.). Experimental colon carcinogenesis. CRC Press. Boca Raton. Fl., USA. p. 107–124. [ Links ]














