Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agricultura técnica en México
versão impressa ISSN 0568-2517
Agric. Téc. Méx vol.32 no.2 México Mai./Ago. 2006
Artículos
Soluciones pulso en la calidad postcosecha de lisianthus (Eustoma grandiflorum Raf.) cv. 'echo blue'*
Pulse solutions in the postharvest quality of lisianthus (Eustoma grandiflorum Raf.) cv. 'echo blue'
Elia Cruz–Crespo1, Lourdes Arévalo–Galarza1, , Raquel Cano–Medrano1 y Elda Araceli Gaytán–Acuña1
, Raquel Cano–Medrano1 y Elda Araceli Gaytán–Acuña1
1 Instituto de Recursos Genéticos y Productividad (Fruticultura), Colegio de Postgraduados. Km 36.5 carretera México–Texcoco. Montecillo, Estado de México, México. CP. 56230.
 Autora para correspondencia:
Autora para correspondencia:
e–mail: larevalo@colpos.mx
* Recibido: Septiembre de 2005
Aceptado: Mayo de 2006
RESUMEN
En la presente investigación se reportan los resultados del empleo de soluciones pulso en la apertura de botones y pigmentación de pétalos de flores de lisianthus (Eustoma grandiflorum Raf.) cv. 'Echo Blue' cosechados en marzo del 2002 en Morelos, México, de donde fueron trasladados al Laboratorio de Fisiología Postcosecha, del Colegio de Postgraduados en Montecillo, México. Se determinaron las variables apertura y color de los botones florales, contenido de antocianinas, azúcares totales, azúcares reductores, peso seco y contenido de clorofila. Además se evaluó la vida de florero y cambios en peso fresco de los tallos florales. Los tratamientos evaluados fueron agua destilada, 8–HQC, 8–HQC + sacarosa, 8–HQC + sacarosa + AG3. El tratamiento con 8–HQC + sacarosa incrementó la apertura de los botones florales en 40%. También se incrementó la intensidad de color en pétalos, lo cual coincidió con el incremento en el contenido de antocianinas. En los tratamientos con sacarosa la vida de florero de los tallos florales aumentó en tres días. Se observó correlación positiva entre azúcares totales y peso seco (r= 0.7043), y entre azúcares totales y contenido de antocianinas (r= 0.7966) en los pétalos. El ácido giberélico de la solución pulso incrementó el contenido de clorofila en las hojas en 117.5%. Los tallos con mejor calidad fueron los del tratamiento que incluyó 8–HQC + sacarosa + AG3.
Palabras clave: Ácido giberélico, apertura floral, pigmentación de pétalos, sacarosa, 8–hidroxiquinoleína.
ABSTRACT
This research reports the effect of pulse solutions on bud opening and petal pigmentation in floral stems of lisianthus (Eustoma grandiflorum Raf.) cv. 'Echo Blue' harvested in March of 2002 in the state of Morelos, Mexico. Afterwards the stems were taken to the Laboratory of Postharvest Physiology in the Colegio de Postgraduados, Montecillo, Mexico to be evaluated. The measured characteristics were color and bud opening, anthocyanin concentration, total and reduced sugars content, dry weight and chlorophyll content. In addition, vase life and fresh weight of the floral stems were also evaluated. The applied treatments were distilled water, 8–HQC, 8–HQC + sucrose, 8–HQC + sucrose + GA3. The treatment that included 8–HQC + sucrose improved flower opening in 40%, as well as color intensity in petals, which coincided with an increase in anthocyanin content in the petals. Vase life of floral stems increased in three days with the treatments including sucrose. In the petals there was a positive correlation between total sugars and dry weight (r= 0.7043) and between total sugars and anthocyanin content (r= 0.7966). The GA3 in the pulse solution increased the chlorophyll content of the leaves in 117.5%. Floral stems of higher quality were those treated with 8–HQC + sucrose + GA3.
Key words: Flower opening petal, gibberellic acid, pigmentation, sucrose, 8–hidroxiquinoline.
INTRODUCCIÓN
La flor de E. grandiflorum tiene gran aceptación en el mercado internacional por su variedad de colores y número de botones florales, características que la hacen muy atractiva al consumidor. En México E. grandiflorum es una especie de reciente introducción cuya demanda en el mercado nacional va en aumento, por lo que se considera un cultivo con amplias perspectivas.
Sin embargo, la especie muestra fallas en la apertura de botones y baja pigmentación de pétalos que se han atribuido a la falta de asimilados después del corte, lo cual disminuye la calidad de las flores (Harbaught et al., 2000), por ello el acondicionamiento de postcosecha es de fundamental importancia. En general el acondicionamiento de otras flores de corte consiste en mantener los tallos en una solución pulso, por un período corto (Halevy y Mayak, 1981). Esta solución puede estar compuesta por un sustrato energético como sacarosa (Ketsa y Narkbua, 2001) y germicidas como 8–citrato de hidroxiquinoleína (8–HQC) (Sun et al., 2001), reguladores de crecimiento como ácido giberélico (AG3) (Celikel y van Doorn, 1995) u otras sustancias específicas para cada especie o cultivar.
Las soluciones pulso basadas en sacarosa promueven la apertura floral y mejoran el color de los pétalos en especies como Heuchera sanguinea (Han, 1998) y Lilium sp (Han, 2003). Se ha demostrado la efectividad del uso de 8–HQC en el control microbiano y en prolongar la vida de florero, como en Nerine bowdenii (Lukaszewska, 1997).
Las soluciones compuestas por sacarosa más 8–HQC tienen diversos efectos benéficos en flores de corte, por ejemplo, mejoran la apertura floral de Gladiolus grandiflora (Meir et al., 1995), elevan el contenido de antocianinas en Gerbera jamesonii (Amariuttei et al., 1995) e incrementan la ganancia de peso fresco en Rosa hybrida (Markhart y Harper, 1995). Otro caso es la aplicación de AG3 en solución lo cual incrementa el contenido de clorofila en hojas en Dracaena marginata (Wilson et al., 1995) y se han observado otros efectos positivos como cuando en presencia de sacarosa aumenta el grado de la apertura floral de Polianthus tuberosa (Wei–Ren et al., 2001) e incrementa el color como en Petunia hybrida (Moalem–Beno et al., 1997). Sin embargo, Goszczynska et al. (1990) mencionaron que la combinación de sacarosa y AG3 no siempre es efectiva, como lo muestran estudios realizados por Celikel y van Doorn (1995) en Iris x Hollandica 'Blue Magic', donde la solución pulso, con estos dos compuestos, no mejoró la calidad de las flores.
Con base en los antecedentes anteriores, el presente estudio se realizó con el objetivo de evaluar el efecto de la aplicación de soluciones pulso basadas en sacarosa, AG3 y 8–HQC solos o en combinación, en la calidad postcosecha de lisianthus cv. 'Echo blue'.
MATERIALES Y MÉTODOS
En marzo del 2002 se cosecharon tallos de lisianthus (Eustoma grandiflorum Raf.) cv. 'Echo Blue' con flores dobles (corolas con dos hileras de pétalos) y 60 cm de altura en un invernadero de la empresa DAYSA S. A. en Cuernavaca, Morelos. El corte se realizó 5 cm arriba del nivel del suelo con la flor principal abierta dejando un total de cinco botones por tallo (se eliminaron los botones jóvenes menores de 2 cm). Los tallos se colocaron en agua destilada para su traslado al laboratorio de Fisiología Postcosecha del Colegio de Postgraduados en Montecillo, México, donde se seleccionaron los libres de daños y defectos y se eliminaron los tres primeros pares de hojas de la base.
Los tallos florales se colocaron 24 h en soluciones pulso compuestas por sacarosa (100 g L–1), el germicida 8–citrato de hidroxiquinoleína (8–HQC) (Sigma®) (0.2 g L–1) y la hormona AG3 (BioGib®10% i.a.) a 0.1 g L–1. Los tratamientos fueron los siguientes: testigo (agua destilada); 8–HQC; 8–HQC + Sacarosa y 8–HQC + Sacarosa + AG3. Los tallos florales se colocaron posteriormente en floreros con agua destilada con una intensidad luminosa de 14 µmol m–2 s–1 con fotoperíodo de 12 h, temperatura de 19 ± 2 °C y 60% HR. Las muestras se tomaron al quinto día después del tratamiento y las variables apertura floral, peso fresco y vida de florero se evaluaron diariamente.
Para evaluar la apertura de los botones se estableció una escala en la que fueron identificadas cinco etapas (Cuadro 1).
La ganancia de peso fresco se evaluó pesando diariamente los tallos en una balanza electrónica, expresándose en porcentaje (peso fresco relativo). Para la evaluación de peso seco se pesó 1 g de pétalos y se secó en estufa a 60 °C por 72 h (peso constante), posteriormente se registró el peso en una balanza analítica.
El contenido de azúcares totales se evaluó mediante la técnica de la Antrona (Witham et al., 1971), en una muestra de 1 g de pétalo por repetición de cada estado de apertura por tratamiento. La muestra fue macerada, se le agregaron 80 mL de alcohol al 80% y fue llevada a ebullición durante 10 min; luego se puso en reposo en refrigeración por 10 días, posteriormente se filtró, se tomó 1 mL de la solución y se diluyó (1:16). Se tomó 1 mL de la dilución y se ajustó el volumen a 3 mL con agua destilada. Al mismo tiempo se preparó un blanco al que se le añadió 4 mL de agua destilada y 6 mL del reactivo de Antrona (4 g L–1), que se mantuvo en agitación dentro de un recipiente con agua fría. Después los tubos se llevaron a ebullición en baño María durante 3 min (CRAFT, Mod. B6–1300), enseguida se sumergieron bruscamente en agua fría. Posteriormente se tomaron lecturas de absorbancia en un espectrofotómetro a 600 nm (Spectronic 20, Bausch & Lomb).
El contenido de azúcares reductores se evaluó mediante la técnica Nelson (1944) y Somogyi (1952). Se tomó 1 mL del extracto de la solución madre utilizada para azúcares totales y se diluyó (1:10), de la dilución se tomó 1 mL y se le agregó 1 mL de reactivo C de Nelson. Se agitaron los tubos (Vortex, Scientific Industries) y se llevaron a ebullición en baño María durante 30 min (Water bath, Precision Scientific). Los tubos se enfriaron bruscamente con agua fría. Se adicionó 1 mL de Arsenomolibdato de Amonio y se agitó vigorosamente (Vortex, Scientific Industries); se aforó con agua destilada a 10 mL, se agitó nuevamente y se tomó la lectura a 540 nm (Spectronic 20, Bausch & Lomb).
Para la evaluación del color de pétalos se estableció una escala visual que identifica seis grados de coloración basada en el grado de pigmentación. El valor de 1 fue para tonalidades blancas o crema y 6 para color púrpura. Los valores se expresaron como promedio de color.
El contenido de antocianinas se determinó de acuerdo con la metodología propuesta por Jiang et al. (2001), para lo cual se tomaron 0.5 g de pétalo fresco que se colocaron en frascos con 5 mL de metanol acidificado (85:15, HCl 1.5 N), los cuales se maceraron y se centrifugaron a 360xg durante 10 min. Se tomaron lecturas en un espectrofotómetro a 535 nm, en condiciones de oscuridad y los valores se expresaron como absorbancia (D.O.) por 0.5 g de pétalo.
Para el contenido de clorofila se tomó una muestra de las hojas cercanas al ápice, al terminar la vida de florero, y se siguió el procedimiento de la AOAC (1980). Los valores se expresaron como mg 100 g–1 de peso fresco.
La vida de florero se definió cuando 50% del follaje, a partir de la base del tallo, perdió turgencia y se expresó en días. La vida de florero de los tallos se inició después del tratamiento de pulso.
En el experimento se utilizó un diseño completamente al azar con ocho repeticiones por tratamiento. Cada unidad experimental constó de un tallo floral. Para el análisis estadístico de los resultados se utilizó la prueba de Tukey (p<0.05).
RESULTADOS Y DISCUSIÓN
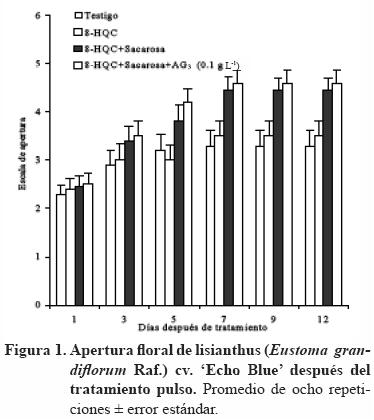
En la Figura 1 se muestra que al quinto día después de tratamiento (DDT) se observó la mayor apertura de las flores con diferencias significativas entre tratamientos (p<0.05). En los tratamientos con sacarosa la apertura floral fue mayor en 40%, en relación con el tratamiento testigo.
Después del corte de las flores se inicia un período de estrés, por lo que en ese momento es importante el suplemento de soluciones que contribuyen al aumento del peso fresco, y como consecuencia, mayor vida de florero. Como se observa en la Figura 2, los tratamientos con sacarosa influyeron de manera positiva (p<0.05) en el incremento de peso fresco (10%) a los 4 DDT.
Los tallos tratados con agua destilada y 8–HQC mostraron una ganancia de peso de 4%; sin embargo, después del sexto día el peso fresco disminuyó drásticamente y en el octavo se presentaron las señales de marchitamiento. No se observó diferencia significativa entre el tratamiento con 8–HQC+Sac y el de 8–HQC+ Sac+ AG3, lo que sugiere que la adición de AG3 no contribuyó a la respuesta positiva observada en el último tratamiento.
Diversos autores han reportado los beneficios de la sacarosa en el peso fresco en rosas cv. 'Madelon' y 'Sonia' (Kuiper et al., 1995; Ichimura et al., 1998). Así mismo, Sultan y Farooq (1999) mencionaron que el peso fresco de flores de Narcissus tazzeta cv. 'Kashimir' tratadas con sacarosa y AG3, solos o en combinación, incrementaron el peso fresco (32%) respecto a las flores no tratadas, sin diferencias significativas entre estos dos compuestos.
En cuanto al peso seco se observó mayor acumulación (p<0.05) en los tratamientos con sacarosa respecto al testigo. En la EA 1 el incremento fue de 22%; en la EA 2, de 7.3 a 28.5%; en la EA 4, del 2 al 8%; mientras que para la EA 5 la acumulación de peso seco fue 25.7% mayor, coincidiendo con la mayor acumulación de azúcares, lo que contribuyó a prolongar la vida de florero de estos tratamientos (Cuadro 2).
El contenido de azúcares totales fue diferente (p<0.05) donde los tratamientos que incluyeron sacarosa con y sin AG3acumularon entre 14 y 19% en la EA 1, entre 15 y 19% en la EA 2, de 14 a 19% en la EA 3, entre 8 y 13% en la EA 4 y de 10.5 al 22% para la EA 5. Se infiere que el AG3 no influyó en el contenido de azúcares (Cuadro 3).
Con respecto a la concentración de azúcares reductores en los botones de las diferentes EA, los tratamientos con sacarosa presentaron una concentración entre 38 y 85% superior al testigo (Cuadro 4). Así mismo, se presentaron diferencias significativas en el tratamiento con AG3 (0.1 g L–1) con un incremento del 16% en las EA 4, del 18% en la EA 5 con respecto al tratamiento 8–HQC y 8–HQC + Sacarosa.
La apertura y crecimiento del botón floral son procesos irreversibles que involucran la expansión de las células y el incremento en peso fresco y seco y requieren de un alto consumo de energía dependiente principalmente del abastecimiento de carbohidratos. En esta investigación se encontró correlación significativa (r= 0.7043) entre el contenido de azúcares totales y el peso seco. Durante las EA 2 y 3 se observó la mayor acumulación de azúcares totales, coincidiendo con la etapa de mayores cambios en el proceso de crecimiento del botón floral. Así mismo, desde la EA 1 hasta la EA 5, el peso seco se incrementó de manera paulatina desde 7.7 – 9.7% hasta 10.5 – 13.4%, respectivamente. Sytsema–Kalkman et al. (1995) reportaron que el contenido de azúcares totales en los botones más maduros de fressia cv. 'Polaris' fue 250% mayor respecto a los botones menos desarrollados, respuesta similar a la obtenida en el contenido de materia seca. Así mismo, en pétalos de Alstroemeria pelegrina cv. 'Jaqueline', R. hybrida cv. 'Sonia' y N. tazzeta cv. 'Kashimir' se reportaron incrementos significativos en el contenido de azúcares totales por el empleo de soluciones pulso basadas en sacarosa (Collier, 1997; Sultan y Farooq, 1999). Diversos autores reportan que la aplicación conjunta de sacarosa y AG3 incrementan el contenido de azúcares totales en los pétalos. Por ejemplo, Sultan y Farooq (1999) reportaron un aumento de 190% en pétalos de flores de N. tazzeta; Lukaszewska (1995) reportó en tulipán cv. 'Apeldoorn', que la aplicación de AG3 estimuló la absorción de sacarosa en solución, mostrando un incremento de 72% en azúcares totales en el pétalo respecto del testigo. Estos resultados coinciden con los registrados en la presente investigación.
De acuerdo con la escala de color establecida, los cambios más evidentes en el color de las flores se presentaron entre las EA 4 y 5 en todos los tratamientos (Cuadro 5), a excepción del tratamiento con 8–HQC + Sacarosa, en donde el cambio más importante ocurrió entre las EA 2 y 3.
El cambio en la escala de color de las flores coincidió con los resultados en la acumulación de antocianinas (Figura 3).
La acumulación de antocianinas se observó, principalmente entre las EA 1 a 2 y de la 4 a la 5 para todos los tratamientos. El incremento en la D.O. fue mayor en los tratamientos que incluyeron sacarosa, con y sin AG3. Así los valores fueron superiores en 73% para la EA 2, 64% para la EA 3, 89% para la EA 4 y 135% para la EA 5 con respecto al testigo. Estos valores se consideraron tomando como referencia de 100% al valor del tratamiento 1 en todas las etapas de apertura. La presencia de AG3 no indujo un incremento significativo en el contenido de antocianinas; la sola presencia de 8–HQC tampoco favoreció esta variable. Por lo tanto, el mayor efecto en la acumulación de antocianinas se obtuvo con sacarosa. Las flores de E. grandiflorum cv. 'Asuka no Asa' y 'Asuka no Kurenai' tratadas con solución de sacarosa mostraron un incremento significativo en el contenido de antocianinas (15–30%, respectivamente), y del 60% en flores de Lilium sp cv. 'Stargazer' (Jamal–Uddin et al., 2001; Han, 2003).
Se observó correlación positiva (r= 0.7966) entre el contenido de azúcares totales y el de antocianinas; además, en el cultivar estudiado el desarrollo de la pigmentación de los pétalos inició en la EA 2. Este resultado coincide con lo reportado por Davies et al. (1993) quienes indicaron que pétalos rosa y púrpura de flores de E. grandiflorum permanecieron sin pigmentación (D.O.=0.0) hasta que el botón alcanzó la etapa de desarrollo cuatro, que fue la inmediata a que las flores estuvieran próximas a expandirse completamente. El botón en la etapa de desarrollo cuatro coincide con la apertura floral dos del presente estudio. Por otra parte, Oren–Shamir et al. (1999) señalaron que las diferencias en la pigmentación de los pétalos de E. grandiflorum dependen principalmente de si las flores proceden de líneas de pigmentación temprana o de pigmentación tardía; estos autores también reportaron que para las líneas tempranas púrpura y rosa, la acumulación de antocianinas se inicia en la etapa tres, mientras que en variedades tardías, hasta la etapa cinco o el final del desarrollo del botón floral. Los resultados en esta investigación coinciden con la caracterización de variedades de pigmentación temprana.
En diversos estudios se ha reportado que la adición de AG3 a soluciones postcosecha mejora la apariencia del follaje al incrementar contenido de clorofila, como sucede en hojas de D. marginata (Wilson et al., 1995), Zantedeschia aethiopica (Skutnik et al., 2001), o retrasa la aparición de hojas cloróticas, como en Sandersonia aurantiaca cv. 'Golden Lights' (Eason et al., 2001) y en Lilium sp (Ranwala y Miller, 1998). En esta investigación el contenido de clorofila inicial en las hojas de E. grandiflorum fue de 62.8 mg 100 g–1 de peso fresco. Al momento del muestreo el contenido de clorofila del tratamiento con sacarosa se incrementó en 5.4% (66.2 mg 100 g–1) respecto al valor inicial; mientras que en el tratamiento con sacarosa más AG3 se registró un valor de106.6% superior al inicial (129.75 mg 100 g–1). En el caso de las hojas de los tratamientos testigo y 8–HQC, el contenido de clorofila disminuyó 7% (58.4 mg 100 g–1) con respecto al muestreo inicial.
En los tratamientos con sacarosa con y sin AG3, la vida de florero de los tallos de E. grandiflorum fue mayor en tres días con diferencias significativas en relación con el testigo. No se encontraron diferencias que pudieran atribuirse a la adición de AG3. Para prolongar la vida de florero se ha destacado la importancia de aplicar sacarosa que es la principal forma de carbono fotosintéticamente asimilado que se transporta a través de la planta, cuyo suministro, en los tallos florales, se interrumpe al ser cortados (Lalonde et al., 1999).
CONCLUSIONES
En E. grandiflorum cv. 'Echo Blue', la adición de la sacarosa en solución (100 g L–1) en combinación con el germinicida 8–HQC favoreció el incremento en el contenido de azúcares y peso seco de los pétalos, mejorando con ello el desarrollo del botón y la apertura floral. Además, aumentó la vida de florero y peso fresco de los tallos (mejor turgencia de pétalos y hojas) y, al incrementar el contenido de antocianinas, mejoró también el color de los pétalos. Por otro lado, no obstante que el uso de AG3 (0.1 g L–1) en combinación con sacarosa no mejoró la apertura floral ni el color de los pétalos, sí incrementó el contenido de clorofila de las hojas.
LITERATURA CITADA
Amariuttei, A.; Constanta, A. and Burzo, I. 1995. Physiological and biochemical changes of cut gerbera inflorescences during vase life. Acta Hort. (Holanda) 405:372–380. [ Links ]
Association of Official Analytical Chemists (AOAC). 1980. Official Methods of Analysis 13th ed. Washington, D.C. p. 62–63. [ Links ]
Celikel, F. G. and van Doorn, W. G. 1995. Effects of water stress and gibberellin on flower opening in Iris x hollandica. Acta Hort. (Holanda). 405:246–252. [ Links ]
Collier, D. E. 1997. Changes in respiration, protein and carbohydrates of tulip petals and alstroemeria petals during development. J. Plant Physiol. 150:446–451. [ Links ]
Davies, K. M.; Bradley, J. M.; Schwinn, K. E.; Markham, K. R. and Podivinsky, E. 1993. Flavonoid biosynthesis in flower petals of five lines of lisianthus (Eustoma grandiflorum Grise.). Plant Sci. 95:67–77. [ Links ]
Eason, J. R.; Morgan, E. R.; Mullan, A. C. and Burge, G. K. 2001. Postharvest characteristics of santonia 'Golden Lights' a new hybrid cut flower from Sandersonia aurantiaca X Littonia modesta. Postharvest Biol. Technol. (Holanda) 22:93–97. [ Links ]
Goszczynska, D. M.; Zieslin N, and Halevy, A. H. 1990. Improvement of postharvest keeping quality of 'Mercedes' roses by gibberellin. Plant Growth Reg. 9:293–303. [ Links ]
Halevy, A. H. and Mayak, S. 1981. Senescense and postharvest physiology of cut flowers. Hort. Rev. 3:59–143. [ Links ]
Han, S. S. 1998. Postharvest handling of cut Heuchera sanguinea Engelm. Flowers: effects of sucrose and silver thiosulfate. HortScience 33:731–733. [ Links ]
Han, S. S. 2003. Role of sugar in the vase solution on postharvest flower and leaf quality of oriental lily 'Stargazer'. HortScience 38:412–416. [ Links ]
Harbaugh, B. K.; Bell, M. L. and Liang, R. 2000. Evaluation of forty–seven cultivars of lisianthus as cut flowers. HortTech. 10:812–815. [ Links ]
Ichimura, K. 1998. Improvement of postharvest life in several cut flowers by the addition of sucrose. Japan Agric. Res. Q. 32:275–280. [ Links ]
Jamal–Uddin, A. F. M.; Hashimoto, F.; Kaketani M.; Shimizu, K. and Sakata, Y. 2001. Analysis of light and sucrose potencies on petal coloration and pigmentation of lisianthus cultivars (in vitro). Scientia Hort. (Holanda) 89:73–82. [ Links ]
Jiang, Y.; Joyce, D. C. and Terry, L. A. 2001.1–Methylcyclopropene treatment affects strawberry fruit decay. Postharvest Biol. Technol. (Holanda) 23:227–232. [ Links ]
Ketsa, S. and Narkbua, N. 2001. Effect of amino oxyacetic acid and sucrose on vase life of cut roses. Acta Hort. (Holanda) 543:227–234. [ Links ]
Kuiper, D.; Ribot, S.; Van Reenen, H. S. and Marissen, N. 1995. The effect of sucrose on the flower bud opening of 'Madelon' cut roses. Scientia Hort. (Holanda) 60:325–336. [ Links ]
Lalonde, S.; Bules, E.; Hellmann, H.; Baker, L.; Patrick, J. W. and Frammer, W. B. 1999. The dual function of sugars carriers: Transpor and sugar sensing. Plant Cell. 11:707–726. [ Links ]
Lukaszewska, A. J. 1995. Distribution of sugars in tulip flower parts as affected by ethrel and GA3 in the holding solution. Acta Hort. (Holanda) 405:351–353. [ Links ]
Lukaszewska, A. J. 1997. Improving keeping qualities of Nerine cut flowers with preservatives. Acta Hort. (Holanda) 430:439–445. [ Links ]
Markhart, A. H. and Harper, M. S. 1995. Deleterious effects of sucrose in preservative solutions on leaves of cut roses. HortScience 30:1429–1432. [ Links ]
Meir, S.; Philosoph–Hadas, S.; Michaeli, R. and Davidson, H. 1995. Improvement of the keeping quality of mini–gladiolus spikes during prolonged storage by sucrose pulsing and modified atmosphere packaging. Acta Hort. (Holanda) 405:335–342. [ Links ]
Moalem–Beno, D.; Tamari, G.; Leitner–Dagan, Y.; Borochov, A. and Weiss, D. 1997. Sugar–dependent gibberellin–induced chalcone synthase gene expression in petunia corollas. Plant Physiol. 113:419–424. [ Links ]
Nelson, N. 1944. A photometric adaptation of the Somogyi method for the determination of glucose. J. Biol. Chem. 153:380–395. [ Links ]
Oren–Shamir, M.; Shaked–Sachray, L.; Nissim–Levi, A. and Ecker, R. 1999. Anthocyanin pigmentation of lisianthus flower petals. Plant Sci. 140:99–106. [ Links ]
Ranwala, A. P. and Miller, W. B. 1998. Gibberellin 4+7, benzyladenine, and supplemental light improve postharvest leaf and flower quality of cold–stored 'Stargazer' hybrid lilies. J. Amer. Soc. Hort. Sci. 123:563–568. [ Links ]
Somogyi, M. 1952. Notes and sugar determination. J. Biol. Chem. 195:19–23. [ Links ]
Sultan, S. M. and Farooq, S. 1999. Effect of sucrose and GA3 on the senescense of cut flowers of Narcissus tazetta 'Kashmir Local'. Adv. Hortic. Sci. (Italia) 13:105–107. [ Links ]
Sun, J.; Jameson, P. E. and Clemens, J. 2001. Water relations and stamen abscission in cut flowers of selected myrtaceae. Acta Hort. (Holanda) 543:185–189. [ Links ]
Skutnik, E.; Lukaszewska, A.; Serek, M. and Rabiza, M. 2001. Effect of growth regulators on postharvest characteristics of Zantedeschia aethiopica. Postharvest Biol. Technol. (Holanda) 21:241–246. [ Links ]
Sytsema–Kalkman, E. Ch.; Brijn–Jansen, L. L. and Marissen, N. 1995. Carbohydrate status of cut freesia flowers. Acta Hort. (Holanda) 405:89–96. [ Links ]
Wei–Ren, S.; Kuang–Liang, H.; Ping–Shu, C. and Wen–Shaw, C. 2001. Improvement of postharvest vase life and flower bud opening in Polianthus tuberosa using gibberellic acid and sucrose. Aust. J. Exp. Agric. 41:1227–1230. [ Links ]
Wilson W., R. S.; Sivakumar, D. and Abeyesekere, M. 1995. Postharvest treatments and refrigerated storage studies on Dracaena marginata. Acta Hort. (Holanda) 405:415–421. [ Links ]
Witham, F. H.; Blaydes, D. F. and Devlin, R. M. 1971. Experiments in plant physiology. Van Nostrand Reinhold. New York, USA. 245 p. [ Links ]














