Introducción
En 1929, Hans Berger describe por primera vez la presencia de ondas cerebrales tras instalar electrodos sobre el cuero cabelludo de seres humanos1. Posteriormente, en 1937, Gibbs publica los cambios que se producen en el electroencefalograma (EEG) tras la administración de determinados fármacos2, con esto se le dio utilidad a la electroencefalografía para brindar la importancia debida a la profundidad anestésica. Con el desarrollo tecnológico, en la década de los 90, comienzan a aparecer monitores de profundidad anestésica (MPA). Estos monitores abrieron una ventana al cerebro, lo que supuso un importante avance en la monitorización frente al uso de los signos clínicos. Con ellos se puede visualizar de forma directa el EEG correspondiente a la región frontal, pero además procesan el EEG del paciente mediante un algoritmo matemático que en muchos casos es cerrado, para obtener un índice de profundidad anestésica (IPA) que evalúa el estado de consciencia. Cuando su valor es bajo indican mayor profundidad anestésica, mientras que si es alto indican superficialización, con escalas que oscilan entre cero y 100. En función del monitor utilizado, se recomienda mantener unos valores determinados3.
Dada la simplificación que suponía utilizar el IPA, pronto se extendió su uso; sin embargo, guiar la profundidad anestésica basándose en el valor numérico que muestra el índice, no está exento de importantes limitaciones, entre las que destacamos:
El uso de un índice no excluye la aparición de un despertar intraoperatorio4,5.
Es sensible a interferencias eléctricas y a la actividad electromiográfica6.
Son poco fiables en determinados grupos poblacionales, como en los pacientes pediátricos7,8, ancianos9,10 o pacientes con trastornos neurológicos6,11.
Son menos fiables con determinados fármacos como la ketamina12,13 o el óxido nitroso14-16.
Es importante tener en consideración que parte de estas limitaciones se deben a que el valor del IPA no tiene en cuenta la edad del paciente, sus comorbilidades asociadas, ni que cada fármaco anestésico actúa en diferentes dianas moleculares. Si en la valoración de la profundidad anestésica, además del índice, se añade el análisis visual del EEG y de la matriz de densidad espectral (MDE) que nos muestran los MPA, dispondremos de más información en tiempo real para adecuar la profundidad anestésica, lo que hace más fiable su uso frente a un índice procesado. Para su valoración es fundamental conocer previamente una serie de conceptos básicos.
Conceptos básicos
En 1994 apareció el primer MPA para guiar el nivel de consciencia durante la anestesia general (AG), fue aprobado por la FDA (Food and Drug Administration) en 19963. Estos monitores registran de forma continua la actividad cerebral mediante la colocación de sensores en la región anterior del cráneo. Estos pueden ser de uno, dos o cuatro canales y permiten el registro del EEG fundamentalmente en la región frontal. Esta actividad eléctrica deriva de las neuronas piramidales de las capas III y V de la corteza cerebral, y es secundaria a los potenciales postsinápticos que preceden al potencial de acción que se inicia por la liberación presináptica de neurotransmisores excitatorios (glutamato o acetilcolina) o inhibitorios (GABA o glicina). La capa V se caracteriza por neuronas piramidales grandes cuyos axones se dirigen hacia estructuras subcorticales, lo cual explica la interconexión que hay entre el córtex y estructuras como el tálamo, hipotálamo o el tronco de encéfalo17.
Una vez registrado el EEG, el monitor permite analizar la amplitud y la frecuencia. La amplitud es el tamaño de la onda y su unidad de medida es el microvoltio (μV). Para que la amplitud de la señal recibida sea la correcta, es fundamental la impedancia, que debe estar entre 300-5000 ohmios y es la resistencia que presenta al paso de la corriente. La frecuencia es el número de ciclos por segundo y su unidad de medida son los hercios (Hz). De tal manera que 5 Hz corresponde a cinco ciclos por segundo18.
El EEG está compuesto por oscilaciones u ondas con una variedad de frecuencias. Los MPA registran las frecuencias, habitualmente por debajo de los 30 Hz para disminuir posibles interferencias; sin embargo, en el adulto sano las frecuencias varían de 0.1 a 500 Hz y se agrupan definiendo bandas de frecuencias, entre las que destacamos (Figura 1):
Para la toma de decisiones es fundamental la interpretación correcta del EEG que muestra los MPA. La frecuencia y la amplitud pueden ser de ayuda para su valoración; no obstante, durante la AG la excepción es observar una sola frecuencia dominante, lo habitual es encontrar ondas de varias frecuencias y voltajes que incluso se superponen, lo cual dificulta su lectura. Con experiencia es posible identificar las diferentes ondas en el EEG; pero disponemos de otro parámetro basado en el análisis espectral que es la MDE, la cual facilita su visualización19,20 (Figura 2).
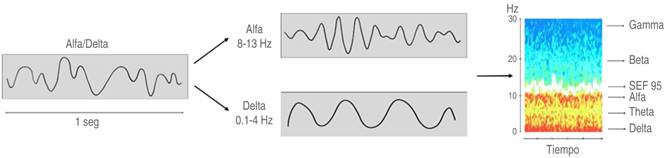
Figura 2: Imagen de superposición de ritmos alfa/delta, con su correspondiente matriz de densidad espectral que facilita su identificación.
La MDE es un gráfico a color que consiste en la descomposición de un segmento del EEG en su contenido de potencia por frecuencia, calculado por la transformada de Fourier. Así se puede observar qué banda de frecuencia hay y con qué intensidad se presenta, en un momento determinado. La potencia se expresa en decibelios y se basa en una escala de colores que varía de azul a rojo, en función de si presenta menor o mayor actividad la banda correspondiente. Los equipos realizan la representación aproximadamente cada 1,2 segundos, lo que posibilita ver retroactivamente los cambios ocurridos en la actividad cerebral del paciente21 (Figura 3).

Figura 3: Esquema simplificado de formación de la matriz de densidad espectral descrita en pasos. En el 1 se visualiza una tira de electroencefalograma de 1 segundo en la que predomina la actividad alfa y delta; esta onda se descompone en el paso 2 en su frecuencia (eje horizontal) por potencia (eje vertical). En el 3 observamos cómo la potencia se representa además con una escala de colores, donde la actividad alfa y delta presenta mayor intensidad. El 4 representa cómo todo lo descrito anteriormente se repite sucesivamente en el tiempo, aproximadamente cada 1,2 segundos, para después en el 5 ver cómo será mostrado en la pantalla de los monitores de profundidad anestésica.
En consecuencia, con la MDE es posible analizar el estado de profundidad anestésica de forma sencilla. Además, permite ver la evolución de los diferentes estados neurológicos del paciente y resulta especialmente útil para detectar determinadas situaciones clínicas (convulsiones, asimetrías, patrón brote-supresión, muerte cerebral, etcétera) cuya identificación precoz puede ser vital para el paciente.
Los MPA también aportan información mediante otras variables, como: la frecuencia mediana (median frequency), la frecuencia de límite espectral (SEF, Spectral Edge Frequency) y la tasa de supresión (TS). La frecuencia mediana es la frecuencia que divide la potencia en el espectro a la mitad. El SEF informa de la frecuencia por debajo de la cual se encuentra 95% de la potencia espectral, por ejemplo, un SEF de 12 quiere decir que 95% de la actividad se encuentra por debajo de los 12 Hz, es decir, en rango delta, theta y alfa; su utilidad clínica radica en que observa si la potencia espectral se está desplazando a frecuencias altas o bajas, al ser indicativas de estados superficiales o profundos.
La TS permite cuantificar el patrón brote-supresión, al reflejar el porcentaje de tiempo en el que las ondas del EEG no alcanzaron los 5 μV durante los últimos 60 segundos22,23. El patrón brote-supresión es un estado de inactivación cerebral profunda con mal pronóstico asociado. Se trata de brotes de actividad aguda de alto voltaje, intercalados con períodos de supresión de la actividad eléctrica23; se puede observar en cualquier fase de la anestesia y es secundario a la sobredosificación anestésica, la hipotermia o a patologías que conlleven isquemia cerebral. Su detección es fundamental, pues su aparición se relaciona con la disfunción cognitiva y el delirio postoperatorio24. Aunque menos frecuente en la práctica clínica, también es posible su cuantificación mediante un algoritmo que representa la probabilidad de estar en un estado de supresión (BSP, burst suppression probability)25.
¿Qué observamos durante los diferentes períodos anestésicos?
El estado anestésico de un paciente no es un estado de on/off, sino que es gradual26. Habitualmente se dividen los períodos anestésicos en tres fases: inducción, mantenimiento y educción. El análisis visual del EEG y de la MDE en el paciente despierto refleja actividad de alta frecuencia y baja amplitud. Durante la inducción, con la administración gradual de fármacos con acción GABAérgica, inicialmente aparece un incremento en la actividad de alta frecuencia (activación beta paradójica) para posteriormente aumentar la actividad de baja frecuencia y alta amplitud con el incremento de las oscilaciones en el rango delta, theta y alfa. Si se administra más dosis del agente hipnótico se observará el patrón brote-supresión e incluso un trazado isoeléctrico19,27.
Durante la fase de mantenimiento de la AG se observan oscilaciones alfa/delta a nivel frontal28, aunque dependerá de factores como el fármaco empleado, dosis, edad o comorbilidades asociadas. Cuando aparecen oscilaciones beta acompañadas de actividad delta, generalmente indican un estado de hipnosis superficial. La actividad theta aparece más frecuentemente entre las bandas de frecuencia alfa y delta en el mantenimiento con halogenados29.
En la educción ocurre todo lo contrario, desaparecen las oscilaciones alfa a nivel frontal, además gradualmente aparece actividad de alta frecuencia y baja amplitud. Esta transición configura una imagen en la MDE conocida como «abertura de cremallera» (Zipper Opening)20. En esta fase, en función del patrón de MDE observado, es posible predecir el riesgo de delirio postoperatorio30.
A la hora de interpretar el EEG y la MDE que nos aportan los MPA, es fundamental tener en cuenta una serie de factores que influyen, como son:
1. Edad: debido a los cambios anatómicos y fisiológicos asociados a la edad, es importante conocer que con edades avanzadas disminuye la potencia de todas las frecuencias (sobre todo las oscilaciones alfa) y se presenta con mayor frecuencia un patrón brote-supresión31. En los niños, durante la AG con sevoflurano se observa actividad de baja frecuencia con oscilaciones delta; sin embargo, la actividad alfa y theta a nivel frontal comienzan a aparecer a partir de los cuatro meses32.
2. Comorbilidades: las patologías vinculadas directa o indirectamente con el sistema nervioso central pueden alterar el patrón electroencefalográfico observado. Por lo tanto, es fundamental conocer todos los antecedentes del paciente, por ejemplo, podemos ver desde ritmos de baja frecuencia como puede ser en pacientes con demencia, isquemias cerebrales o ictus, hasta pacientes con predominio en la actividad de alta frecuencia con patrones específicos, como en el caso de las convulsiones6,11,33.
3. Estímulo nociceptivo: el estímulo doloroso también se puede observar en la actividad electroencefalográfica, básicamente se puede poner de manifiesto de tres formas: 1) mediante el aumento de la actividad beta, que aparece en anestesias superficiales en ausencia o con dosis insuficiente de opioides, secundario a un aumento de la actividad cortical; 2) por la disminución del componente alfa debido al retorno de la comunicación talamocortical; 3) mediante el aumento de la actividad delta por mecanismos poco estudiados en los que parece influir la formación reticular del mesencéfalo34.
4. Fármacos hipnóticos: cada uno de los agentes hipnóticos empleados presenta su mecanismo de acción y diana correspondiente. Todo ello se traduce en distintos patrones de actividad encefálica en función del agente empleado, que pueden observarse con facilidad en el EEG o en su espectrograma21 (Figura 4).
Fármacos anestésicos y sus patrones electroencefalográficos
Propofol
El propofol actúa en los receptores GABAA repartidos por el encéfalo y la médula espinal, para potenciar la inhibición de los circuitos nerviosos35. Los patrones electroencefalográficos observados durante la inducción con propofol son dosis dependientes, que pasan de un patrón de paciente despierto con actividad de alta frecuencia y baja amplitud a un patrón con predominio de oscilaciones alfa/delta29. Normalmente la actividad alfa se detecta en las personas despiertas con los ojos cerrados en la región occipital. Durante la pérdida de la consciencia, mediante fármacos con acción GABAérgica, desaparecen las oscilaciones alfa a nivel occipital y aparecen en la región frontal36; fenómeno conocido como anteriorización37, que se produce por mecanismos de bucle en los circuitos talamocorticales38. Durante el retorno a la consciencia, las oscilaciones alfa se disipan de la región anterior y vuelve a aparecer la actividad de alta frecuencia y baja amplitud30.
En la AG balanceada es frecuente la coadministración de fármacos para conseguir un estado óptimo de hipnosis-analgesia. Con el propofol es frecuente el uso de opioides como el remifentanilo. Este fármaco produce efectos en el EEG, secundario a su actividad agonista sobre los receptores μ. Se caracteriza por una disminución en la actividad beta durante anestesias superficiales, o bien por un incremento de las oscilaciones alfa con disminución de la actividad delta durante anestesias profundas39.
En la práctica clínica diaria se ha utilizado el patrón alfa/delta como marcador del estado hipnótico adecuado; aunque, no está exento de controversias, pues se han descrito episodios de consciencia a pesar de su presencia40.
Purdon y colaboradores28, describieron dos patrones relacionados con estados de inconsciencia; a través del acoplamiento fase-amplitud se puede estudiar la interacción que hay entre diferentes bandas de frecuencias; así que lo realizaron entre las oscilaciones de baja frecuencia (0.1-1 Hz) y las alfa. Esto les permitió detectar dos patrones que denominaron trough-max y peak-max. El patrón trough-max se relaciona con la transición entre la pérdida y recuperación de la consciencia, además se caracteriza por presentar amplitud máxima de las oscilaciones alfa en el valle de las oscilaciones de baja frecuencia. El patrón peak-max es indicativo de estado profundo de inconsciencia41 y se observa como la amplitud máxima de las oscilaciones alfa en el pico de las oscilaciones de baja frecuencia. Con los MPA actuales no es posible detectar ambos patrones en el espectrograma pues no contiene información de fase; sin embargo, es posible visualizarlo en el EEG al observar si las oscilaciones alfa presentan mayor tamaño en el pico (peak-max) o en el valle (trough-max) de las lentas.
Halogenados y óxido nitroso
Los halogenados producen sus efectos a través de la unión a varios receptores en el encéfalo y la médula espinal. Los más importantes son: la unión a receptores GABAA con el aumento de la inhibición GABAérgica, así como el bloqueo de la liberación de glutamato mediante la unión a receptores NMDA (N-methyl-D-aspartate)42. En concentraciones por debajo de la concentración alveolar mínima (CAM), los halogenados muestran predominio de oscilaciones alfa/delta en el EEG, lo cual es similar al propofol, pero cuando se incrementa a una concentración igual o superior a la CAM, entre las bandas de frecuencia delta y alfa, aparece un incremento de las oscilaciones theta. Esta relación entre la CAM y la actividad theta es útil clínicamente, ya que indica un estado profundo de inconsciencia29.
En el caso del óxido nitroso, utilizado en la práctica clínica como segundo gas, se observa cómo aparece un aumento de la actividad lenta delta cuando se usa junto a otro agente inhalatorio; en cambio, cuando el halogenado se elimina aparece el patrón EEG característico del óxido nitroso, en el que se observa un predominio de las oscilaciones gamma/beta15,16.
Ketamina
La ketamina es un fármaco anestésico con propiedades analgésicas, que actúa como agonista no competitivo de los receptores NMDA en las neuronas glutamatérgicas excitadoras del cerebro y la médula espinal42. Las dosis bajas de ketamina se asocian con un patrón electroencefalográfico característico, así como incremento de las oscilaciones gamma/beta (entre los 25 y 32 Hz). Este aumento de la actividad del EEG ayuda a explicar la razón por la que los IPA alcanzan a menudo valores altos en pacientes bajo AG12,13. Mientras que las dosis más elevadas de ketamina se caracterizan por un incremento en la actividad de baja frecuencia43.
Debido a las propiedades analgésicas que presenta, es frecuente su uso de forma concomitante con fármacos de acción GABAérgica, como el propofol o el sevoflurano. Para guiar su administración es fundamental el análisis visual del EEG y MDE, donde se observa descenso de las oscilaciones delta/alfa o delta/theta/alfa con incremento de la actividad beta44.
Dexmedetomidina
La dexmedetomidina actúa a través de la unión a los receptores alfa-2-adrenérgicos presinápticos, en neuronas que se proyectan desde el locus cerúleo. Dicha unión disminuye la liberación de noradrenalina por esas neuronas. La pérdida de la inhibición por la noradrenalina en el área preóptica del hipotálamo, activa los influjos inhibidores de la mayor parte de los principales centros de vigilia en el mesencéfalo, protuberancia, prosencéfalo basal e hipotálamo45. Mayormente se usa en infusión para sedaciones en las que los pacientes responden a la estimulación auditiva o táctil con escasa depresión respiratoria.
El patrón de EEG característico muestra una combinación de actividad lenta delta con husos de sueño (spindles), que son oscilaciones entre 9 y 15 Hz, que se producen en ráfagas de uno a dos segundos de duración y se generan por mecanismos talamocorticales. Aunque se producen aproximadamente en el mismo rango que las oscilaciones alfa, son de menor potencia y duración.
Una mayor dosis de dexmedetomidina trae consigo la desaparición de los husos de sueño y el incremento de las oscilaciones delta46. Cuando se administra junto con el propofol modifica la actividad alfa/delta de éste, al aumentar la profundidad de la anestesia. Además, se caracteriza por el incremento en las oscilaciones de baja frecuencia y la disminución de la actividad alfa47 (Figura 5).
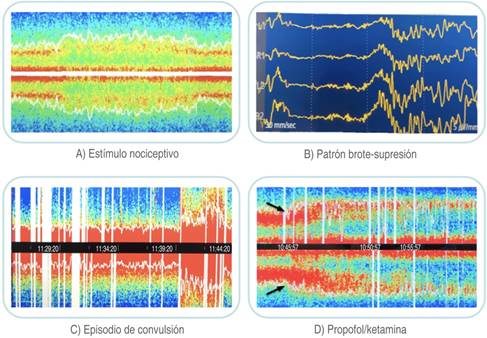
Figura 5: Ejemplos de electroencefalograma y matriz de densidad espectral. A) Se observa cómo desaparece la actividad alfa y el Spectral Edge Frequency comienza a aumentar, lo que sugiere un estímulo doloroso. En este caso secundario al inicio de la cirugía laparoscópica. Tras aumentar la dosis de remifentanilo, vuelve a aparecer actividad alfa y el Spectral Edge Frequency se sitúa en torno a 12 Hz. B) Se visualizan episodio de patrón brote supresión en paciente de 80 años intervenido urgentemente por una perforación gástrica. C) La matriz de densidad espectral muestra un aumento de la actividad de predominio, tanto en un rango de alta como de baja frecuencia. El episodio ocurre durante la resección de una lesión que ocupaba espacio a nivel parietal con monitorización neurofisiológica, además dicha imagen coincidió en el electroencefalograma con un episodio convulsivo que cedió tras medicación. Las barras de color blanco se corresponden con artefactos. D) Se observa el cambio que se produce en el patrón alfa/delta durante una infusión continua de propofol, tras la administración de un bolo de ketamina de 0.5 mg/kg e inicio de perfusión a 0.1 mg/kg/h (flechas negras) con fines analgésicos en un paciente de 15 años, que estuvo en cirugía por escoliosis lumbar.
Conclusiones
El cerebro no es sólo un número y el uso de índices basados en el electroencefalograma para guiar la profundidad anestésica no está exento de importantes limitaciones. Cada fármaco tiene su diana molecular correspondiente con un patrón electroencefalográfico característico, por lo que simplemente observar el valor que muestra un IPA puede no ser suficiente e incluso sus valores podrían no coincidir con el estado hipnótico en el que se encuentra el paciente. Si añadimos el análisis visual del EEG y la MDE, pese a que requiere mayor formación, aportará más información frente al IPA, puesto que permite su valoración independientemente de la patología, edad o fármaco que se esté empleando. Su uso, además de disminuir el riesgo de despertar intraoperatorio, trae consigo otros beneficios como el menor consumo de fármacos, despertares más rápidos, reducción del tiempo en las unidades de recuperación, así como disminución del deterioro cognitivo y delirio postoperatorio, entre otros. Por todo ello, es fundamental la integración de los datos que los MPA aportan, para poder detectar situaciones en las que solamente la valoración del IPA no hubiese sido suficiente.











 nueva página del texto (beta)
nueva página del texto (beta)




