Introducción
Tras la popularidad que ganaron los monitores de profundidad anestésica: entropía (GE Healthcare) y el índice biespectral o BIS (por sus siglas en inglés) (Medtronic, Covidien), la anestesiología recibió entusiastamente el advenimiento de una nueva generación de monitores de la profundidad anestésica como Narcotrend (MonitorTechnik), SedLine (Masimo) y el mismo BIS; con un procesador del electroencefalograma (EEG) llamado espectrograma o espectrografía, aunque su comercialización fue limitada. La empresa Medtronic y su filial Covidien, a través de su sitio de internet, liberaron en 2020 el software para actualizar su monitor BIS, lo que pone al alcance de muchos hospitales y anestesiólogos un monitor de la profundidad anestésica de nueva generación. Este trabajo incluye fotografías de monitores BIS (Medtronic, Covidien) colocados de manera convencional en la región frontal de pacientes en el período perioperatorio.
Espectrograma
Tras la obtención de las ondas de EEG con electrodos de superficie, se procesa en un espectro que grafica dos dimensiones: la frecuencia de las ondas y el poder de cada frecuencia en decibeles, posteriormente para poder agregar la dimensión de tiempo, la potencia de las ondas se transforma en una escala calórica de colores y se obtiene un gráfico tridimensional llamado matriz de densidad espectral (DSA, por sus siglas en inglés), también conocido como espectrograma1. En este gráfico tridimensional la variable de tiempo se grafica en el eje de las «x» en unidad de minutos, la frecuencia de las ondas en el eje «y» en hertz (Hz) y en una escala de colores cálidos y fríos, que va del azul (ausencia de poder) al rojo (mayor poder) se grafica la potencia de la presencia de ondas.
La DSA es una tecnología que recientemente trata de aprovecharse en muchas ramas de las neurociencias para detectar actividad epiléptica, para identificar las diferentes huellas de los fármacos anestésicos y las diferencias en la actividad cerebral de pacientes ancianos y pediátricos, todos son escenarios que durante mucho tiempo se encontraron fuera de los valores numéricos de los monitores de profundidad anestésica2-5.
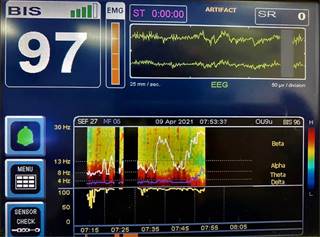
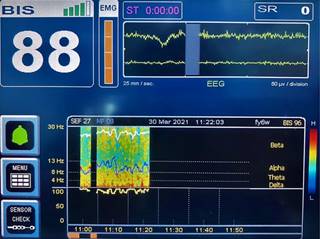
Paciente despierto
En el EEG normal de un paciente despierto deben verse ondas beta y gamma en la región frontal central que nos indican consciencia y actividad intelectual, ondas alfa o más lentas en regiones occipitales (ritmo dominante posterior) que aumentan cuando el paciente cierra los ojos y ritmos lentos en regiones subcorticales6. La sumatoria de toda la actividad nos da como resultado una DSA con colores cálidos en todo el espectro de frecuencias (Figura 1).
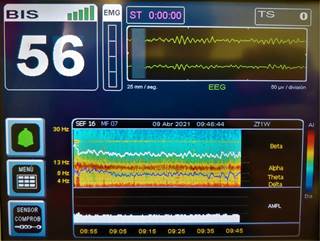
Propofol
Dependiendo de la velocidad y dosis de administración del propofol, tras la pérdida de la consciencia se puede observar un patrón predominante de ondas delta y lentas, si el paciente es anciano inclusive pueden aparecer brotes de supresión. Durante la recuperación de la pérdida de la consciencia o si el efecto se mantiene con una perfusión del fármaco, se verá la aparición de un patrón combinado de ondas alfa (9-12 Hz) y lentas (0.5-1 Hz)1. En un paciente despierto sólo se observan ondas alfa en las regiones occipitales (corteza visual) cuando el paciente cierra los ojos, pero durante la pérdida de la consci-encia la actividad alfa aparece en las regiones frontales y centrales, a lo que se le llama fenómeno de anteriorización7 (Figura 2).
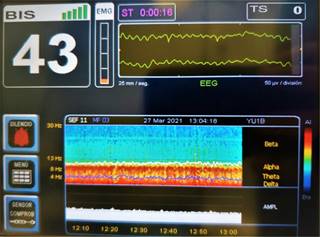
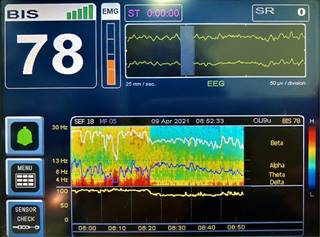
Sevoflurano
La DSA de pacientes anestesiados con sevoflurano ilustra un incremento en la potencia frontal de ondas delta (1-4 Hz), theta (5-8 Hz) y alfa (9-12 Hz)8 (Figura 3). Cuando sevoflurano es administrado en concentraciones por debajo de la concentración alveolar mínima (CAM) el EEG muestra oscilaciones lentas y delta, y oscilaciones alfa coherentes similares al patrón observado con propofol1 (Figura 4).
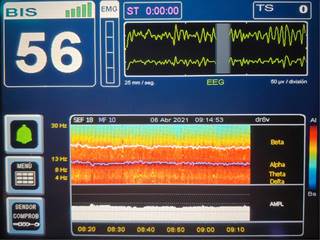
Figura 3: Electroencefalografía de sevoflurano y su huella en la matriz de densidad espectral con color rojo en todas las frecuencias por debajo de alfa (theta, delta y lenta).
Dexmedetomidina
El EEG de los pacientes que están recibiendo dexmedetomidina muestra una combinación de oscilaciones lentas y deltas, con spindles o «husos»; éstos son oscilaciones de 9 a 15 Hz que ocurren en ráfagas que duran de 1 a 2 segundos1. En la DSA los spindles aparecen como rayas rojas en el rango de frecuencia alfa y beta baja, pero a pesar de tener actividad similar al propofol, los spindles tienen mucho menos poder (Figura 5). Si la tasa de infusión de dexmedetomidina aumenta, los spindles desaparecerán y la amplitud o el poder de las ondas lentas y delta se incrementará. Aun cuando el paciente ya se encuentre anestesiado con propofol, la adición de dexmedetomidina aumenta la potencia de las ondas lentas y el pico de oscilación theta, mientras disminuye la potencia máxima alfa9.
Ketamina
La influencia de la ketamina en el trazado del EEG depende de la dosis. En las dosis habituales que inducen la pérdida del conocimiento, la ketamina produce un patrón llamado «estallido gamma» caracterizado por la alternancia de ondas delta lentas (0.1 a 4 Hz) con ondas gamma (27 a 40 Hz) asociadas con un aumento de las ondas theta (4 a 8 Hz) y disminución de las ondas alfa y beta10; a dosis bajas el EEG muestra oscilaciones rápidas, en el rango beta alto y bajo gamma entre 25 a 32 Hz muy similar al EEG de un paciente despierto y con actividad intelectual (Figura 6), lo que explica el incremento de la tasa metabólica cerebral, el flujo sanguíneo y las alucinaciones. La anestesia con ketamina se correlaciona de manera más clara con distintos cambios en el rango theta, incluido el aumento de la potencia y la conectividad funcional. La conectividad de anterior a posterior en alfa se deprime al máximo con la administración de ketamina anestésica, lo que sugiere un efecto dependiente de la dosis11.
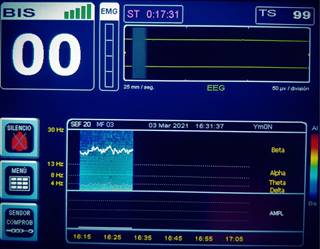
Muerte encefálica
Con fines ilustrativos se presenta una fotografía del monitor de un paciente adulto a quien se diagnosticó clínicamente muerte encefálica y se encontraba en espera de un estudio confirmatorio, ya que en nuestro país no está permitido utilizar los monitores de profundidad anestésica como método diagnóstico. Se observan los dos canales de EEG en isoeléctrico o «silencio eléctrico cerebral» y el valor de BIS de 0, además la DSA muestra colores fríos en tonos azules a lo largo de todo el rango de frecuencias, lo que se traduce como ausencia de actividad en todo el espectro (Figura 7).
Conclusiones
Es necesario que continuemos los esfuerzos por emplear monitores de la profundidad anestésica basados en el análisis de la electroencefalografía en bruto y que continuemos haciendo investigación al respecto, ya que esto permitirá al anestesiólogo basar su manejo anestésico en el entendimiento del efecto de los fármacos sobre el sistema nervioso central, al evitar la sobredosificación y posiblemente al disminuir la aparición de complicaciones, adelantarse al retraso de análisis de los monitores, reconocer anormalidades en los pacientes y en las diversas situaciones críticas del perioperatorio.











 nova página do texto(beta)
nova página do texto(beta)