Introducción
Las tumoraciones mediastinales anteriores implican un riesgo elevado de morbimortalidad debido a una alta incidencia de obstrucción de la vía aérea y colapso cardiovascular durante la inducción anestésica, ambas son potencialmente mortales y tienen una incidencia de complicaciones de 7-18%1.
Las masas mediastínicas suelen ser de etiología benigna o maligna y pueden surgir de cualquiera de los componentes del mediastino anterior: timo (timoma), tiroides, pulmón, vías respiratorias (carcinoma broncogénico), pleura, pericardio y tejido linfático (linfoma)2,3. Una valoración preoperatoria detallada es importante, ya que los pacientes pueden presentarse desde asintomáticos hasta presentar signos avanzados secundarios a la compresión de las estructuras intratorácicas, como dolor en el pecho, disnea, tos, diaforesis, estridor, síncope, distensión yugular, síndrome de vena cava superior e incapacidad para mantenerse en posición supina3. Otros síntomas más específicos pueden agregarse dependiendo de la etiología.
Se debe establecer un plan perioperatorio individualizado basado en los hallazgos clínicos, radiográficos y quirúrgicos. Este plan debe ser de naturaleza multidisciplinaria, incluyendo al anestesiólogo, cirujano, intensivista y oncólogo.
Los pacientes con masa mediastinal deben ser clasificados por riesgo de acuerdo con la presencia de síntomas y el porcentaje de compresión traqueal. La literatura indica ausencia de complicaciones graves en pacientes con características de bajo riesgo, así que pueden recibir anestesia general de forma segura con monitorización estándar. Los pacientes de riesgo intermedio y alto necesitan un tratamiento individualizado basado en sus síntomas y estudios radiológicos, ya que pueden presentar síndrome mediastinal (SM) caracterizado por la descompensación respiratoria aguda y hemodinámica4. La monitorización arterial invasiva y la colocación de un acceso central es obligatoria en estos pacientes debido al riesgo potencial de inestabilidad cardiorrespiratoria5.
En la Tabla 1 se muestra la clasificación de riesgo de acuerdo con la sintomatología presente.
Tabla 1: Clasificación de riesgo por sintomatología.
| Bajo riesgo | Riesgo intermedio | Alto riesgo |
|---|---|---|
| Asintomático o síntomas leves | Síntomas posturales leves o moderados | Síntomas posturales graves |
| Sin síntomas posturales | Compresión traqueal < 50% | Estridor, cianosis, derrame pericárdico o síndrome de vena cava superior |
| Sin evidencia significativa radiográfica de compresión estructural | Compresión de tráquea > 50% |
Modificada de: Blank RS, et al.4
Caso clínico
Femenino de 30 años de edad, originaria de León, Guanajuato, de ocupación fotógrafa.
Cuenta con un único antecedente de sarcoma sinovial en región plantar del pie izquierdo, diagnosticado en 2012 y tratado mediante resección quirúrgica. En 2013 presenta reincidencia en misma región con metástasis en región inguinal, retroperitoneo y tórax, por lo que se decide hacer una nueva resección de la lesión plantar y quimioterapia, que logra la remisión de la enfermedad. En 2019 se realiza nuevo PET que evidencia dos masas intratorácicas dependientes de pericardio y diafragma derecho, por lo que se reinicia esquema de quimioterapia y se programa para resección de tumores intratorácicos mediante toracotomía bilateral.
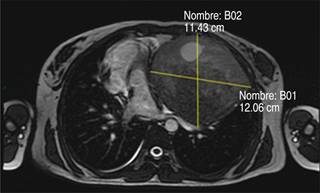
A su valoración se encontró alerta, orientada, con signos vitales con SpO2 95% al aire ambiente, TA 95/63 mmHg, FC 86 lpm. A su ingreso se solicitaron estudios preoperatorios, los cuales se encontraron dentro de parámetros normales. De igual manera, se solicitó electrocardiograma, el cual se encontró sin alteraciones. Se realizó TC de tórax que reportó lesión ocupante en el lóbulo inferior del pulmón izquierdo de aproximadamente 11.43 × 12.06 cm (Figuras 1 y 2), así como ecocardiografía que encontró derrame pericárdico moderado, engrosamiento de ventrículo izquierdo y FEVI 60%.
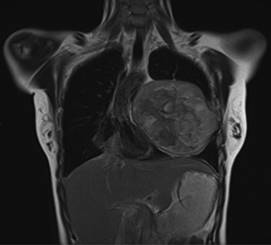
Figura 2: Tomografía axial computarizada reconstruida de tórax: masa en hemitórax izquierdo, que genera desviación de tráquea, corazón y pulmón.
A la exploración física se encontró con hipoventilación de campos pulmonares de predominio derecho y movimiento de amplexión y amplexación disminuidos, sin datos de dificultad respiratoria, ruidos cardíacos sin alteraciones y el resto de la exploración física normal.
Se realiza la cirugía el día 27 de mayo de 2020 bajo anestesia general balanceada y monitorización invasiva. Ingresó la paciente a sala quirúrgica, se colocó inicialmente monitorización no invasiva con apoyo de monitor rainbow. Se preoxigenó con O2 por mascarilla facial a 5 L/min y se realizó inducción anestésica mediante propofol de 150 mg, fentanyl de 150 μg, rocuronio 30 mg. Se realizó intubación unipulmonar mediante laringoscopía directa, colocando un tubo Robertshaw® 37 French izquierdo, se corroboró su colocación mediante fibroscopía, auscultación y capnografía. Durante la inducción se mantuvo estable en lo ventilatorio y hemodinámico. Tras la inducción, se colocó monitoreo invasivo mediante catéter venoso central yugular derecho y línea arterial.
Durante el mantenimiento se manejó ventilación mecánica controlada por volumen con volumen tidal de 400 mL, FR 12-14 rpm, PEEP 5-8 cmH2O, relación I:E 1:1.5, FiO2 80%. Se mantuvo hipnosis mediante sevoflurano a 2 vol%, fentanilo y dexmedetomidina en infusión. La paciente se mantuvo con tendencia a la hipotensión, por lo que se inició infusión de norepinefrina dosis respuesta, se reportó un sangrado total de 1,900 cm3, por lo que se transfundieron tres concentrados eritrocitarios y un plasma fresco congelado, así como ácido aminocaproico y gluconato de calcio, logrando egresar con hemoglobina 13 mg/dL. Se mantuvo con adecuada uresis y egresó con una gasometría arterial final con pH 7.35, pO2 101 mmHg, pCO2 38.2 mmHg, SatO2 97%, EB -3.9 mmol/L, HCO3 21.1 mmol/L, lactato 2.2 mmol/L, glucosa 81 mg/dL, K 4.1 mmol/L, Na 141 mmol/L. Egresó a Unidad de Terapia Intensiva para vigilancia del estado hemodinámico, con manejo analgésico mediante infusión con oxicodona, sin apoyo vasopresor, bajo ventilación espontánea con apoyo de O2 por tienda facial, hemodinámicamente estable con signos vitales de egreso con presión arterial media 66 mmHg, FC 70 lpm, SatO2 95%.
En cuanto a lo quirúrgico, se realizó toracotomía derecha en la cual se localizó tumoración de 7 × 10 cm en base pulmonar adherido a hemidiafragma, y se realizó resección de la misma (Figura 3). Posteriormente se realizó toracotomía izquierda y se efectuó resección amplia con lingulectomía y pericardiotomía parcial, finalmente se colocó prótesis de reconstrucción de pared torácica y dos sondas endopleurales.
Discusión
Las masas intratorácicas pueden ser benignas o malignas, pueden provenir del pulmón, pleura u otros componentes del mediastino. Los diagnósticos comunes son linfoma, timomas, tumores de células germinales, granulomas, carcinoma broncogénico, tumores de tiroides y quistes broncogénicos6. Pueden generar compresión en corazón, grandes vasos, vías respiratorias e incluso pueden llegar a presentar síndrome de masa mediastínica (SMM), el cual es el colapso de la vía respiratoria al momento de colocarse en posición supina. Puede presentarse como una leve o moderada dificultad para respirar hasta un colapso total de las vías respiratorias. Los factores de riesgo del SMM son derrame pericárdico, compresión traqueal de > 50% y patrones mixtos restrictivos y obstructivos en las pruebas de función pulmonar7.
La cirugía para resección de tumores mediastínicos conlleva un gran reto por los cambios hemodinámicos y ventilatorios que se generan durante la anestesia general secundarias a la compresión de las estructuras intratorácicas6. Las consideraciones anestésicas durante la cirugía de pacientes con masa mediastinal varían de acuerdo con los hallazgos y la cirugía propuesta5. Aunado a esto, en la mayoría de estos abordajes torácicos es necesaria una ventilación unipulmonar, la cual presenta su propio desafío y requiere cierta experiencia en la técnica y manejo de las complicaciones. Los tubos de doble lumen son grandes y difíciles de manejar, y a menudo son difíciles de colocar. La adición de una vía aérea difícil, conocida o inesperada, puede hacer que la colocación sea imposible. Asegurar la vía aérea con un tubo endotraqueal, independientemente del tipo, en una vía aérea difícil, pero conocida, suele ser la primera prioridad y el primer desafío8,9. Elegir un tubo de doble lumen (TDL) de tamaño adecuado y garantizar su colocación adecuada es fundamental para un aislamiento pulmonar adecuado. Un TDL de tamaño insuficiente puede aumentar el riesgo de incrementar la presión positiva al final de la espiración (PEEP) e hiperinsuflación pulmonar dinámica. Se considera un TDL de tamaño «óptimo» al más grande, que atravesará de manera atraumática la glotis y la tráquea, cuyo componente bronquial se asienta en el bronquio del tallo principal con sólo una pequeña fuga de aire10.
Los TDL colocados a ciegas pueden estar mal posicionados hasta en un 48% de las veces11. La broncoscopía de fibra óptica sigue siendo el estándar de oro para confirmar su colocación. En cuanto a la medición del diámetro bronquial, la tomografía computarizada es el estándar de oro, sin embargo, es poco práctico en algunos escenarios12. Roldi y colaboradores, combinaron el uso de parámetros clínicos estándares (sexo y altura) para predecir el tamaño de TDL13.
Posteriormente se adiciono a los parámetros clínicos para las mediciones traqueales mediante ultrasonido, con el objetivo principal de reducir el uso de TDL de gran tamaño14,15. Se demostró que el uso de la ecografía es una alternativa más confiable que la auscultación, al ser una alternativa más simple y económica que la fibrobroncoscopía. En la Tabla 2 se muestran algunas de las indicaciones más frecuentes para la ventilación unipulmonar11.
Tabla 2: Indicaciones más comunes para la ventilación unipulmonar.
| Exposición quirúrgica | Aislamiento protector pulmonar | Ventilación pulmonar diferencial | Lavado bronquial unilateral |
|---|---|---|---|
| Resección pulmonar | Malignidad | Trasplante unipulmonar | Proteinosis alveolar pulmonar |
| Cirugía toracoscópica asistida por video | Material purulento | Fístula broncopleural | |
| Toracoscopía | Hemoptisis masiva | Ruptura bronquial | |
| Biopsia de pulmón | Enfermedad pulmonar parenquimatosa asimétrica | ||
| Biopsia de ganglio linfático | |||
| Cirugía de aorta torácica | |||
| Cirugía de esófago | |||
| Cirugía mediastínica | |||
| Cirugía de la pared torácica |
Modificada de: Shoni M, et al.13
Mantenimiento de la anestesia. La elección farmacológica para mantener la anestesia general ha sido ampliamente debatida. Se sabe que los anestésicos inhalados inhiben la vasoconstricción pulmonar hipóxica, y tienen como ventaja la atenuación de la respuesta inflamatoria, la protección del glucocáliz y del parénquima pulmonar10. Las técnicas mediante TIVA (anestesia total intravenosa) no alteran la vasoconstricción pulmonar hipóxica, además de disminuir el desajuste V/Q y mejorar la oxigenación, por lo que la convierten en la técnica anestésica de elección para pacientes sometidos a ventilación unipulmonar.
Manejo de la hipoxemia secundaria a ventilación unipulmonar. Durante la ventilación unipulmonar el pulmón que se interviene quirúrgicamente se excluye de la ventilación, mientras se mantiene la perfusión. Este gran desajuste entre ventilación y perfusión (V/Q) crea una derivación intrapulmonar con hipoxemia. Además, la pérdida de reclutamiento alveolar del pulmón no operado debido a la anestesia general y la posición lateral también contribuye a la hipoxemia16.
La vasoconstricción pulmonar hipóxica activa y redirige el flujo sanguíneo, desde las regiones pulmonares mal ventiladas del pulmón no ventilado hacia las regiones pulmonares bien ventiladas, para disminuir la derivación intrapulmonar. Los factores que mejoran la compatibilidad V/Q incluyen la posición de decúbito lateral, así como maniobras de reclutamiento. Se pueden intentar aumentos de PEEP en el pulmón no operado hasta un máximo de 20 cmH2O para abrir los alvéolos atelectásicos, mientras la hemodinamia del paciente lo tolere. Cuando la PEEP se acerque al punto de inflexión de la curva de distensibilidad pulmonar estática del paciente, es probable que mejore la oxigenación. Por el contrario, si la presión de equilibrio al final de la espiración aumenta más allá del punto de inflexión, es probable que se deteriore la oxigenación. La aplicación de PEEP en el pulmón no operado debe individualizarse. Por otro lado, también se debe considerar la insuflación apneica de oxígeno o la presión positiva continua en las vías respiratorias (CPAP) hacia el pulmón operado para mejorar la oxigenación mediante la ventilación mecánica pasiva17.
Manejo del dolor. Las estrategias de manejo del dolor se basan en una anestesia multimodal y tienen como objetivo proporcionar una analgesia postoperatoria adecuada, al reducir las complicaciones postoperatorias. El dolor postoperatorio en la cirugía torácica coincide con cada ciclo respiratorio, lo que hace que los pacientes presenten un dolor constante10. Además del uso de analgésicos intravenosos, la anestesia regional es una de las técnicas de elección para estos procedimientos quirúrgicos, y la analgesia epidural torácica es el estándar de oro. En las dosis habituales, la analgesia epidural no afecta significativamente la oxigenación y podría prevenir el desarrollo de lesión pulmonar aguda. Otras técnicas alternativas de anestesia regional incluyen el bloqueo paravertebral, el bloqueo del erector espinal y el bloqueo del serrato anterior, que causan menos hipotensión sistémica comparado con el bloqueo epidural, sin embargo, requieren entrenamiento especializado adicional12.
Conclusión
Las masas mediastinales abordan muchos retos para el anestesiólogo, a quien le compete realizar un abordaje preoperatorio completo, tomando en cuenta para su plan anestésico las repercusiones tanto de la vía aérea como hemodinámicas que se pueden presentar durante el transanestésico. De igual manera se deben considerar todos los cambios en la mecánica pulmonar, principalmente los cambios en las presiones pulmonares, para lograr así una rápida y adecuada recuperación pulmonar, y durante la ventilación unipulmonar es importante mantener adecuados niveles de PEEP de manera individualizada, para poder disminuir el riesgo de atelectasias.
La intubación selectiva sigue siendo la mejor opción de manejo de la vía aérea en este tipo de pacientes. De igual manera, es fundamental tener un adecuado manejo analgésico postoperatorio para que su recuperación sea satisfactoria.
Se debe comunicar sobre el plan anestésico al equipo quirúrgico, así como ellos deben comunicarnos a detalle el plan quirúrgico, para conocer todas las posibles complicaciones durante el transanestésico y poder preverlas.











 nueva página del texto (beta)
nueva página del texto (beta)