Introducción
Las complicaciones neurológicas perioperatorias secundarias a la sedación y anestesia general son frecuentes1,2. Es así como eventos isquémicos pueden presentarse hasta en 1% de las cirugías no cardíacas, no neurológicas, y hasta en 3.0 a 4.9% de las cirugías cardiovasculares1,3; adicionalmente, se ha encontrado mayor incidencia en pacientes de edad avanzada (> 65 años de edad), diabéticos o con antecedentes de enfermedad cardiovascular1-3. Por otra parte, la hipoxia intraoperatoria o sus factores precipitantes como la reducción del flujo sanguíneo cerebral (FSC) se presentan hasta en 9% de las cirugías cardíacas, y se han asociado a mayor riesgo de deterioro cognitivo, delirium, accidentes isquémicos transitorios e incluso muerte1,2,4,5. Para evitar estos desenlaces es necesario detectar la hipoxia cerebral de manera temprana; sin embargo, hasta el momento no existe consenso sobre cuál es la prueba ideal para su diagnóstico6,7.
Para este fin se han creado métodos que miden marcadores relacionados a hipoxia cerebral, entre los más usados encontramos algunos invasivos como la medición de la presión intracraneal (PIC), el cálculo de la presión de perfusión cerebral (PPC)7-11, la presión tisular de oxígeno cerebral (PtiO2)8-10, la microdiálisis cerebral (MDC)7-9,11-13 y otros no invasivos como el Doppler transcraneal y la espectroscopía de infrarrojo cerebral8,9,14. Entre éstos la MDC se ha presentado como una herramienta particularmente útil, ya que permite medir niveles de sustratos y metabolitos que reflejan directamente las diferentes adaptaciones celulares a la variación en los niveles de oxígeno6,12,13.
Los primeros estudios que evaluaron la MDC se enfocaron en medición de PtiO2 y demostraron resultados prometedores, pero el surgimiento de nueva evidencia hizo necesario el estudio y la búsqueda de otros marcadores que reflejaran el metabolismo hipóxico cerebral como el lactato, la relación lactato piruvato (RLP) y en ocasiones el glutamato15, ya que en condiciones fisiológicas el piruvato vincula la glucólisis y el metabolismo del glutamato al metabolismo oxidativo; en presencia de oxígeno, el piruvato será metabolizado por la enzima piruvato deshidrogenasa para entrar al ciclo de Krebs, pero en condiciones anaeróbicas esta enzima es inhibida y la enzima lactato deshidrogenasa aumentará la conversión de piruvato a lactato, incrementando la RLP16-19.
El uso del lactato y la RLP es controversial, ya que sus valores pueden ser inexactos cuando se examinan de manera aislada20, pues ambos presentan comportamientos complejos21 y su metabolismo se ve afectado por distintos fenómenos fisiopatológicos19 que en muchas ocasiones llevan a que la fluctuación de sus concentraciones no se ajuste a la respuesta a la hipoxia cerebral, según conceptos clásicamente descritos18, lo cual podría explicar los niveles elevados de lactato o RLP en ausencia de hipoxia, o por el contrario, los niveles normales en presencia de hipoxia marcada21. Dado que la evidencia del uso del lactato como marcador de hipoxia en anestesia o sedación es controversial7, se realizó una búsqueda de la literatura para evaluar la utilidad de su elevación para el diagnóstico temprano de hipoxia cerebral.
Material y métodos
Se realizó una revisión sistemática cualitativa con base en la guía PRISMA (por sus siglas en inglés, Preferred Reporting Items for Systematic Review and Meta Analysis)22.
Criterios de elegibilidad
Los documentos seleccionados para la revisión debieron realizarse en pacientes mayores de 18 años, bajo anestesia general y/o sedación con medición de lactato como diagnóstico y/o predictor de hipoxia cerebral. Se excluyeron artículos duplicados, con ausencia de relación en título, artículos relacionados con elevación de lactato por causas diferentes a hipoperfusión/hipoxia cerebral y que mencionan lactato como marcador pronóstico, predictor de morbilidad o mortalidad.
Métodos de búsqueda
Se realizó una búsqueda a través de las siguientes bases de datos electrónicas: PubMed, Scopus, Web of Science, ScienceDirect, ClinicalKey y Ovid. Se incluyeron artículos sin tener en cuenta la fecha de publicación utilizando como filtros artículos primarios en idioma español e inglés, sin límite de tiempo.
Para la caracterización de los estudios, la técnica implementada se basó en la utilización de vocabulario en términos MESH, utilizando la estrategia PICOT22, diferenciando: P (población): pacientes bajo anestesia general o sedación, I (intervención): no específica, por lo cual se omitió, C (comparación): niveles de lactato obtenidos en presencia o ausencia de hipoxia cerebral, O (outcomes o desenlaces): elevación de lactato como marcador de hipoxia cerebral, T (tiempo): durante estancia hospitalaria.
Selección de los estudios
Todas las referencias de los artículos incluidos se procesaron con la aplicación web de acceso gratuito para la gestión de revisiones sistemáticas Rayyan para eliminar los elementos duplicados. Posteriormente se revisaron los títulos y resúmenes teniendo en cuenta los criterios de elegibilidad (Figura 1).
El texto completo de los artículos incluidos fue leído por dos de los evaluadores de manera individual estableciendo el total de documentos; posteriormente los documentos fueron leídos y discutidos por cuatro de los autores determinando el número definitivo de artículos. La totalidad de archivos suplementarios se encuentran disponibles por pedido al autor corresponsal.
Análisis estadístico y riesgo de sesgos y aplicabilidad
Se consideraron datos estadísticamente significativos con valores p = 0.05 e intervalos de confianza de 95%. El riesgo de sesgos y la calidad metodológica se evaluó de los artículos seleccionados a través de la herramienta QUADAS-2 (evaluación de la calidad de los estudios de precisión diagnóstica) 23 y la extensión PRISMA para reportar revisiones sistemáticas exploratorias (PRISMA-ScR).
Resultados
Se incluyó un total de 167 pacientes (54 mujeres y 113 hombres), sus edades oscilaban entre 18 y 71 años, las patologías fueron en su totalidad neurológicas: 28 con HSA (hemorragia subaracnoidea), de las cuales 27 tienen Fisher > dos y una fue clasificada como grado I por la Federación Mundial de Neurocirujanos, 99 tenían diagnóstico de lesión cerebral traumática severa, 19 presentaban hemorragia supratentorial intraparenquimatosa o intraventricular con volumen > 30 mL y 21 tenían criterios de lesión difusa tipo II, III, IV o V según clasificación de Marshall en tomografía computarizada cerebral.
La totalidad de los estudios vinculan diferentes métodos de monitoreo de perfusión cerebral, principalmente sensores de monitoreo multiparámetro: PIC, PPC, PtiO2 siempre asociados a la cuantificación de diferentes marcadores como lactato, glutamato, glucosa, piruvato y la RLP obtenidos por microdiálisis cerebral (Tabla 1).
Tabla 1: Artículos encontrados que hacen énfasis en la elevación de lactato como marcador de hipoxia cerebral.
| Autor | Tipo de estudio | Características de la población | Intervención (parámetros utilizados) | Resultados | Conclusiones |
|---|---|---|---|---|---|
| Hutchinson, et al.(24) | Reporte de caso | 1 paciente con HSA grado I | Comparación de variables monitoreo multiparámetro (PIC, PPC y PtiO2) y comportamiento de marcadores extracelulares por microdiálisis (lactato, glutamato, piruvato y glucosa) con diferentes intervalos de tiempo durante la intervención quirúrgica | Durante el abordaje hubo una caída de PtiO2 (de 28 mmHg a 2 mmHg) asociada con un aumento en el CO2 cerebral (de 28 mmHg a 34 mmHg) y una disminución en el pH (de 7.23 a 7.06). Dicho evento hipóxico se asoció con disminución de piruvato (de 48 µmol/L a 20 µmol/L) y aumentos en lactato (de 0.97 mmol/L a 3.5 mmol/L) y glutamato (de 9.1 µmol/L a 99 µmol/L) | Sí se evidenció elevación del lactato y cambios en otros marcadores (glucosa, piruvato y glutamato) asociados a HCT |
| Sexo femenino | |||||
| Edad 41 años | |||||
| Hlatky, et al.(15) | Cohorte retrospectiva | 57 ptes. con LCT | Comparación de variables monitoreo multiparámetro (PIC, PPC y PtiO2) y comportamiento de marcadores extracelulares por microdiálisis (lactato, glutamato, piruvato y glucosa) cada hora | El lactato de dializado aumentó de 3.4 ± 0.3 mmol/L cuando PtiO2 era normal a 4.5 ± 0.6 mmol/L cuando PbtO2 disminuyó por debajo de 10 mmHg, y a 4.8 ± 0.8 mmol/L cuando PtiO2 estaba en el nivel más bajo registrado (p < 0.05) | Sí, principalmente la R L/P o lactato, cuando hay hipoperfusión severa |
| Ptes. con hipoxia | |||||
| Edad 43.7 ± 23.8 (H: 5 M: 2) | |||||
| Ptes. sin hipoxia | También cuando PbtO2 disminuyó por debajo de 10 mmHg, la relación L/P de dializado no cambió significativamente de estos valores de referencia. Sin embargo, como PtiO2 disminuyó a valores aún más bajos, la relación L/P dializado aumentó de 37.5 ± 18.8 a 76.3 ± 17 | ||||
| Edad 37.1 ± 15.2 (H: 44 M: 6) | |||||
| Sahuquillo, et al.(21) | Cohorte retrospectiva | 21 ptes. con TCE moderado a grave | Monitoreo por microdiálisis cerebral y PtiO2. | Se usaron puntos de corte de > 2.5 en lactato y de 25 en RLP para definir metabolismo anaerobio. | No, la elevación del lactato y la relación lactato piruvato no tuvieron una correlación con episodios de hipoxia tisular (medidos por PO2) |
| H: 15 y M: 6 | Se analizaron los niveles de lactato y R L/P de cada microbial generado en las primeras 96 horas tras el TCE | ||||
| Glasgow ≤ 13 | |||||
| Edad entre 18 y 70 años | Se encontró una concordancia (k = 0.029; IC 0.24-0.34) | ||||
| Chen, et al.(26) | Cohorte retrospectiva | 19 ptes. con SAH Fisher ≥ 2 o Hunt y Hess ≥ 2 | Comparación de variables monitoreo multiparámetro y comportamiento de marcadores extracelulares por microdiálisis. | La sensibilidad de PIC o PPC anormal para R L/P elevado y PtiO2 reducido fue mala (21.2% en el mejor de los casos). | No hay relación de HCT con cambios en los niveles de lactato |
| Sexo H: 13 M: 6 | La R L/P o PtiO2 fue anormal en muchos casos con PIC o CPP normal. | ||||
| Edad media: 51 años (31a-71a) | Se examinó la frecuencia de hipoxia cerebral y disfunción energética en diferentes rangos de PIC y PPC y la relación entre PtiO2 y la R L/P | La hipoxia cerebral grave a menudo se asoció con un R L/P > 40 (86%). No obstante, se observó hipoxia cerebral leve (20 mmHg) e hipoxia cerebral severa en sólo 53 y 36% de las muestras con disfunción de energía cerebral, respectivamente | |||
| GCS ≤ 8 ptos. | |||||
| Ko, et al.(10) | Cohorte retrospectiva | 18 ptes. comatosos con hemorragia intracerebral | Comparación de PtiO2 cerebral y comportamiento de marcadores extracelulares por microdiálisis (lactato, glutamato, piruvato y glucosa) cada hora | La relación entre oxigenación cerebral y crisis metabólica e hipoxia cerebral, aumenta si PPC < 50/crisis metabólica: riesgo PPC < 70 mmHg. | El riesgo de hipoperfusión cerebral aumentó significativamente cuando la PPC disminuyó a 80 mmHg en comparación con 100 mmHg como rango de referencia |
| Sexo H: 9 M: 9 | Predictores de hipoxia cerebral: 18% de probabilidad de presentar hipoxia cerebral por cada aumento de 10 mmHg en PPC (OR: 0.82; IC 95%: 0.69-0.96; p = 0.01). | ||||
| Edad entre 32 y 80 años | |||||
| GCS 6 ptos | Predictor de crisis metabólica: 12% > probabilidad si índice de reactividad de oxígeno es 0.2 (OR: 1.12; IC 95%: 1.0-1.2; p = 0.02) | ||||
| Patet, et al.(25) | Cohorte prospectiva | 26 ptes. comatosos con LCT y HSA | Comparación de variables monitoreo multiparámetro (PIC, PPC y PtiO2) y comportamiento de marcadores extracelulares por microdiálisis (lactato, glutamato, piruvato y glucosa) cada hora | Con R L/P normal, hay una correlación directamente proporcional entre lactato arterial y cerebral (r = 0.56, p = 0.0001). Sin embargo, cuando está R L/P > 25, la correlación se vuelve inversamente proporcional (r = -0.11, p = 0.04). Durante aumento de la demanda cerebral R L/P normal (r = 0.62) incrementó a R L/P > 25 (r = 0.45) (ambos p < 0.0001) | En condiciones homeostáticas, los niveles de lactato arterial y cerebral sí tienen una fuerte correlación |
| HSA: 8 ptes. y LCT: 18 ptes. | |||||
| Sexo F: 10 ptes. y H: 16 ptes. | |||||
| Edad media 52 (entre 24 y 57 años) | |||||
| GCS (3-7 ptos.) | |||||
| Sala, et al.(19) | Cohorte prospectiva | 24 ptes. con LCT grave | Examinan el metabolismo de lactato cerebral en pacientes LCT severa en fase temprana, con microdiálisis y PtiO2 midiendo metabolismo cerebral y comparando la perfusión con TC | Los episodios de lactato elevados glucolíticos tienen niveles mayores de lactato (6.1 ± 2.22 versus hipoxico 4.7 ± 0.7 p = 0.05), piruvato (186.4 ± 46.3 versus hipóxico 106.8 ± 13.2 p < 0.0001) y PbtO2 (27.2 ± 5.3 versus hipóxico 16.7 ± 3.4 p < 0.0001) en episodios hipóxicos la relación LPR es mayor y niveles de glutamato más elevados | En pacientes con LCT grave, el estudio indica que aumentar el lactato cerebral parece asociarse con glucólisis activada en lugar de hipoxia |
| Edad media: 36 años ± 15 años | |||||
| Sexo M: 6 ptes. y H: 18 ptes. | |||||
| GCS medio 5 ptos. (3-8 ptos.) |
HSA = hemorragia subaracnoidea; PIC = presión intracraneal; PPC = presión de perfusión cerebral; PtiO2 = presión tisular de oxígeno cerebral; HCT = hipoperfusión cerebral temprana; LCT = lesión cerebral traumática; Ptes. = pacientes; H = hombres; M = mujeres; R L/P = relación lactato/piruvato; TCE = trauma craneoencefálico; HSA = hemorragia subaracnoidea; Ptos. = puntos; GCS = Glasgow coma score.
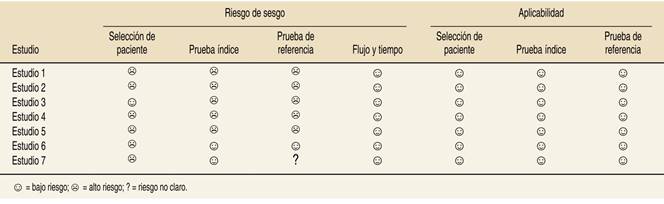
Calidad de los estudios y riesgo de sesgos
Respecto a la calidad de los artículos (Figura 2), en la evaluación de aplicabilidad de pruebas, la condición diana cumplió con una adecuada evaluación por medio de una prueba índice y/o prueba de referencia en la totalidad de publicaciones. No obstante, se evidenció alto riesgo de sesgo de selección en seis de siete artículos dado por la ausencia de aleatorización de pacientes, puesto que sólo se estudiaron pacientes con condiciones que requieren monitoreo intracraneal. Además, se evidenció riesgo de sesgo de alto grado en la prueba índice en cinco de siete artículos (por ausencia de cegamiento de evaluadores) y de prueba de referencia en seis de siete (por interpretación de resultados con conocimiento de prueba índice). Por último, en flujos y tiempos hubo bajo riesgo en todos los artículos, pues todos los estudios realizados incluyeron mediciones de marcadores de metabolismo y PtiO2 desde mediciones continuas hasta cada hora (Figura 3).

Figura 3: Riesgo de sesgo de artículos seleccionados. Estrategia de evaluación de sesgo QUADAS-2; se evidencia alto riesgo de sesgo en selección de paciente (seis/siete artículos), prueba índice (cinco/siete artículos) y prueba de referencia (cinco/siete artículos); en uno de los artículos no se mencionaba información suficiente. No hay riesgo de sesgo con respecto al flujo y tiempo de los artículos evaluados.
La mayoría de los estudios plantean como hipótesis el uso de lactato como marcador de hipoperfusión/hipoxia cerebral y para ello, lo asociaron a los parámetros que indirectamente sugieren la aparición de dicho evento (como disminución de PtiO2 o de la presión de perfusión cerebral) y evaluaron su comportamiento en el período hipóxico.
Lactato, piruvato y relación lactato/piruvato (RLP)
El lactato y el piruvato podrían ayudar a dilucidar los episodios de hipoxia/isquemia, dado su comportamiento durante este fenómeno. Hutchinson y colaboradores reportaron hipoxia cerebral en dos ocasiones durante un procedimiento quirúrgico de aneurisma basilar. El primer episodio se presentó durante el abordaje quirúrgico, en el cual se encontró una disminución de la PtiO2 (de 28 mmHg a 2 mmHg) asociada a elevación en los niveles de lactato y piruvato con respecto a los valores iniciales de la siguiente manera: el lactato se elevó durante el minuto nueve y 15 (60%), minuto 42 (150%), y minuto 85 (250%) alcanzando un pico máximo. Por su parte, el piruvato alcanzó 33% al minuto 25, pero esta elevación no fue constante (después del minuto 26 se generó una disminución del mismo). El segundo episodio se presentó por edema cerebral posterior al cierre de la duramadre, el cual registró un nuevo descenso de la PtiO2 (38 mmHg a 26 mmHg); sin embargo, el lactato y el piruvato no mostraron cambios significativos respecto a la línea de base24. Patet y colaboradores realizaron una comparación entre lactato cerebral versus sérico, evidenciando que en condiciones normales (RLP normal) hay una correlación fuerte con un índice de Pearson positivo r = 0.56 p = 0.001; sin embargo, en episodios de alteración metabólica cerebral (RLP > 25) esta relación disminuye con r = -0.11 p = 0.004, por lo que los resultados ante lesión cerebral o hipoxia no serían equiparables25.
Flujo sanguíneo cerebral (FSC)
Sala y colaboradores usaron PCT (perfusion computed tomography, por sus siglas en inglés) con inyección de iohexol para determinar variaciones de la perfusión cerebral y determinaron que la totalidad de los pacientes con hiperlactatemia hipóxica presentaron oligoemia cerebral (FSC < 32.5 mL/100 g/min), mientras que en los pacientes con hiperlactatemia secundaria a glucólisis se observó FSC normal en 62% e hiperemia cerebral (FSC > 70 mL/100 g/min) en el restante 38%19; sin embargo, la medición de FSC no fue contemplada en los otros estudios.
Presión intracraneal y presión de perfusión cerebral
Chen y colaboradores buscaron determinar la prevalencia de hipoxia cerebral (PtiO2 < 10 mmHg) y disfunción energética (RLP > 40) en alteración de la presión intracraneal y de presión de perfusión cerebral (PPC). En pacientes con PIC normal (< 20 mmHg) se evidenció una incidencia de 15% de disfunción energética; sin embargo, en comparación con valores de PIC mayores hubo una incidencia de 14.5%, encontrando niveles de RLP > 40 con PIC 11.7 ± 11.9 mmHg y RLP < 40 con PIC 10.5 ± 8.2 mmHg p = 0.006, por lo que no se puede establecer una relación directa entre dichas variables. No obstante, evidenció que en pacientes con PIC elevadas tenía una asociación hasta de 55.6% con PPC disminuida (< 60 mmHg)26. Por el contrario, Ko y su equipo consideraron que los episodios de crisis metabólica (RLP > 40 y glucosa cerebral < 0.7 mmol/L) sí tienen una asociación con PPC, pues con valores > 110 mmHg la probabilidad de desarrollar crisis metabólica es sólo de 3% y con valores de PPC < 70 mmHg la probabilidad se incrementa a 17%20. A pesar de ello, el aumento de lactato también ocurre con presiones normales como lo evidenciaron Sala y colaboradores, episodios de hiperlactatemia no hipóxica están asociados a niveles normales de PIC (93 ± 4%) y PPC normal (88 ± 6%), por lo que las variaciones de PIC y PPC tienen una baja asociación con los niveles de lactato, a diferencia de la relación con PtiO2 que parece ser más alta19.
Asimismo, Chen y colaboradores evidenciaron valores normales de PIC (< 20 mmHg) en 80.6% de las muestras con hipoxia cerebral moderada, y 79.2% con hipoxia cerebral severa, y reportaron valores de PIC de 10.6 ± 7.4 mmHg en normoxia, 11.5 ± 9.9 mmHg en hipoxia moderada y de 15.7 ± 21.2 mmHg en hipoxia severa. Con valores normales PPC (> 60 mmHg) se encontró hipoxia cerebral moderada en 89.4% y severa en 75.8% de las muestras26. En pacientes con hipoxia cerebral moderada, las mediciones de PIC ≥ 20 mmHg tienen sensibilidad de 19.6% y especificidad de 91.1%, mientras que con valores de PPC < 60 mmHg la sensibilidad es de 16.5% con especificidad de 96.1%, además en pacientes con hipoxia cerebral severa (PtiO2 ≤ 10 mmHg) la PIC ≥ 20 mmHg tiene sensibilidad de 19.7% y especificidad de 90.1%, mientras que PPC < 60 mmHg cuenta con sensibilidad 14.4% y especificidad 95.6%, por lo cual cabe destacar bajos niveles de sensibilidad de PPC y PIC para diagnóstico de hipoxia cerebral26. Sin embargo, Ko y colegas encontraron una relación lineal entre PtiO2 y PPC, cuando la PPC disminuye de 90 a 50 mmHg, la probabilidad de hipoxia cerebral (PtiO2 ≤ 15 mmHg) se incrementa de 21 a 58%. Por cada 10 mmHg que aumente la PPC, la probabilidad de hipoxia cerebral disminuye 18% (OR: 0.82; IC 95%: 0.69-0.96; p = 0.001), por lo cual valores de PPC entre 70 mmHg y 80 mmHg fueron considerados como predictores de hipoxia cerebral (OR: 1.5; IC 95%: 1.1-2.1; p = 0.001)20. En este mismo estudio evidenciaron que si el índice de reactividad de oxígeno (relación PtiO2 y PPC) es > 0.2, puede tener 12% de probabilidad de presentar crisis metabólica (OR: 1.12; IC 95%: 1.0-1.2; p = 0.002)20.
Glucosa e hipoxia/isquemia cerebral
En relación a la glucosa, Hutchinson y colegas identificaron una disminución progresiva y proporcional de sus niveles asociada al evento hipóxico, alcanzando una reducción de 100% luego de una hora con valores de PtiO2 de 2 mmHg; no obstante, la asociación fue realizada durante un procedimiento vascular y se desconoce si hubo o no presencia de flujo arterial durante la medición24.
De forma similar, Hlatky y su equipo observaron hallazgos similares en condiciones de hipoxia (glucosa: 0.7 ± 0.2 mmol/L; p < 0.001), en comparación con niveles normales de PtiO2 (1.3 ± 0.2 mmol/L, p < 0.001). Vale la pena aclarar que estos episodios no estuvieron asociados a hipoglucemia sistémica, pues los niveles de glucosa séricos se mantuvieron entre 7.5 ± 1.3 mmol/L, y durante el punto más bajo de PtiO2 niveles de 7.3 ± 1.6 mmol/L; otro evento que se presentó posterior a la disminución de glucosa fue la reducción de niveles del piruvato15.
Contrario a lo anterior, Patet y colegas evidenciaron una relación lineal positiva entre glucosa cerebral y periférica, encontrando valores séricos de 6.5 (5.9-7.1) mmol/L durante los episodios de hipoglucemia cerebral (HGC) (definida como glucosa cerebral < 1.0 mmol/L) versus glucemia de 7.8 [7.0-8.9] en ausencia esta condición (p < 0.001), con un índice de correlación de Pearson r = 0.62 p < 0.001; sin embargo, cuando hay aumento de la demanda cerebral (RLP > 25) la relación disminuye r = 0.45 p = 0.001, por lo cual no es útil realizar una equivalencia de ambas variables durante esta condición25.
Otro factor evidenciado en el estudio fue el aumento de RLP en 80% de los pacientes con HGC, alcanzando valores de 35 ± 9 versus 27 ± seis en ausencia de dicho fenómeno p < 0.0001, esto asociado a la elevación del lactato de 4.0 ± 2.3 a 5.4 ± 2.9 mmol/L durante HGC p = 0.004 y de piruvato de 126.9 ± 65.1 a 172.3 ± 74.1 μmol/L, respectivamente p = 0.005; sin embargo, sólo 8% de HGC se asociaron niveles de PtiO2 < 15 mmHg25.
Glutamato y presión tisular de oxígeno cerebral
Hutchinson y su equipo evidenciaron que el descenso de PtiO2 (de 28 mmHg a 2 mmHg) coincidió con aumentos de glutamato (9.1 μmol/L a 99 μmol/L)24. Hlatky R y colaboradores describen un incremento de glutamato a medida que la PtiO2 desciende, pues con valores de 20-40 mmHg, el glutamato es 20.3 ± 3.8 mol/L (p = 0.16), y en niveles de hipoxia cerebral de 41.1 ± 16.1 mol/L (p = 0.21), alcanzando niveles de 52.3 ± 18.1 mol/L p = 0.001 cuando PtiO2 estuvo en el nivel más bajo15. N Sala y colegas observaron que los niveles de glutamato son más elevados en hiperlactatemia hipóxica 20.3 ± 33.4 μmol/L p = 0.068 en comparación con hiperlactatemia no hipóxica 16.2 ± 24.3 p = 0.068. Teniendo en cuenta que estos hallazgos no fueron estadísticamente significativos, el glutamato no ha sido implementado del todo como marcador de hipoxia cerebral19.
Discusión
Respecto a la calidad de los artículos, la mayoría tuvieron alto riesgo de sesgo de selección y ausencia de cegamiento de los evaluadores para el análisis de los resultados de las pruebas de MDC o PtiO2; sin embargo, los estudios igualmente se consideran de buena calidad, pues no se evidencian problemas en seguimiento y monitoreo de los pacientes, además la mayoría de los estudios son de tipo análisis retrospectivo, por lo que estos sesgos no influyen en el desenlace.
Durante la revisión de la bibliografía se pudo evidenciar que todas las mediciones de lactato fueron realizadas mediante MDC y por lo regular se asociaron a monitoreo multimodal. Ésta principalmente se llevó a cabo en pacientes con lesiones cerebrales como HSA de etiología aneurismática y traumatismo craneoencefálico (TCE) severo con hemorragia supratentorial, intraparenquimatosa o intraventricular8,9,27,28. En todos los estudios se determinó la presencia de hipoxia/isquemia cerebral basados en monitoreo de PtiO2, adicionalmente entre ellos existían puntos de corte muy variables, por lo cual es importante consensuar algunos conceptos como: hipercalemia cerebral (lactato cerebral > 4 mmol/L), RLP elevado (> 40), hipoglucemia cerebral (< 1 mmol/L), Hipoxia cerebral severa (PtiO2 < 10 mmHg) hipoxia cerebral moderada (PtiO2 < 20 mmHg), crisis metabólica (RLP > 40 e hipoglucemia cerebral)8,9,20,27,28.
La MDC permite estimar múltiples variables de metabolismo anaeróbico (lactato, glutamato, glucosa, RLP, piruvato) no sólo a nivel regional, sino también global independientemente de la localización de catéter (perilesional o tejido sano)19. En un inicio se planteó al lactato como marcador de hipoxia cerebral por medio de MDC; sin embargo, se evidenció mayor utilidad al efectuar monitoreo multiparámetro (PtiO2, PIC y PPC), por lo cual la mayor parte de estudios que se han realizado asociaron estos dos métodos29.
Relación lactato/piruvato
Una de las principales medidas asociadas a hipoxia cerebral es la RLP, cuyos metabolitos han sido ampliamente estudiados y usados para el diagnóstico de hipoxia cerebral21. Pese a lo anterior, el uso de RLP es controversial debido a que no existe claridad acerca sus valores normales y sus fluctuaciones en relación a alteraciones del metabolismo energético no asociadas a hipoxia, por ejemplo, la presencia de hiperlactatemia sérica puede aumentar la absorción de lactato por parte de los astrocitos a través de transportadores de monocarboxilato para ser usados como recurso energético cerebral30, por ello se ha evidenciado que condiciones como el ejercicio vigoroso, situaciones de estrés metabólico o hipoxia tisular sistémica pueden relacionarse con aumentos de lactato cerebral31. Por esto, de acuerdo a la literatura, las mediciones de lactato sérico carecen de utilidad para la búsqueda y detección de hipoxia cerebral25.
Medición de lactato y relación con glucosa
Otro de los marcadores asociados a la elevación de lactato fue la disminución de glucosa, por ejemplo, en un estudio realizado por Patet y colaboradores se encontró que cambios de RLP > 40 y glucosa < 1 mmol/L son considerados anormales, por lo que resultan ser predictores de crisis de energía celular y aparición de isquemia. Esto demuestra la importancia de combinar varios marcadores, en particular los dos últimos para predecir hipoxia cerebral28. Por el contrario, algunos estudios revelaron que la hipoglucemia (descrita como una disminución de 50% de los valores de glucosa y elevación de 50% de lactato cerebral) no era predominantemente de origen hipóxico, además, no se detectó asociación o evidencia de que la hipoglucemia generara cambios de la RLP en suero25.
Relación lactato y glutamato
Los estudios encontrados describen que los cambios en la relación lactato glutamato no fueron estadísticamente significativos. Sin embargo, Gupta y su equipo estudiaron los niveles de lactato en pacientes que llevaron a craniectomía descompresiva y observaron que los niveles medios de glutamato eran más altos en los períodos de isquemia detectada por medio de MDC cuando se comparaban con el metabolismo normal o la disfunción mitocondrial (59.6 μmol/L en isquemia versus 32.9 μmol/L en disfunción mitocondrial versus 14.38 μmol/L durante el metabolismo normal)27; no obstante, es difícil determinar la asociación y la significancia estadística entre esta relación.
Limitaciones
La mayoría de los estudios incluyó cohortes pequeñas, y entre los diferentes artículos no hubo consenso con respecto a las variables que evaluaron, ya que se utilizaron conceptos diferentes para definir normoxia, hipoxia cerebral leve, severa y moderada, crisis metabólica y alteración del metabolismo cerebral; los puntos de corte para la PtiO2, la RLP y la hipoglicemia cerebral variaban según el estudio. Todos los estudios usaron variables distintas para establecer una relación entre la hipoxia y los cambios en el metabolismo cerebral. Todo lo mencionado anteriormente pudo llevar a la obtención de resultados heterogéneos, por lo cual no se realizó un análisis estadístico de esta información, pero fue posible establecer relaciones entre el comportamiento de las diferentes variables que se analizaron.
Son necesarias futuras investigaciones que integren diferentes parámetros para aumentar los valores estadísticos de estas mediciones, realizando seguimientos continuos de niveles de glucosa, PtiO2, lactato, piruvato y RLP, de preferencia por MDC en línea para determinar la velocidad de cambio y patrones de los mismos.
Conclusiones
La medición aislada de los niveles de lactato cerebral no han mostrado desenlaces estadísticamente significativos en comparación con su asociación a monitoreo multimodal. Por otro lado, en presencia de disfunción metabólica cerebral su utilidad es nula. Sin embargo, se requiere un mayor número de ensayos clínicos aleatorizados y evaluación estricta de la medición de los niveles de lactato cerebral en pacientes bajo anestesia general.











 nueva página del texto (beta)
nueva página del texto (beta)