Introducción
Según la Sociedad Americana de Anestesiología (ASA, por sus siglas en inglés), el dolor agudo relacionado con una cirugía es aquel que se presenta en el paciente quirúrgico posterior al procedimiento. Sin embargo, debemos tomar en cuenta que el dolor postquirúrgico se caracteriza por diversas experiencias sensoriales, emocionales y mentales desagradables, asociadas con respuestas autonómicas, endocrinometabólicas, fisiológicas y conductuales1-3.
En la actualidad, el dolor agudo postoperatorio tiene una alta incidencia correspondiendo hasta al 50% en cirugía no torácica y de hasta el 80% cirugía de tórax y ortopédica. Los factores predictivos del dolor postoperatorio resultante de diversos procedimientos quirúrgicos son principalmente el dolor preoperatorio, ansiedad, edad, tipo de cirugía (abdominal, ortopédica o torácica) y duración (Figura 1)4,5.
La sensibilización central juega un papel importante en el dolor postquirúrgico, el cual es principalmente nociceptivo somático resultado de la agresión quirúrgica. Posterior a la agresión presentada en los receptores nociceptivos durante el evento quirúrgico, se presenta un estado hiperalgésico. Éste se divide en hiperalgesia primaria, resultado de la sensibilización de los nociceptores periféricos; e hiperalgesia secundaria, que se encuentra asociada con la sensibilización de la médula espinal y el sistema nervioso central. En caso de perpetuarse la nocisepción, se presentan alteraciones como alodinia, parestesias, etcétera. Bayman demostró que la toracoscopía provoca hasta un 25% de dolor crónico5-8.
Para poder tratar el dolor agudo postoperatorio se debe realizar una evaluación objetiva del mismo, a través de métodos y escalas dentro de las cuales se encuentra la EVN, es el método de medición empleado con más frecuencia en muchos centros de evaluación del dolor, la cual consta de la referencia del paciente tomando a 0 como ausencia de dolor y 10 como máximo dolor9-11.
La primera línea para el tratamiento de dolor postquirúrgico son los opioides. La buprenorfina es un agonista parcial de opiáceos derivado de la tebaína, sintetizado en 1969 por KW Bentley, tiene una estructura hexacíclica y fue comercializada por primera vez en los Estados Unidos en la década de 1980 por los laboratorios Reckitt & Colman como analgésico, con el nombre comercial de Buprenex 0.3 mg/mL inyectable. En comparación con la morfina, es más liposoluble con una potencia 20 a 30 veces superior, convirtiéndose en una molécula atractiva para la aplicación por diferentes vías, intravenosa, sublingual, transdérmica. Las dosis recomendadas para el manejo del dolor postquirúrgico por grupos de edades son: 2-12 años de 2-6 μg/kg cada seis a ocho horas, ≥ 13 años de 3 a 6 μg/kg en intervalos de hasta cada seis horas. Los efectos adversos más frecuentes son náuseas y vómitos y se presenta en relación a la dosis. Se ha observado que dosis menores de 4 μg/kg son efectivas y con pocas probabilidades de náusea y vómito12-17.
La toracoscopía es un procedimiento que se basa en la colocación de un telescopio (toracoscopio) dentro de la cavidad torácica para la visualización del tórax en tiempo real, se puede realizar bajo anestesia local más sedación o anestesia general balanceada. Se ha descrito ampliamente el uso de propofol y midazolam para sedación en estos procedimientos, así como fentanilo y bloque peridural o intercostal para el control analgésico. Sin embargo, Grendelmeier y colaboradores18 encontraron mayor riesgo al utilizar propofol vs midazolam para sedación consciente, dada una mayor incidencia de hipoxemia (saturación de oxígeno arterial pulsátil < 90%) y episodios de hipotensión (presión arterial sistólica < 90 mmHg)8,19-22. El uso de buprenorfina aún carece de evidencia científica que describa la dosis eficaz para efectos secundarios comunes como náuseas y/o vómitos en recuperación postquirúrgica o en pabellón. En este estudio se evaluó la eficacia terapéutica de la buprenorfina al comparar tres dosis del medicamento, observando como objetivo secundario el control de la náusea y vómito postoperatorio para cirugía toracoscópica en paciente despierto.
Material y métodos
Se realizó un estudio prospectivo, transversal, doble ciego a 48 pacientes sometidos a toracoscopía. Para el cálculo de muestra se tomó en cuenta a la población ingresada al Servicio de Neumología del Hospital General de México para cirugía de toracoscopía en el año 2016 (N = 62). Se estimó un error alfa bilateral de 0.05 con error beta de 0.20 y una pérdida probable de pacientes del 10% de la muestra con el paquete estadístico G power.
Este estudio se condujo de acuerdo a las normas de ética sobre investigación en sujetos humanos de la Declaración de Helsinki, el reglamento de la Ley General de Salud en materia de investigación para la salud. El protocolo fue autorizado por el Comité de Ética e Investigación del Hospital General de México «Dr. Eduardo Liceaga» con número de aprobación de DI/17/203/3/050.
Procedimiento: después de firmar consentimientos informados para realizar procedimiento anestésico, los pacientes ingresaron a sala de quirófano, donde se monitorizaron con presión arterial no invasiva (PANI), frecuencia cardíaca, electrocardiograma (EKG) de cinco derivaciones, frecuencia respiratoria, índice biespectral (BIS) y pulsioximetría. En caso de no existir contraindicaciones médicas para el procedimiento, se realizó toracoscopía con paciente despierto. A todos los pacientes se les proporcionaron los siguientes medicamentos durante el transanestésico: bloqueo con ropivacaína al 0.2% en zona intercostal y en herida quirúrgica; propofol dosis respuesta (para mantener un BIS entre 40 y 60%); fentanilo IV concentración plasmática 2-4 ng/mL a una perfusión de 0.026-0.052 μg/kg/min; lidocaína a 25 μg/kg/min IV; metamizol 30 mg/kg IV; dexametasona 8 mg IV; ondansetrón 8 mgs IV. Treinta minutos previos al término de la cirugía, se aplicó buprenorfina en perfusión intravenosa durante cinco minutos con bomba de jeringa-pistón de la siguiente manera: grupo A 1 μg/kg, grupo B 2 μg/kg y grupo C 3 μg/kg, después se vigilaron en la Unidad de Cuidados Postanestésicos monitorizados con PANI, EKG de 5 derivaciones, pulsioximetría y temperatura. Se llevó el registro de la analgesia obtenida en el postoperatorio además de las otras variables secundarias a los cero, 10, 30, 60, 90 y 120 minutos. En caso de dolor, se establece el siguiente rescate analgésico: ENV 1-3 no se administran medicamentos; ENV 4-5 se administra buprenorfina a un tercio de la dosis utilizada para analgesia postoperatoria vía IV; con EVN de 6 a 10 se administra buprenorfina IV a la mitad de la dosis utilizada para analgesia postoperatoria, la intensidad del dolor fue evaluada nuevamente a los 10 minutos en todos los casos (Figura 2).
Para mantener el estudio cegado un investigador aplicó la buprenorfina, realizó el procedimiento anestésico y recogió los datos en el período postquirúrgico, un segundo investigador realizó las diluciones y la aleatorización y un tercer investigador realizó el análisis estadístico.
Análisis estadístico: para la evaluación de la variable primaria «intensidad de dolor» (EVN) y sedación (RASS), se utilizó la prueba de Shapiro-Wilk que determinó que las variables fueron no paramétricas, posteriormente se llevó a cabo un análisis de medias para pruebas no paramétricas por medio de la prueba Kruskal-Wallis.
Por medio de la prueba de t de Student para variables dependientes, se compararon medias para conocer la diferencia entre variables cuantitativas continuas durante el tiempo, tanto para el dolor (EVN) como para sedación (RASS). Para las variables cualitativas se usó estadística descriptiva.
Resultados
De los 48 pacientes, se eliminó uno del grupo A y uno del grupo B, ya que ambos egresaron a la Unidad de Terapia Intensiva (UTI). Los casos estudiados tenían una edad de entre 20 y 79 años con una media de 53 años, el género fue predominantemente masculino (72%), mientras que el femenino fue de 28%; el procedimiento más frecuente fue la toma de biopsia (Figura 3).
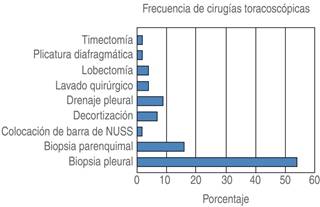
Figura 3: Frecuencia del tipo de cirugía realizada: biopsia pleural 25 pacientes, biopsia de parénquima pulmonar siete pacientes, colocación de barra de Nuss uno, decorticación tres, drenaje pleural cuatro, lavado quirúrgico dos, lobectomía dos, plicatura diafragmática uno, timectomía uno.
En cuanto a las variables dependientes analizadas, ningún paciente presentó náusea y/o vómito, RASH y/o depresión respiratoria. El control del dolor posoperatorio inmediato no controlado se observó en un paciente del grupo A (Tabla 1); al finalizar las dos horas de cuidados postquirúrgicos, se evidenció una frecuencia de descontrol de dolor agudo (EVN de cuatro o mayor) en el 33% de los pacientes del grupo A, y de 20 y 18.7% del grupo B y C respectivamente (Figura 4). Sin embargo, no se demostraron diferencias estadísticamente significativas en las medias para la intensidad de dolor en el momento de ingreso a la Unidad de Cuidados Postanestésicos (UCPA). En cuanto a la intensidad de dolor en relación al tiempo de estancia, se demostró la aparición más temprana (a los 10 minutos) estadísticamente significativa en el grupo A, en comparación al grupo B y C (Tabla 2).
Tabla 1: Frecuencia de intensidad de dolor (EVN) al ingreso a Unidad de Cuidados Postanestésicos.
| Grupo n (%) | 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| A | 2 (13.30) | 9 (60.00) | 3 (20.00) | 0 (0) | 1 (6.7) |
| B | 4 (26.66) | 10 (66.67) | 1 (6.67) | 0 (0) | 0 (0.0) |
| C | 6 (37.50) | 8 (50.00) | 2 (12.50) | 0 (0) | 0 (0.0) |
Observamos la intensidad de dolor en el momento en el que el paciente ingresa a Unidad de Cuidados Postanestésicos tanto en número (n) como en porcentaje (%), expresado con base a la escala verbal numérica, en cada grupo (grupo A = 1 μg/kg, grupo B = 2 μg/kg, grupo C = 3 μg/kg).
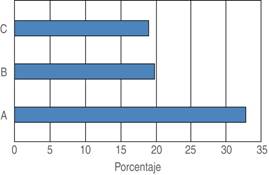
Figura 4: Frecuencia de pacientes con descontrol algológico. Se consideró descontrol algológico un EVN de cuatro o más, observándose mayor descontrol algológico en el grupo A. (Grupo A = 1 μg/kg, grupo B = 2 μg/kg, grupo C = 3 μg/kg).
Tabla 2: Diferencias de medias en intensidad de dolor conforme el paso de tiempo.
| Grupo | 0’ | 10’ | 30’ | 60’ | 90’ | 120’ |
|---|---|---|---|---|---|---|
| A | 1 | 0.041* | 0.02 | < 0.000 | < 0.000 | < 0.000 |
| B | 1 | 0.164 | 0.019* | 0.006 | 0.003 | < 0.000 |
| C | 1 | 0.384 | 0.045* | 0.012 | 0.004 | 0.001 |
Evaluación de la intensidad de dolor medido por (EVN) a los 0, 10, 30, 60, 90 y 120 minutos de estancia en UCPA por grupos (grupo A = 1 μg/kg, grupo B = 2 μg/kg, grupo C = 3 μg/kg), realizado por ANOVA.
EVN = escala verbal numérica, UCPA = Unidad de Cuidados Posanestésicos. ANOVA = Análisis de varianza.
* Estadísticamente significativo.
Para la evaluación de sedación se utilizó la escala RASS, ningún paciente presentó RASS de -4 (sedación profunda) o -5 (sin respuesta). El grupo que presentó menor frecuencia de sedación moderada (-3) fue el grupo A, sin diferencias estadísticamente significativas entre grupos a su ingreso a UCPA (Figura 5). En cuanto a la duración de la sedación por tiempo, observamos una recuperación lenta estadísticamente significativa en el grupo C comparado con el grupo A y B (Tabla 3).
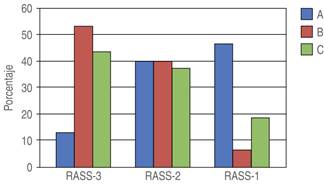
Figura 5: Nivel de sedación (RASS) al ingreso a UCPA. Nivel de Sedación representado en frecuencia, evaluado por escala de RASS al momento de ingreso a UCPA por grupo (Grupo A en color azul = 1 μg/kg, Grupo B en color rojo = 2 μg/kg y Grupo C en color verde = 3 μg/kg).
Tabla 3: Diferencia de nivel de sedación RASS entre las medias conforme el tiempo, durante su estancia en Unidad de Cuidados Postanestésicos.
| Grupo | 0’ | 10’ | 30’ | 60’ | 90’ | 120’ |
|---|---|---|---|---|---|---|
| A | 1 | 0.544 | 0.491 | 0.362 | 0.028* | < 0.000 |
| B | 1 | 0.164 | 0.041* | < 0.000 | < 0.000 | < 0.000 |
| C | 1 | 0.041* | 0.004 | < 0.000 | < 0.000 | < 0.000 |
Evaluación de la profundidad de sedación evaluado con la escala de RASS a los 0, 10, 30, 60, 90 y 120 minutos de estancia en UCPA por grupos (grupo A = 1 μg/kg, grupo B = 2 μg/kg, grupo C = 3 μg/kg), realizado por ANOVA.
RASS = R ichmond A gitation- S edation S cale, UCPA = Unidad de Cuidados Posanestésicos, ANOVA = Análisis de varianza.
* Estadísticamente significativo.
Discusión
Novedad en el estudio: no existen estudios previos que valoren estas dosis en ningún tipo de escenario, además de ser el primer estudio que compara buprenorfina en el período postquirúrgico con pacientes despiertos bajo un procedimiento toracoscópico, por ello, no se pueden realizar comparaciones con otros trabajos. Se encontró que utilizar dosis de 1, 2 o 3 μg/kg cuando se analizan las frecuencias presenta un ligero aumento de pacientes con dolor a la utilización de 1 μg/kg, pero no conlleva una mejor analgesia al valorar la significancia estadística.
Eficacia anestésica de la buprenorfina a diferentes dosis con analgesia multimodal: aunque en un inicio se pensaba que la toracoscopía al disminuir la longitud de la herida quirúrgica provocaba muy poco dolor, Bayman8 en el estudio realizado en el 2017, donde se realizaron toracotomías y toracoscopías con intubación selectiva e infiltración de los nervios intercostales y anestesia general balanceada a base de opioides, demostró que la toracotomía y la toracoscopía son cirugías con un nivel de dolor semejante en los primeros tres días con una media para la toracoscopía de 6.5 (dolor intenso) en escala de EVA a los 120 minutos posteriores al ingreso a la UCPA. En este estudio se demostró que el utilizar una analgesia multimodal con bloque intercostal e infiltración de la herida con anestésico local, más el uso de fármacos con sinergia analgésica; como son paracetamol, glucocorticoide, metamizol, opioide transanestésico y buprenorfina antes del egreso mantiene una media de intensidad de dolor entre 2.5 y 2.8, o sea, alrededor de 200% veces menos que lo encontrado por Bayman. Pergolozzi17 en el año de 2012 describió las dosis recomendadas del fármaco para control de dolor postquirúrgico, llegando a utilizar hasta 300 μg por dosis cada seis horas, en el presente estudio se demostró que con dosis bajas del medicamento (1 a 3 μg/kg) es suficiente para un adecuado control del dolor.
Al analizar la cantidad de dolor conforme el paso del tiempo, se encontró que con dosis de 1 μg/kg hay una diferencia estadísticamente significativa en las medias de dolor al ingreso a UCPA y las presentadas al minuto 10 (p = 0.41) en comparación con las otras dosis que lo presentan hasta el minuto 30, por lo que el mantenimiento de analgesia a través del tiempo es más constante con 2 μg/kg (p = 0.019) y 3 μg/kg (p = 0.045).
Sedación con diferentes dosis de buprenorfina: en cuanto a sedación, las frecuencias encontradas al ingreso a la UCPA demuestran menor escala de RASS para los pacientes del grupo C, pero al analizarse diferencias de medias no fue estadísticamente significativo. Al analizarse conforme el paso del tiempo, se encontró que una dosis de 3 μg/kg produce una disminución estadísticamente significativa en la sedación desde el minuto 10 (p = 0.041) a diferencia del grupo de 2 μg/kg que lo presenta al minuto 30 (p = 0.041) y del grupo de 1 μg/kg que lo presenta en el minuto 90 (p = 0.028); así, con dosis de 1 y 2 μg/kg se mantienen con un nivel de sedación similar a la valorada durante el ingreso y durante los 120 minutos de estancia en la UCPA.
Diferencias en los efectos colaterales: se ha descrito que el uso de dosis moderadamente altas de buprenorfina como analgésico postoperatorio producen efectos que van desde náusea hasta depresión respiratoria, en este trabajo se evidenció que a dosis que van de 1 a 3 μg/kg de buprenorfina, con el esquema de analgesia multimodal, no se presentó en ningún caso náuseas/vómitos y/o depresión respiratoria.
Aplicabilidad de la analgesia para pacientes sometidos a procedimientos toracoscópicos: la buprenorfina, por sus propiedades farmacológicas23,24, puede utilizarse en pacientes con daño renal, daño hepático e inmunodeprimidos, por lo que, a diferencia de otros opioides, no constituye peligro con cambios en el funcionamiento fisiológico del paciente en quirófano. La potencia con la que cuenta (30 a 40 veces mayor que la morfina) produce una adecuada analgesia mientras los nervios intercostales sean bloqueados y se ministren diversos medicamentos como paracetamol, dexametasona y metamizol durante la toracoscopía, ya que el estímulo principal es en la zona por donde los trócares y la cámara óptica ingresan a la cavidad torácica.
Costo-efectividad de la analgesia con buprenorfina vs diferente tipo de analgesia en pacientes sometidos a toracoscopía: en México, la Secretaría de Salud elaboró un módulo de estimación de costos que se actualiza aproximadamente cada cinco años. En el 2014, los costos por hospitalización en unidades de terapia intensiva, donde la mayor parte de estos pacientes egresa sobre todo si aún no cuenta con un control adecuado del dolor o está intubado y bajo ventilación mecánica, varían desde $910.00 en salubridad hasta $7,800.00 en un hospital privado tipo A1. Esto sin contar con los gastos inherentes al cuidado de un paciente crítico, con lo que puede aumentar en un 1,000%. Es probable que los pacientes no requieran cuidados intensivos pero sí intermedios si fueron intubados y extubados o presentan analgesia parcial, el monto por cama de terapia intermedia es de $790.00 en salubridad o $7,100.00 en un hospital privado tipo A1 con las mismas consideraciones en cuanto a gastos por hospitalización. Así, contar con un medicamento que provea un buen control del dolor y además ayude a evitar la intubación del paciente para toracoscopía disminuirá importantemente los gastos del paciente en hospitales privados y los gastos subsidiados por los impuestos en hospitales públicos.
Conclusiones
El utilizar una analgesia multimodal durante la cirugía de toracoscopía disminuye un 200% la media para el dolor moderado-severo postquirúrgico inmediato.
Dosis de buprenorfina para prevención de dolor postquirúrgico entre 1 a 3 μg/kg no produce náusea, vómitos, RASH y/o depresión respiratoria.
No existen diferencias estadísticamente significativas entre el nivel de analgesia y/o sedación durante los primeros 120 minutos de ingreso a la UCPA entre las dosis de 1 a 3 μg/kg.
El nivel de mantenimiento de analgesia fue más evidente con dosis de 2 y 3 μg/kg (30 minutos) que con dosis de 1 μg/kg requiriendo mayor rescate analgésico.
La sedación con dosis de 1 μg/kg fue menor y se mantuvo por más tiempo, con dosis de 3 μg/kg se encontró mayor nivel de sedación (sin llegar a sedación profunda) pero con una rápida recuperación.
Al ser una muestra pequeña de pacientes, se requiere un ensayo clínico con mayor número de participantes.











 nueva página del texto (beta)
nueva página del texto (beta)