Introducción
El dolor es un síndrome complejo que causa angustia emocional y física, lo cual produce un impacto fisiológico adverso en varios órganos y sistemas, afectando la recuperación de los pacientes1.
Aunque la manipulación del parénquima cerebral per se no es dolorosa, las bases anatómicas y fisiológicas demuestran que el dolor postquirúrgico experimentado por los pacientes sometidos a craneotomías es de origen somático debido a la manipulación del escalpe (inervación de ramas originadas en el plexo cervical y el nervio trigémino), músculos pericraneales, tejido blando y duramadre (inervada por los nervios que acompañan a las arterias meníngeas)1,2. Sin embargo, el dolor en pacientes pediátricos después de craneotomías aún es subestimado, a causa de la creencia de que los pacientes no experimentan dolor intenso después de este tipo de cirugías.
La Clasificación Internacional de Trastornos de Cefalea publicado por la International Headache Society establece criterios diagnósticos para diferentes cefaleas, ha clasificado el dolor de cabeza postcraneotomía y lo ha subdividido en las variedades agudo y persistente2. Actualmente la evidencia muestra que alrededor de 60% de los pacientes postcraneotomías, experimentan dolor moderado a severo en el postoperatorio inmediato o presentan dolor persistente con elementos neuropáticos varios meses después (dolor crónico)3. En su estudio Bronco y colaboradores encontraron que, a pesar de la aplicación de analgesia multimodal, 16% de los pacientes neuroquirúrgicos pediátricos sufrieron dolor moderado a severo en la sala de recuperación y 6% presentó dolor moderado a severo en el primer y segundo día postquirúrgico4.
La estimulación simpática asociada a dolor puede conducir a hipertensión arterial, agitación, temblores, vómito e incremento de la presión intracraneal, posibles eventos nocivos, principalmente por el riesgo de hemorragia intracraneal postoperatoria5,6, reflejándose en una estancia hospitalaria prolongada que a su vez aumenta los gastos hospitalarios7.
Los opioides parenterales constituyen la piedra angular para el control del dolor moderado a severo, especialmente después de cirugía mayor. No obstante, existe controversia en su uso para analgesia postoperatoria en craneotomías debido al temor de sus efectos colaterales tales como sedación, depresión respiratoria, miosis y náusea, que pueden enmascarar signos de deterioro neurológico y alterar la valoración neurológica temprana, por lo que se requiere precaución en el manejo del dolor postoperatorio, a fin de no interferir en dicha valoración.
En pediatría el manejo del dolor es complejo, dadas las barreras que limitan la adecuada evaluación del dolor postoperatorio, como pueden ser la dificultad para reconocer, valorar y cuantificar la intensidad del dolor, debido a que los niños menores de cuatro años y aquéllos con ciertas afecciones neurológicas y/o intelectuales no son capaces de verbalizar o describir exactamente la magnitud de su dolor8.
En la literatura médica de la especialidad no encontramos ninguna guía de práctica clínica para analgesia postoperatoria en neurocirugía pediátrica. La mayoría de los estudios se han realizado en población adulta.
El objetivo de nuestro estudio es describir la calidad analgésica de buprenorfina en asociación con ketorolaco y ondansetrón, administrado en infusión continua intravenosa en niños sometidos a procedimientos neuroquirúrgicos intracraneales así como describir parámetros hemodinámicos, posible presencia de sedación profunda y eventos adversos.
Métodos
Previa aprobación del Comité de Ética e Investigación del Instituto Nacional de Pediatría y obtención del consentimiento informado de los padres así como asentimiento informado en pacientes mayores de 11 años, se llevó a cabo un estudio de cohorte descriptivo, (observacional, prospectivo, longitudinal y sin grupos comparativos) en el que se incluyeron a todos los niños de 0-17 años programados para cirugía intracraneal electiva en un período de 24 meses de enero de 2015 a diciembre de 2017.
En los criterios de inclusión se consideró a todos los pacientes con estado físico de la Sociedad Americana de Anestesia (ASA por sus siglas en inglés) I-III y escala de coma de Glasgow de 15 puntos previo al evento quirúrgico. Dentro de los criterios de exclusión, se consideraron a niños que requirieron cirugía de urgencia, pacientes bajo tratamiento crónico con algún medicamento que pueda influir en el dolor postoperatorio (antiinflamatorios no esteroideos, opioides, antiepilépticos y neuromoduladores) y se eliminó a quienes se les interrumpió el tratamiento analgésico establecido o requirieron ventilación mecánica en el postoperatorio.
Durante el período intraoperatorio el anestesiólogo proporcionó anestesia total intravenosa (ATIV) con propofol y fentanyl en infusión o anestesia general balanceada, utilizando fentanyl en infusión y sevoflurano. En ambas técnicas anestésicas se administró fentanyl mediante bomba Medex (Medfusion 3500), realizando ATIV manual, calculando una concentración plasmática objetivo entre 0.004-0.006 μg/mL durante el procedimiento quirúrgico. A todos los pacientes se les aplicó bloqueo de escalpe con bupivacaína al 0.25% inmediatamente después de la inducción anestésica.
Para analgesia postoperatoria los pacientes recibieron buprenorfina 6 μg/kg/día + ketorolaco 2 mg/kg/día + ondansetrón 0.3 mg/kg/día en infusión continua intravenosa mediante bomba elastomérica para 30 horas, la cual se inició al ingresar a la unidad de terapia intensiva pediátrica.
Los investigadores realizaron evaluaciones al inicio de la infusión a las cuatro, ocho, 12, 24 y 30 horas, que abarcaron parámetros hemodinámicos tales como frecuencia cardíaca, tensión arterial y saturación de oxígeno así como valoración del dolor mediante diferentes escalas de acuerdo a la edad del paciente. En los niños menores de cuatro años se aplicó la escala Face-Legs-Activity-Cry-Consolability (FLACC)9, en los niños de cinco a siete años la Escala Facial de Dolor de Wong-Baker10,11 y en mayores de siete años la escala visual analógica (EVA)11. Las tres escalas se evalúan estableciendo un valor numérico entre 0-10, tomando como punto de corte un valor ≥ 4 puntos. Asimismo, se registró la presencia de eventos adversos y el puntaje de la escala de Ramsay para evaluar presencia y profundidad de sedación.
En el análisis estadístico se describió la distribución univariada con todas las variables; en caso de que la discrepancia ante el modelo normal se considere importante, se reportó la mediana y amplitud intercuartil. Para las variables cuantitativas se describió su resumen por media y desviación estándar. Con respecto a las variables cualitativas se reportaron las frecuencias absoluta y relativa. Para las escalas de dolor y la escala de Ramsay se establecieron los casos con dolor intenso y sedación profunda de acuerdo con los puntos de cortes establecidos para cada escala. Se determinó la correlación entre las variables de dolor con las variables hemodinámicas por medio del coeficiente de correlación de Spearman. Se evaluó la asociación entre las variables preoperatorias (edad, sexo y tipo de cirugía) con las escalas de dolor por el modelo lineal general. Los parámetros estimados se reportaron con el intervalo de confianza de 95% y la significancia estadística se reconocerá al nivel de α < 0.05. Con las asociaciones analizadas estadísticamente no significativas se realizó el análisis de poder post-hoc, estableciendo como criterio del nivel de poder estadístico suficientemente alto1- β > 0.8. Todos los análisis estadísticos se hicieron con el paquete estadístico comercial JMP10 de SAS Institute, Inc.
Resultados
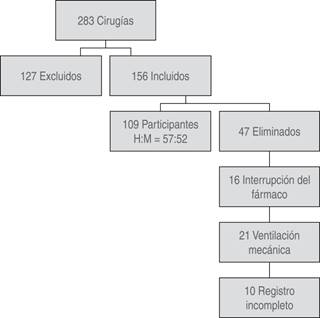
Durante el período establecido, 283 pacientes fueron sometidos a craneotomías, de los cuales 127 pacientes fueron excluidos. Se incluyeron en la muestra del estudio 156 pacientes, de los que se eliminaron 47 (Figura 1).
De los 109 pacientes estudiados, 52 fueron femeninos y 57 masculinos. La edad media fue de cuatro años ocho meses, con un rango de tres meses a 16 años. El peso promedio fue de 21.4 kg (Tabla 1).
Tabla 1: Datos demográficos y características clínicas.
| Error estándar | Mediana | Amplitud intercuantil 25-75% | ||
|---|---|---|---|---|
| Edad (meses) | 58.06 ± 56.95 | 5.45 | 25 | 11.5-101.5 |
| Peso (kg) | 21.4 ± 18.7 | 1.70 | 13-35 | 8.3-28.5 |
| Tiempo quirúrgico (min) | 241.11 ± 90.48 | 8.66 | 240 | 180-280 |
| Tiempo anestésico (min) | 362.02 ± 94.8 | 9.08 | 360 | 300-400 |
| Sangrado (mL) | 434.67 ± 427.15 | 40.91 | 310 | 220-500 |
| Tasa de fentanyl (μg/kg/h) | 4.62 ± 1.23 | 0.11 | 4.4 | 3.8-5 |
| Dosis total de fentanyl (μg) | 527.77 ± 523.4 | 50.13 | 119 | 196.1-641 |
| Total dosis de rescate | 1 ± 1.29 | 0.12 | 0-2 |
Los diagnósticos de los pacientes incluyeron: craneosinostosis 58 (53.2%), tumores de fosa posterior 27 (24.7%), craneofaringioma 7 (6.4%), otros supratentoriales (tumores interventriculares, lesiones en cíngulo e hidrocefalias) 17 (15.5%). El tipo de cirugía que más se realizó fue la supratentorial (Tabla 2).
Tabla 2: Análisis univariable de la población de estudio.
| Control adecuado del dolor | Sin control del dolor | Total de la muestra | p | OR | |
|---|---|---|---|---|---|
| Pacientes n (%) | 78 (71.56) | 31 (28.40) | < 0.0001 | ||
| Sexo n (%) | 0.17 | 1.8 | |||
| Femenino | 41 (78.84) | 11 (21.15) | 52 (47.7) | ||
| ;Masculino | 37 (64.10) | 20 (35.00) | 57 (52.2) | ||
| ASA n (%) | 0.97 | ||||
| 1 | 3 | 1 | 4 (3.6) | ||
| 2 | 64 | 25 | 89 (81.6) | ||
| 3 | 11 | 5 | 16 (14.6) | ||
| Diagnóstico n (%) | 0.32 | ||||
| Craneosinostosis | 38 (65.50) | 20 (34.40) | 58 (53.2) | ||
| Tumor de fosa posterior | 20 (74.04) | 7 (25.90) | 27 (24.7) | ||
| Craneofaringioma | 6 (85.70) | 1 (14.20) | 7 (6.4) | ||
| Otras | 14 (82.35) | 3 (17.60) | 17 (15.5) | ||
| Tipo de cirugía n (%) | 0.78 | 1.27 | |||
| Supratentorial | 72 (71.20) | 29 (28.70) | 101 (92.6) | ||
| Infratentorial | 6 (75.00) | 2 (25.00) | 8 (7.3) | ||
| Tipo de anestesia | 0.4 | 0.69 | |||
| Anestesia total intravenosa | 51 (75.0) | 17 (25.00) | 68 (62.3) | ||
| Anestesia general | 27 (65.80) | 14 (34.15) | 41 (37.6) | ||
| Vómito n (%) | 0.33 | 2.6 | |||
| Presencia | 1 (3.13) | 6 (7.79) | 7 (6.4) | ||
| Ausencia | 30 (96.80) | 72 (92.3) | 102 (93.58) | ||
| Náusea n (%) | 0.61 | 1.5 | |||
| Presencia | 2 (6.25) | 7 (9.09) | 9 (8.2) | ||
| Ausencia | 29 (93.54) | 71 (91.0) | 100 (91.7) |
n = número de pacientes.
Al tomar en consideración el puntaje en las escalas, junto con el comportamiento hemodinámico a las cuatro, ocho, 12, 24 y 30 horas de la infusión se observó que con la combinación de buprenorfina-ketorolaco hubo un adecuado control del dolor en 78 pacientes (71.56%), mientras que en 31 (28.4%) se encontró inadecuado control del dolor, con una diferencia estadísticamente significativa (p < 0.001) (Figura 2 y Tabla 2).
La evaluación del grado de sedación se realizó utilizando la escala de Ramsay. Se observó sedación moderada en 5.6% de los pacientes al inicio de la infusión y a las 24 horas (4.5%), sin repercusión significativa en las variables hemodinámicas como FC, saturación y tensión arterial. Sólo se reportó incidencia de un paciente con somnolencia (0.9%) sin requerir administración de fármaco antagonizante de opioide o maniobras adicionales (Figura 3).

Figura 3: Grado de sedación mediante la escala de Ramsay, durante la infusión de buprenorfina y ketorolaco para manejo del dolor postoperatorio.
Dentro de los efectos colaterales se encontró náusea en 9 pacientes (8.2%) y vómito en 7 (6.64%); no se presentó prurito, retención urinaria, sedación profunda, depresión respiratoria ni alteración neurológica (Figura 4 y Tabla 3).
Tabla 3: Relación de efectos secundarios.
| Variable | Náusea | p < 0.05 | Vómito | p < 0.050 |
|---|---|---|---|---|
| Sexo | Hombres | 0.837 | Hombres | 0.790 |
| Diagnóstico | Otros | 0.126 | Otros | 0.028 |
| Tipo de rescate | Combinado | 0.177 | Combinado | 0.376 |
| ASA | III | 0.254 | III | 0.1424 |
| Anestesia | TIVA | 0.302 | TIVA | 0.158 |
| Dolor | No controlado | 0.614 | Controlado | 0.334 |
Para el análisis univariable se dividió a la población en dos grupos: grupo 1: pacientes con control adecuado del dolor, grupo 2: pacientes sin control del dolor. El análisis univariable mostró una p > 0.05 en las variables de género, estado físico de ASA, diagnóstico, tipo de cirugía, náusea y vómito, no encontrando diferencia significativa en éstas (Tabla 2).
En ambos sexos hubo adecuado control del dolor, con un porcentaje mayor en el sexo femenino. Con respecto al estado físico de ASA, se notó una relación directamente proporcional entre control inadecuado del dolor y mayor puntaje en el estado físico del ASA.
En relación al tipo de cirugía se apreció menor control del dolor en los pacientes sometidos a remodelación craneal por craneosinostosis y cirugía supratentorial (Tabla 2).
Con respecto a la técnica anestésica, se observó un mejor control del dolor, en los que recibieron anestesia total intravenosa.
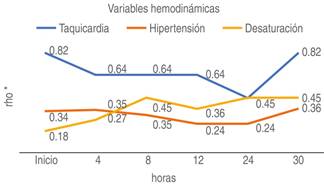
El tiempo total de la infusión fue de 30 horas, observándose que a las cuatro y 24 horas, los pacientes mostraron mayor puntaje en las escalas de dolor, sin relación con descontrol de las variables hemodinámicas, es decir, no se detectó hipertensión, desaturación ni taquicardia (Figura 5). El puntaje superior a las cuatro horas puede ser debido a presencia de irritabilidad o ansiedad, ya que no se observó descontrol en las variables hemodinámicas.
A los pacientes registrados con inadecuado control del dolor (31 pacientes), se les dio dosis de rescate con buprenorfina IV y/o paracetamol, previamente valorado por el médico intensivista tratante.
Concerniente a los rescates otorgados a los pacientes con un control inadecuado, se notó que fueron necesarios a partir de las 20 horas de la infusión (Figura 6). El número de rescates fueron de 1-3, con una media de 2. La población que recibió rescates con buprenorfina IV fueron 14 (12.8%), 5 (4.5%) con paracetamol IV y 9 (8.2%) con ambos fármacos. Tres pacientes (2.7%) obtuvieron una calificación en las escalas de dolor de 6, en una sola ocasión, por lo que se catalogaron como «sin control del dolor»; sin embargo, no recibieron rescates adicionales y en el resto de las evaluaciones obtuvieron una calificación de 0 en las escalas de dolor.

Figura 6: Comportamiento del dolor durante la infusión analgésica en pacientes con control inadecuado.
A pesar del uso de rescates con buprenorfina no se encontró sedación profunda en los pacientes.
Los niños que requirieron mayor número de rescates fueron aquéllos con diagnóstico de craneosinostosis y cirugía supratentorial.
Discusión
Existe controversia en cuanto al uso de opioides para manejo del dolor postoperatorio de pacientes neuroquirúrgicos, por una parte, algunos anestesiólogos se oponen al uso de opioides debido al riesgo de efectos adversos, pero por otra parte, se ha reportado la presencia de hipertensión arterial, agitación, vómitos, temblores y ansiedad en aquellos pacientes con control inadecuado del dolor, lo que puede condicionar aumento de la presión intracraneal y hemorragia, mermando la recuperación y el resultado postquirúrgico.
Hay evidencia en varios estudios prospectivos en adultos que confirman la experiencia de dolor moderado a severo en aproximadamente 60% de los pacientes después de una craneotomía, que puede persistir más allá del período postoperatorio inmediato3,7,12-14.
En la actualidad encontramos pocos estudios enfocados en evaluar la incidencia y severidad del dolor postoperatorio en pacientes pediátricos después de cirugía craneal4,15, así como un número limitado de estudios que reporten el uso de opioides en niños sometidos a craneotomías.
Los opioides parenterales constituyen la piedra angular para el manejo del dolor moderado a severo, especialmente después de cirugía mayor. El dolor nociceptivo suele responder bien a los opioides.
Algunos estudios publicados en población pediátrica han examinado el uso de opioides para craneotomías, entre ellos: fentanyl-midazolam8, tramadol-fentanyl16, morfina17, codeína18, hidromorfona, oxicodona19, fentanyl, tramadol, morfina20 con resultados variables, pero ninguno que documente el uso de buprenorfina, ketorolaco y ondansetrón para este tipo de intervención quirúrgica.
Nuestro estudio de cohorte observacional prospectivo reveló una alta incidencia de control adecuado de dolor postquirúrgico (78%) con la combinación de buprenorfina y ketorolaco en infusión. La administración en infusión continua permite a los pacientes tratar su dolor sin la presencia de picos y valles farmacológicos, ya que mantiene una concentración plasmática continua. La administración sistémica intermitente de y PRN (Pro re nata) ha sido un método estándar para la analgesia postoperatoria1,3, pero estas estrategias pueden ocasionar períodos de sobresedación (efecto opiáceo pico), seguido de períodos de analgesia inadecuada (efecto opiáceo final)1.
Maxwell y colaboradores realizaron un estudio donde se evaluaron las terapias analgésicas de tres hospitales pediátricos universitarios de Estados Unidos, reportando en uno de los centros el uso de hidromorfona, fentanyl o morfina en infusión IV, concomitante con una infusión de naloxona a dosis baja (1-1.5 μg/kg/h) como profilaxis para limitar los efectos colaterales inducidos por los opioides19. En nuestro estudio no se apreció sedación profunda con el uso de buprenorfina que interfiriera en el examen neurológico, sólo se notó un paciente con somnolencia que no requirió administración de fármaco antagonizante de opioides. Se observó la presencia de sedación moderada al inicio de la infusión y a las 24 horas. La concentración plasmática promedio de fentanyl al final de la cirugía fue de 0.00462 μg/mL, dosis adecuada para el inicio de la infusión, permitiendo una continuidad del manejo del dolor a base de opioide. La presencia de sedación moderada al inicio de la infusión puede ser por el sinergismo con el efecto residual de fentanyl. En estudios posteriores se debe evaluar la causa desencadenante del pico de dolor a las 24 horas. Aunque más que dolor, se puede tratar de cierto grado de irritabilidad, ya que no hubo cambios en las constantes vitales. Tampoco requirieron administración de naloxona los pacientes que recibieron rescates de buprenorfina IV.
Otro de los efectos adversos temidos de los opioides es náusea y vómito. La presencia de náusea y vómito en nuestro estudio es muy baja, 8.2 y 6.64% respectivamente, a diferencia de la reportada en otros centros hospitalarios con el uso de opioides para analgesia: The Johns Hopkins Hospital (náusea 56% y vómito 33%); The Boston Children’s Hospital (náusea 53% y vómito 58%); The Children’s Hospital of Philadelphia (náusea 42%, vómito 66%)19. Esto nos indica que al administrar ondansetrón en infusión continua para mantener una dosis constante podemos reducir la incidencia de náusea y vómito al utilizar opioides en este tipo de cirugías. En el estudio realizado por Xing y colaboradores3 se compararon tres regímenes de analgesia postoperatoria para craneotomías que incluyó fentanyl, morfina y tramadol así como un grupo control al que se le administró solución salina. Todas las bombas analgésicas se prepararon para 50 horas y contenían además 0.4 mg/kg de ondansetrón. En este estudio se reporta una incidencia de náusea de 27.5% y vómito de 47.5% en el grupo que recibió tramadol. Nosotros encontramos una incidencia muy baja de náusea y vómito postoperatorio al utilizar buprenorfina en combinación con ondansetrón, lo que puede sugerir que, además de ser importante la administración en infusión continua, también influye la dosis del antiemético así como el opioide que se elija en este tipo de cirugías.
Una de las estrategias actuales para abordar el control del dolor es la analgesia multimodal. Este concepto implica que la asociación de diferentes intervenciones analgésicas por diferentes vías, consiguen una efectividad mayor sobre su utilización única, disminuye los efectos secundarios y aumenta la satisfacción de los pacientes, especialmente porque los efectos de un enfoque multimodal se consideran sinérgicos más que aditivos21. La analgesia multimodal se recomienda para el manejo del dolor perioperatorio pediátrico22. En este estudio se añadió la infusión ketorolaco, lo que permite disminuir dosis y en consecuencia efectos secundarios, otra estrategia multimodal incluyó el uso de bloqueo de escalpe previo a la insición quirúrgica.
Uno de los posibles riesgos del uso de antiinflamatorios no esteroideos (AINEs) en neurocirugía craneal es la disminución de la función plaquetaria, lo que podría condicionar hemorragia. No obstante, ninguno de los pacientes en nuestro estudio presentó sangrado postoperatorio. En estudios previos se ha valorado el uso de ketorolaco en infusión y por horario establecido durante las primeras 24 horas del postoperatorio sin detectar hemorragia postoperatoria como evento adverso5,23. Sin embargo, para establecer un perfil de seguridad de los AINEs en este tipo de cirugías es necesario un mayor número de pacientes.
Referente al tipo de cirugía, encontramos menor control del dolor en las cirugías supratentoriales, lo cual se reflejó en las escalas de dolor y en el requerimiento de dosis de rescate con buprenorfina; sin embargo, en la población de estudio hubo mayor número de pacientes con este tipo de abordaje.
La buprenorfina es de interés en el control del dolor postoperatorio y oncológico pediátrico debido a su larga duración de acción y metabolismo en gran parte independiente de la función renal, aunque son escasamente descritos los parámetros farmacocinéticos y farmacodinámicos en niños24. Una revisión retrospectiva de sobredosis de buprenorfina en 54 niños reportada por los centros de envenenamiento de Estados Unidos revela que los niños que ingirieron > 2 mg de buprenorfina tuvieron más probabilidades de experimentar algún efecto clínico, ningún niño que ingirió < 4 mg experimentó un efecto severo25. Gracias al amplio rango de seguridad de buprenorfina de presentar eventos adversos es una opción adecuada en craneotomías, ya que se desea evitar sobresedación, náusea y vómito que interfiera con una valoración neurológica temprana.
Al administrar los fármacos en una infusión disminuimos costos, puesto que otorgarlos por separado implica la disponibilidad de tres bombas para cada paciente, lo cual en el contexto de varios hospitales de Latinoamérica es complicado.
Este esquema analgésico se ha utilizado por varios años en nuestro centro de trabajo, por lo que consideramos pertinente realizar este estudio para observar los alcances y limitaciones de dicha terapia analgésica.
Conclusiones
El dolor postcraneotomía en pediatría es un problema clínico desafiante, a través de una estrategia multimodal se puede obtener un alivio apropiado del dolor. Los resultados del actual estudio sugieren que el uso de buprenorfina, ketorolaco y ondansetrón en infusión es una opción efectiva para tratar el dolor en este tipo de pacientes, debido a que no ocasionó depresión respiratoria o sedación excesiva que imposibilite una valoración neurológica adecuada, además la presencia de náusea y vomito fue muy baja.
Se requiere un tamaño mayor de muestra para obtener mejor validez del estudio y compararlo con otras terapias analgésicas.











 nueva página del texto (beta)
nueva página del texto (beta)