Manejo hemodinámico, casos clínicos durante la guardia COVID-19
El primer llamado de enfermería. Masculino de 59 años, antecedente de hipertensión, COVID-19 +, infiltrados bilaterales. Requirió intubación hace 48 horas y ahora se encuentra hipotenso con TA 89/45 mmHg y con 2 horas de oliguria, en estos momentos con una SO2 de 85% que minutos antes se encontraba en 94% con mismo FiO2 de 65% y PEEP de 12 cmH2O, la SvcO2 55%. El residente de guardia cuestiona la posibilidad de evaluar la variabilidad de la presión de pulso o una prueba de levantamiento de pies para decidir administrar un reto de volumen de 30 mL/kg de peso.
El segundo llamado de enfermería es por un ingreso. Paciente masculino de 71 años con diagnóstico de COVID-19 +, lleva tres días con fiebre de 38 oC, disnea Borg 5 de 6, dolor torácico. La PCR es de 180 mg/dL y la ferritina 780 pg/dL. TA 75/40, frecuencia cardíaca de 130 por minuto. Se ha solicitado la evaluación del equipo ECMO venoarterial.
En caso de hipotensión, recomendamos un reto de vasopresores con principio fisiológico: los pacientes COVID-19 pueden desarrollar síndrome de insuficiencia respiratoria aguda (SIRA), el cual tiene cuatro momentos críticos1 a nivel hemodinámico hasta donde sabemos. El primero de ellos es una vasoconstricción pulmonar hipóxica2 (VCPH), la cual puede ocasionar hipertensión pulmonar y, a su vez, disfunción del ventrículo derecho. Éstas dos últimas situaciones pueden hacer que el paciente sea muy poco tolerante a cargas de volumen intravascular, lo que se puede evidenciar fácilmente por ultrasonido al encontrar un ventrículo derecho del mismo tamaño o mayor que el ventrículo izquierdo, junto con una vena cava inferior dilatada y sin colapso3. El segundo tipo de crisis hemodinámica de estos pacientes es cuando se encuentran en la llamada «tormenta de citoquinas»4, la cual está caracterizada por niveles de interleucina 6 altos, proteína C reactiva > 100 mg/dL, ferritina > 600 μg, y eventos sostenidos de fiebre > 38 oC, la cual puede causar un estado de sepsis, vasodilatación y/o depresión miocárdica, incluyendo ruptura de placas ateromatosas en coronarias que lleven a infarto agudo de miocardio. El tercero5,6 son crisis relacionadas con eventos trombóticos, como la tromboembolia pulmonar, que se ha asociado a niveles de dímero D alto al ingreso de estos pacientes. El cuarto y más grave evento de crisis hemodinámica de estos pacientes es un cuadro de choque cardiogénico, causado por una miocarditis fulminante viral7.
Por lo tanto, no recomendamos hacer ninguna prueba estática o dinámica de respuesta a volumen por dos motivos: en primer lugar, los pacientes con algún grado de hipertensión pulmonar difícilmente son respondedores a volumen. Segundo y más importante, todas las pruebas dinámicas y/o estáticas de respondedor a volumen carecen de validez fisiológica8 en escenarios de hipertensión pulmonar. De hecho, la variabilidad de la presión de pulso puede verse aumentada como dato de disfunción de ventrículo derecho y no como un dato de respuesta a volumen9.
Evaluación del paciente 1. Por lo anterior, se decide no administrar volumen al paciente e iniciar norepinefrina a 0.03 μg/kg/min, con lo cual la presión mejora a 111/75 mmHg y con ello sin realizar cambios en el ventilador la SaO2 mejora a 91%, lo que es una evidencia indirecta de que el aumento de presión arterial sistémica ha redistribuido el flujo de la circulación pulmonar y mejora el trastorno V/Q, en especial las áreas de bajo V/Q.
Si el escenario no es una tormenta de citocinas, la meta es lograr balances negativos, para lo cual empleamos el protocolo FACTT simplificado10 de restricción de volumen y empleo de diurético.
Protocolo FACTT simplificado10:
Descontinúe fluidos de mantenimiento.
Dilución de medicamentos en la menor cantidad compatible posible.
No limite los requerimientos de nutrición enteral.
Utilice vasopresores en caso de PAM < 60 mmHg.
| PAM > 60 mmHg | ||
|---|---|---|
| PVC en mmHg | Diuresis < 0.5 mL/kg/h | Diuresis < 0.5 mL/kg/h |
| > 8 | Furosemida* 3 mg/h en infusión revalorar en 1 hora | Furosemida** 20 mg revalorar en 4 horas |
| 4-8 | Ringer lactato 15 mL/kg peso revalorar en 1 hora | Furosemida** 20 mg revalorar en 4 horas |
| < 4 mmHg | Ringer lactato 15 mL/kg peso revalorar en 1 hora | Revalorar en 4 horas |
* Si el paciente se encuentra recibiendo esa dosis o mayor, duplique la dosis hasta un máximo de 24 mg/h.
** Si el paciente ha recibido esa dosis de bolo o mayor, duplique la dosis hasta un máximo de 160 mg.
No exceda la dosis total de 620 mg/día de furosemida.
Ante creatinina sérica ≥ 3 mg/dL durante el protocolo, evalúe la necesidad de hemodiálisis.
Recomendamos preferir reto de vasopresor antes que reto de volumen para revertir eventos de hipotensión.
No recomendamos la realización de pruebas dinámicas o estáticas para evaluar respuesta a fluidos.
Recomendamos el protocolo FACTT simplificado para el manejo de volumen en pacientes con ARDS por COVID-19 que no se encuentren en eventos de tormenta de citocinas.
Evaluación del paciente 2. Los pacientes COVID-19 en crisis de tormenta de citocinas pueden ser ubicados en el fenotipo inflamatorio11 de ARDS y se ha descrito que este grupo no se beneficia de restricción de volumen12. Por el tiempo de duración de la fiebre, la estimación del déficit de volumen se inicia con un bolo de solución Ringer lactato de 250 mL, al mismo tiempo que norepinefrina. De manera empírica recomendamos reto de volumen, sólo mientras se tenga presión venosa central < 8 mmHg.
• El equipo de intubación se prepara para realizar laringoscopía directa. Algunas recomendaciones hemodinámicas.
Norepinefrina13 puede redistribuir el flujo pulmonar, lo que disminuiría la hipertensión pulmonar, que es una de las causas de hipotensión de estos pacientes, pero dosis altas de norepinefrina pueden, por el contrario, exacerbar la hipertensión pulmonar, por lo que recomendamos antes de usar dosis altas de norepinefrina agregar vasopresina,14 la cual tiene una menor repercusión en la presión arterial pulmonar. Por otro lado, desde el punto de vista hemodinámico, recomendamos el empleo de fármacos de inducción con mínimos efectos hemodinámicos, que pueden consultarse en otros escritos al respecto.
Evolución del paciente 2. Se realiza carga de volumen 250 mL, se inician vasopresores, así como ventilación mecánica, el paciente presenta TA 90/77 mmHg, FC 110 por minuto, SaO2 94%, SvcO2 60%, lactato 8 mmol/L.
Es importante en lo posible contar con una evaluación ecocardiográfica. El manejo hemodinámico de estos pacientes se determina adecuado si se reduce el grado de hipertensión pulmonar y/o disminuye el tamaño del ventrículo derecho como respuesta a cada intervención. La presencia de cor pulmonale (hipertensión pulmonar) puede sospecharse mediante una escala diseñada por el grupo de trabajo de Vieillard-Baron15:
La presencia de > 2 puntos en la escala de cor pulmonale (Tabla 1) debe advertir de la presencia de algún grado de hipertensión pulmonar, y éste es el grupo de mayor mortalidad en pacientes con SIRA. En estos pacientes debe mantenerse el equilibrio de PaCO2 < 48 mmHg junto con presión meseta < 27 cmH2O y una relación meseta-PEEP < 18 cmH2O. Las cuales deben considerarse como parte de la estrategia hemodinámica de protección del ventrículo derecho16.
Tabla 1: Escala pronóstica de cor pulmonale en SIRA15.
| Parámetro | Puntos |
|---|---|
| Neumonía como causa de SIRA | 1 |
| Meseta-PEEP > 18 cmH2O | 1 |
| PaO2/FiO2 < 150 | 1 |
| PaCO2 > 48 mmHg | 1 |
| Total | 0-4 |
SIRA = síndrome de insuficiencia respiratoria aguda; PEEP = presión positiva al final de la expiración.
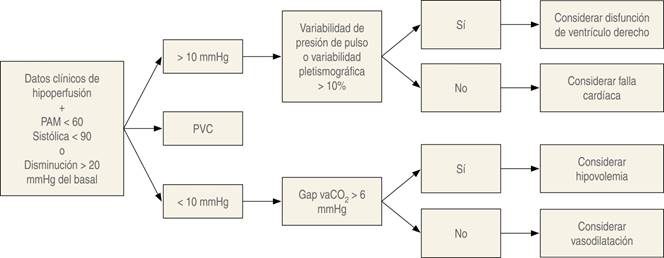
Sospecha de hipoperfusión
Criterios clínicos:
Criterios gasométricos de bajo gasto:
Ante un criterio clínico más un criterio gasométrico, o tres criterios clínicos o los dos gasométricos, la probabilidad de hipoperfusión es muy alta.
Ante estos casos recomendamos los algoritmos de las Figuras 1 y 2 como una guía de abordaje. En caso de que el monitoreo ecocardiográfico o mínimamente invasivo no sea suficiente, y en especial en los casos donde se considere inodilatadores de arteria pulmonar, sugerimos monitoreo mediante catéter de arteria pulmonar.
Evolución paciente 2. El paciente continuó con deterioro hemodinámico, se inició dobutamina a ocho gammas, se reporta: SvcO2 58%, TA 90/45, FC 120 por minuto, lactato 12 mmol/L. Se evalúa el inicio de ECMO VA por choque cardiogénico. Nosotros solicitamos la evaluación de un neumólogo con experiencia en hipertensión pulmonar para valorar fármacos de vasodilatación pulmonar.
Recomendamos:
Evaluación ecocardiográfica siempre que sea posible.
Ante eventos de tormenta de citocinas, recomendamos no seguir estrategias de restricción de líquidos, pero regresar a éstas una vez que se controle el evento.
Evaluar el empleo de norepinefrina + vasopresina antes que dosis altas de norepinefrina en el manejo de hipotensión asociada con crisis de vasoconstricción pulmonar hipóxica.
Un reto de inotrópico si continúa el deterioro hemodinámico con SvcO2 < 60% y/o Gap vaCO2 > 6 mmHg, así como seguimiento por parámetros de SvcO2 y Gap vaCO2 para evaluar respuesta terapéutica.
Recomendamos en casos que persistan con deterioro hemodinámico atribuibles a hipertensión pulmonar la pronta consulta con expertos en hipertensión pulmonar, para evaluar terapias de vasodilatación pulmonar como óxido nítrico, iloprost, etcétera, y considerar el uso de monitoreo avanzado invasivo de la presión de la arteria pulmonar.
Conclusión
Seguir protocolos bien estructurados puede ayudar a que rápidamente nos demos cuenta en dónde estamos equivocados, así como la dirección y magnitud de nuestro error. Por el momento, damos una base de lo que fisiológicamente hace sentido y esperamos pronto poder tener el pilar faltante de la estadística para respaldar este abordaje. Por lo pronto, si estas discusiones le ayudan a abordar mejor a los pacientes que están bajo su cargo, el trabajo a marchas forzadas empleado en redactarlas, habrá valido la pena con creces.











 nueva página del texto (beta)
nueva página del texto (beta)